Einer Grippe läßt sich am besten mit einer Grippeschutzimpfung vorbeugen. Derzeit wird die Impfung für ältere und chronisch kranke Menschen sowie für Mitarbeiter im Gesundheitswesen und verwandten Berufen empfohlen. Neue intranasal applizierbare Vakzine sind in der Entwicklung und erfolgreich getestet worden (1). Sollten sich solche Spray-Vakzine bewähren, wird die Akzeptanz der Impfung sicherlich steigen, und Influenza-Pandemien kann dann wirksamer Einhalt geboten werden. Trotz der nachgewiesenen Wirksamkeit der Grippeschutzimpfung, bleiben jedoch Lücken bestehen. So können manche gefährdete Menschen nicht geimpft werden, weil sie gerade an einem anderen Infekt leiden oder eine Allergie gegen Hühnereiweiß haben. Auch kann der aktuelle Impfstoff unzureichend sein, wenn kurz vor der Grippesaison eine neue Virusvariante auftaucht, die nicht durch die Vakzine abgedeckt ist.
Diese Überlegungen haben zur Entwicklung von Influenza-Virustatika geführt, die nun in Deutschland zugelassen und überall in der Laienpresse als „Durchbruch in der Grippebehandlung“ angepriesen werden. In Wahrheit gibt es derartige Grippemittel jedoch schon seit über 20 Jahren. Mit dem virustatisch wirksamen Parkinson-Mittel Amantadin kann eine Influenza A in der frühen Infektionsphase effektiv eingedämmt werden. Amantadin ist für diese Indikation in Deutschland auch zugelassen. Das Problem dieser Substanz liegt in den häufigen unerwünschten Wirkungen (ZNS), einer raschen Resistenzentwicklung und der fehlenden Wirksamkeit gegen Influenza B.
Das Neue an den jetzt propagierten Grippemitteln Zanamivir und Oseltamivir ist, daß sie gegen die Viren der Influenza A und B wirken und besser verträglich sind. Beide Substanzen hemmen spezifisch das Enzym Neuraminidase, das für die Verbreitung der Grippeviren im Wirt notwendig ist.
Therapiestudien: Der erste für die Behandlung der unkomlizierten Influenza zugelassene Neuraminidase-Inhibitor ist Zanamivir. Es wird unter dem Markennamen Relenza als „Diskhaler“ verkauft. Eine Therapieeinheit (Rotadisk) mit 100 mg Wirkstoff kostet etwa 60 DM. Grundlage der Zulassung in den USA waren 3 Phase-III-Studien mit insgesamt 1588 Patienten (2). Die einzige bislang komplett veröffentlichte Studie (3) wurde im Winter 1997 durchgeführt. Dabei zeigte sich, daß bei 455 Patienten, die spätestens 36 Stunden nach Auftreten der ersten Grippesymptome mit 2 mal 10 mg Zanamivir/d oder Plazebo 5 Tage lang behandelt wurden, durch das Verum im Mittel 1,5 Tage früher Symptomfreiheit erzielt werden konnte (5 vs. 6,5 Tage). Der Behandlungseffekt war jedoch bei Patienten mit nur leichten Symptomen und bei spätem Therapiebeginn gering bis nicht vorhanden. Zudem waren die Ergebnisse der 3 Studien hinsichtlich der Effektivität bei den durch die Grippe besonders gefährdeten Patienten (Asthma, Emphysem, Herzkrankheit, Alter > 65 Jahre) uneinheitlich. Nur in einer Studie (2) fand sich bei diesen Patienten ein signifikanter Nutzen von Zanamivir; die anderen beiden Studien zeigten nur einen geringen Vorteil oder sogar einen nicht signifikanten Nachteil durch die Verum-Gabe. Gesundheitsökonomisch bedeutsame Aspekte wie Krankenhausaufenthalte oder Arbeitsausfallzeiten waren jeweils kein Studienendpunkt oder die Patientenzahlen waren viel zu gering (z.B. zur Beurteilung der Letalität).
Die zweite, kurz vor der Zulassung stehende Substanz ist Oseltamivir. Sie wird unter dem Namen Tamiflu als oral zu nehmendes Mittel vertrieben werden; der Preis ist noch nicht bekannt . Zwei Therapiestudien haben in den USA zur Zulassung geführt, jedoch ist keine dieser Studien bislang komplett nachzulesen. In einer kleineren Untersuchung mit experimentell induzierter Influenza (4) zeigte sich, daß nach Gabe von Oseltamivir (bis 26 Stunden nach der Infektion, 5 Tage lang) geringere Krankheitssymptome auftraten. Laut Gutachten der FDA soll in den noch nicht komplett publizierten Phase-III-Studien der Krankheitsverlauf in den Oseltamivir-Gruppen um etwa 1,3 Tage kürzer gewesen sein (2). Besonders bemerkenswert ist auch hier der Hinweis in der amerikanischen Fachinformation, daß eine Wirksamkeit bei Patienten mit chronischen Herz- und/oder Lungenkrankheiten nicht nachgewiesen ist (5).
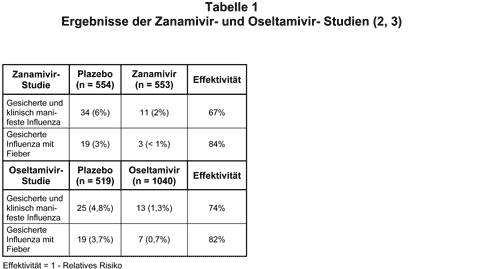
Prophylaxe: Die Studien zur Grippeprophylaxe sind ausführlicher publiziert und daher besser zu beurteilen. In der größten Zanamivir-Studie (6) inhalierten 1107 vorwiegend junge, gesunde Probanden zu Beginn einer Grippeepidemie (1997/98) 28 Tage lang prophylaktisch täglich 2 mal 10 mg Zanamivir-Pulver, und in der Oseltamivir-Studie (7) nahmen 1562 vorwiegend junge und gesunde Freiwillige ebenfalls zu Beginn der Influenza-Epidemie 1997/98 6 Wochen lang täglich 75 bzw. 150 mg Oseltamivir in Kapseln ein. In beiden Studien war das Design plazebokontrolliert, doppelblind und randomisiert. Es wurden sowohl klinische (Tagebuch, Visiten) als auch serologisch/virologische Kontrollen (Nasenabstriche mit Viruskultur und Antikörpertiter im Serum) durchgeführt.
Beide Substanzen waren bei der gewählten Studienpopulation etwa gleich wirksam in der Prophylaxe einer Grippeerkrankung (Tab.1). Die Wirkung von Oseltamivir war in beiden gewählten Dosierungen gleich, so daß beide Dosierungs-Gruppen hier zusammengefaßt werden.
Unerwünschte Wirkungen: Zanamivir hat in der geprüftenen Dosierung (2 mal 10 mg/d; alle Therapiestudien zusammengefaßt) gegenüber Plazebo nicht vermehrt zu unerwünschten Wirkungen geführt (8). Allerdings ist darauf hinzuweisen, daß die Sicherheit bei Patienten mit chronischen Lungenerkrankungen noch unklar ist. In Einzelfällen kann die Inhalation des Pulvers einen Asthmaanfall auslösen und bei 10-15% der Asthmatiker sinkt die Ein-Sekunden-Kapazität um mehr als 20% ab (2). Zanamivir passiert die Plazenta und tritt in die Muttermilch über; daher sollten Schwangere und Stillende kein Zanamivir einnehmen.
Aus den gepoolten Daten der Phase-III-Studien (5) zur Behandlung mit Oseltamivir geht hervor, daß diese Substanz Übelkeit (9,9%), Erbrechen (9,4%) und Schwindel (1%) verursachen kann. Schwangere sollten das Mittel nicht einnehmen, da es Hinweise auf fetale Skelettanomalien gibt. Das gleiche gilt für Stillende da Oseltamivir in die Muttermilch übertritt.
Die häufig geäußerte Annahme, daß sich gegen Neuraminidase-Hemmer keine Resistenz entwickelt, mußte mittlerweile revidiert werden. So hat sich in mindestens einem Fall unter laufender Therapie mit Zanamivir bei einem immunsupprimierten Patienten, vermutlich durch Mutation, eine neue Virusvariante gebildet (2).
Fazit: Die neuen Neuraminidase-Hemmer Zanamivir und Oseltamivir können bei rechtzeitigem Therapiebeginn (innerhalb von 36 Stunden nach Auftreten der Symptome) den Verlauf einer Grippe im Mittel um 1,5 Tage verkürzen und die Symptome lindern. Ob und in welchem Maße dies auch für Patienten mit bestehenden Lungen- und/oder Herzkrankheiten oder für ältere Menschen gilt, ist noch nicht geklärt. Ebenfalls ist unklar, ob diese Therapie überhaupt Einfluß auf Ausfallszeiten, Krankenhausaufenthalte, Folgeerkrankungen oder gar Letalität hat. Für die Grippeprophylaxe mit Neuraminidase-Hemmern besteht derzeit keine Zulassung. Der Effekt ist auch recht gering, denn es müßten etwa 25 gesunde Menschen behandelt werden, um eine Grippe zu verhindern. In jedem Falle ist die Vorbeugung mit einer Grippeschutzimpfung wesentlich effektiver und billiger.
Aus diesen Gründen bleibt die Grippe-Therapie mit Neuraminidase-Hemmern derzeit nur auf wenige Menschen beschränkt, nämlich frisch Infizierte ohne gravierende Begleiterkrankungen und fehlendem Impfschutz, die sich eine längere Krankheit nicht „leisten können“.
Literatur
1. Nichol, K.L., et al.: JAMA 1999, 282, 137.
2. FDA: Division Director memorandum: http://www.fda.gov/cder
3. MIST Study Group (Management of Influenza in the Southern Hemisphere Trialists): Lancet 1998, 352, 1877.
4. Hayden, F.G., et al.: JAMA 1999, 282, 1240.
5. Tamiflu-Fachinformation (USA), Roche Lab. Inc., 10/99.
6. Monto, A. S., et al.: JAMA, 1999, 282, 31.
7. Hayden, F. G., et al.: N. Engl. J. Med. 1999, 341, 1336.
8. Relenza-Fachinformation (USA), Glaxo Wellcome Inc., 1999.