Zusammenfassung: Neue Wirkstoffe mit neuen Wirkprinzipien eliminieren bei chronischer Hepatitis C nach den Ergebnissen erster Studien häufiger das Virus als die Standardtherapie mit Interferon alfa plus Ribavirin und Proteasehemmern der ersten Generation (Telaprevir und Boceprevir). Die neuen Wirkstoffe scheinen auch deutlich besser verträglich zu sein als die Proteaseinhibitoren der ersten Generation. Mit der Kombination neuer Wirkstoffe, z.B. Sofosbuvir plus Lepidasvir in einer Tablette und nur einmal täglicher Einnahme – also einer Therapie ohne Interferon-Injektionen und ohne Ribavirin – wurde bei deutlich kürzerer Therapiedauer und bei Infektionen mit unterschiedlichen Genotypen bei > 85% der Patienten eine komplette Viruselimination erreicht. Dies gelang auch bei Patienten mit bisher sehr geringen Erfolgschancen, z.B. solchen, die auf eine Therapie einschließlich eines Proteaseinhibitors nicht angesprochen hatten, Patienten, bei denen wegen einer psychischen Erkrankung Interferon alfa kontraindiziert ist, und bei Patienten mit kompensierter Leberzirrhose.
Weltweit sind ca. 170-200 Mio. Menschen mit dem Hepatitis-C-Virus chronisch infiziert. Jährlich sterben mehr als 350.000 an den Folgen (1). In Deutschland ist die Hepatitis C mit ca. 0,5 Mio. chronisch Erkrankten die häufigste klinisch relevante chronische Virusinfektion. Es gibt sechs verschiedene Genotypen des Hepatitis-C-Virus, die regional unterschiedlich häufig sind. Der Genotyp 1 überwiegt weltweit.
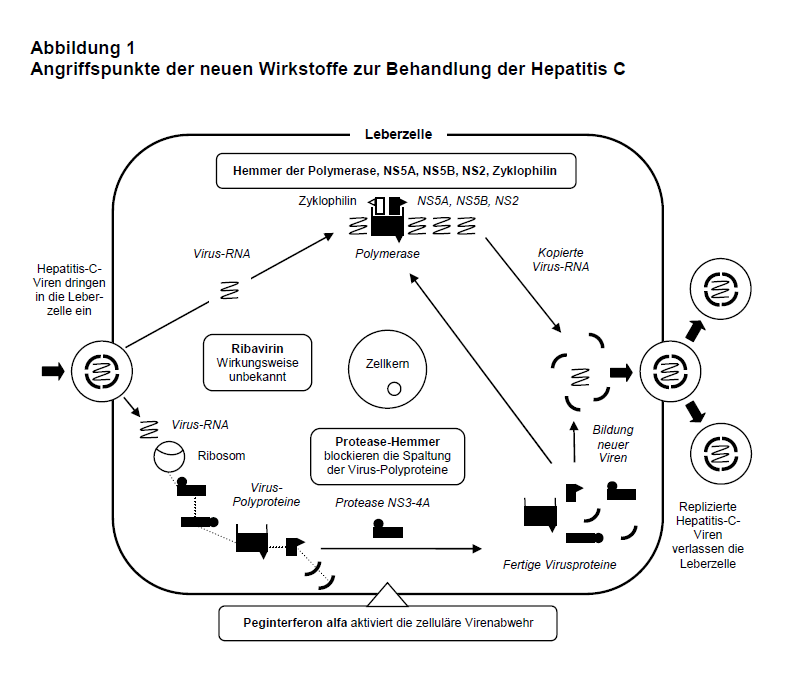
Zur Geschichte der Hepatitis-C-Therapie: Vor einem Vierteljahrhundert wurde das Hepatitis-C-Virus entdeckt. Bis dahin fiel die Erkrankung unter die ungenaue Sammelbezeichnung „Non A, non B Hepatitis“. Zunächst war die chronische Virusinfektion nicht heilbar, dann kamen kleine therapeutische Erfolge durch Interferon alfa: bei ca. 15% der Patienten wurde das Virus anhaltend eliminiert (Sustained virological response = SVR). Die SVR ist das primäre Behandlungsziel. Durch Pegylierung von Interferon alfa (Peginterferon alfa) wurde die Pharmakokinetik und damit die Wirksamkeit verbessert. Mit Peginterferon alfa in Kombination mit Ribavirin wurde die SVR auf ca. 50% gesteigert. 2011 wurden die beiden ersten Proteaseinhibitoren, Boceprevir (Victrelis®) und Telaprevir (Invico®), zugelassen. Jeweils in Kombination mit Peginterferon alfa plus Ribavirin (Dreifachkombination) wurden SVR von ca. 70% erzielt. Wir haben in den letzten Jahren über fast alle neuen Wirkstoffe zur Therapie der chronischen Hepatitis C berichtet: über die ersten Proteaseinhibitoren Telaprevir und Boceprevir (2), über eine neue, direkt auf die Hepatitisviren wirkende Substanz, den HCV-NS5A-Replikationskomplex-Inhibitor Daclatasvir in Kombination mit dem NS3-Proteaseinhibitor Asunaprevir (3) und zuletzt über den oral einzunehmenden Nukleotid-Polymerase-Inhibitor Sofosbuvir (4). Für Patienten, die auf eine Behandlung mit den bisher zugelassenen Wirkstoffen nicht ansprechen, wird es künftig Alternativen geben (s. Tab. 1 und 2). Patienten mit chronischer Hepatitis C und kompensierter Leberzirrhose waren bisher schlecht oder gar nicht zu behandeln. Probleme gibt es auch bei Patienten, die wegen psychischer Erkrankungen kein Interferon erhalten sollten. Ziel der Behandlung der chronischen Hepatitis C ist die SVR, weil dadurch Folgeerkrankungen, wie Leberzirrhose und hepatozelluläres Karzinom, vermindert werden können und somit auch die Letalität gesenkt werden kann. 2014 ist also für diese Infektion aus verschiedenen Gründen ein bemerkenswertes Jahr (5).
Neue Studienergebnisse: Anfang des Jahres wurden mehrere Studien mit neuen, sehr wirksamen und akzeptabel verträglichen Wirkstoffkombinationen veröffentlicht, und weitere werden sicher folgen. Zwei wollen wir exemplarisch besprechen, denn die immer komplexeren Kombinationstherapien (vgl. Tab. 2) können wahrscheinlich vereinfacht werden. In beiden offenen Studien wurde die Wirksamkeit der Kombination Sofosbuvir plus Daclatasvir (6) sowie Sofosbuvir plus Ledipasvir (7) untersucht und dies bei Patienten mit vorher unbehandelter sowie vorher erfolglos behandelter chronischer Hepatitis C. Daclatasvir (vgl. 3) und Ledipasvir sind die ersten HCV-NS5A-Replikations-Komplex-Inhibitoren. Sie können wie Sofosbuvir (vgl. 4) oral eingenommen werden.
In der ersten Studie (6; gesponsert von Bristol-Myers Squibb und Pharmasset), wurden zunächst 44 unbehandelte Patienten mit chronischer Hepatitis C Genotyp 1 und 44 unbehandelte Patienten mit chronischer Hepatitis C Genotyp 2 oder 3 randomisiert. Sie erhielten Daclatasvir 60 mg und Sofosbuvir 400 mg je einmal täglich oral mit bzw. ohne Ribavirin 24 Wochen lang. Die Studie wurde dann um weitere 123 Patienten mit chronischer Hepatitis C erweitert. Von diesen waren 82 unbehandelt und wurden nur 12 Wochen lang behandelt, und 41 Patienten waren zuvor erfolglos behandelt worden, einschließlich eines Proteaseinhibitors (Telaprevir oder Boceprevir plus Peginterferon alfa plus Ribavirin). Der primäre Endpunkt war die SVR 12 Wochen nach Ende der Therapie.
Insgesamt wurden 211 Patienten kombiniert mit Daclatasvir plus Sofosbuvir behandelt. Bei Patienten mit Hepatitis-C-Genotyp 1 erreichten 98% der 126 bis dato Unbehandelten und 98% der zuvor erfolglos Behandelten eine SVR 12 Wochen nach Ende der Therapie. Bei Patienten mit den bei uns seltenen Hepatitis-C-Genotypen 2 und 3 war die SVR etwas niedriger: 92% der 26 Patienten mit Genotyp 2-Infektion und 89% der Patienten mit Genotyp 3. Bei Subgruppen des Genotyps 1 war die Ansprechrate annähernd gleich (1a = 98% und 1b = 100%). Die Unterschiede in den Ansprechraten zwischen Patienten mit und ohne Mutation im IL28 (93% vs. 98%) und in den Gruppen mit bzw. ohne Ribavirin (94% vs. 98%) waren gering.
Die häufigsten UAW waren Müdigkeit, Kopfschmerzen und Übelkeit. In der Ribavirin-Gruppe trat die bekannte UAW Anämie häufiger auf als in den Gruppen ohne Ribavirin.
In die zweite Studie (7) wurden in einem US-amerikanischen Zentrum von November bis Dezember 2012 insgesamt 100 Patienten (> 18 Jahre) mit einer Hepatitis-C-Genotyp 1-Infektion eingeschlossen. Es sollte geprüft werden, wie wirksam und verträglich die Behandlung mit einer einmal täglich einzunehmenden Tablette ist, die 400 mg Sofosbuvir und 90 mg Lepidasvir enthält. Ledipasvir ist wirksam bei Genotyp 1 und auch bei der einzigen bisher gefundenen Virusmutation (S282T), die die Wirksamkeit von Sofosbuvir vermindern kann (8). Die Studie wurde von Gilead Sciences gesponsert.
In einer Kohorte A wurden 60 bis dato unbehandelte Patienten mit chronischer Hepatitis C in drei Gruppen 1:1:1 randomisiert und nach Genotyp 1a und 1b stratifiziert. Die 1. Gruppe erhielt acht Wochen lang die Kombinations-Tablette (s.o.); die 2. Gruppe erhielt zusätzlich Ribavirin und die 3. Gruppe erhielt die Kombinationstablette 12 Wochen lang.
In Kohorte B wurden 40 Patienten mit chronischer Hepatitis C, die bereits auf eine Dreifach-Therapie einschließlich einem Proteaseinhibitor nicht angesprochen hatten, in zwei Gruppen (4. und 5. Gruppe) 1:1 randomisiert und nach Genotyp 1a und 1b und Leberzirrhose stratifiziert. 22 Patienten (55%) in Kohorte B hatten eine kompensierte Leberzirrhose. Die 4. Gruppe erhielt 12 Wochen lang die Kombinations-Tablette, die 5. Gruppe erhielt zusätzlich Ribavirin. Primärer Endpunkt der Studie war SVR 12 Wochen nach Ende der Therapie.
In Kohorte A (bisher unbehandelte Patienten) hatten eine SVR in der 1. Gruppe 19 von 20 Patienten (95%), 21 von 21 in der 2. Gruppe und 18 von 19 (95%) in der 3. Gruppe. In Kohorte B (Therapieversagen und Patienten mit kompensierter Leberzirrhose) hatten eine SVR in der 4. Gruppe 18 von 19 (95%) und 21 von 21 in der 5. Gruppe. Zwei der drei Patienten ohne SVR hatten einen viralen Rückfall, und ein Patient erschien nicht mehr zu den Folgeuntersuchungen.
Die häufigsten UAW waren in dieser Studie Übelkeit, Anämie, Kopfschmerzen und respiratorische Infekte. Nur ein Patient (5. Gruppe) hatte eine schwere UAW – eine Anämie, die auf Ribavirin zurückzuführen war.
Diese Ergebnisse und der eventuelle Nutzen der Kombination mit Ribavirin müssen an größeren Patientenzahlen überprüft werden. Die hier erzielten Ergebnisse sind jedoch zunächst erfreulich. Die Therapie der chronischen Hepatitis C wird vereinfacht und verkürzt. Außerdem können mit der neuen Kombination nun auch psychisch Kranke und Patienten mit kompensierter Leberzirrhose mit Erfolg behandelt werden.
Laufende Studien: Weitere neue Wirkstoffe zur Therapie der chronischen Hepatitis C sind in verschiedenen Phasen klinischer Studien. Im Wesentlichen handelt es sich um vier Wirkstoffklassen (s. Tab. 1): Zweite Generation der Proteaseinhibitoren (PI), NS5B Polymerase-Inhibitoren (NS5B.I), NS5A-Komplex-Inhibitoren (NS5A.I) und Wirtszellen-interagierende Substanzen (WIA). Wichtige Schritte, die Wirksamkeit (SVR) der Therapie zu verbessern – auch um eine Resistenzbildung zu vermindern, werden die verschiedenen Kombinationen dieser Wirkstoffe sein mit und ohne Ribavirin oder Interferon alfa. Eine Übersicht derzeit laufender Studien mit Kombinationen gibt Tab. 2.
Zweite Generation Proteaseinhibitoren (PI): Nachteil der ersten PI, Boceprevir und Telaprevir (vgl. 2), waren häufige Nebenwirkungen. Zum Teil musste die Behandlung deshalb unterbrochen oder abgesetzt werden. Weitere Probleme waren die geringe Resistenzbarriere und die Wirksamkeit nur bei Genotyp 1. Die 2. Generation der PI ist besser verträglich und wirkt auch gegen die meisten Genotypen, ausgenommen Genotyp 3 (9; s. Tab. 1).
NS5B Polymerase-Inhibitoren (NS5B.I): Diese Nukleosid/Nukleotid-Inhibitoren sind „falsche“ Substrate für die virale Polymerase, binden am aktiven Zentrum NS5B des Hepatitis-C-Virus und führen zu Fehlern in der wachsenden RNS-Kette. Da die NS5B-Region bei allen Genotypen hochkonserviert ist, wirken diese Substanzen auch bei allen. Der erste Vertreter dieser Klasse war Mericitabin, der allerdings eine schwächere Wirkung beim Genotyp 1 zeigte (10), aber eine hohe gegen die Genotypen 2, 3 und 4 (11; s. Tab. 1). In Kombination mit einem PI und/oder Ribavirin und/oder Interferon alfa ergab sich bei allen Genotypen eine gute SVR (s. Tab. 2). Das Pyrimidin-Analog Sofosbuvir ist ein gegen alle Genotypen hochwirksamer NS5B.I mit hoher Resistenzbarriere (15).
NS5A-Komplex-Inhibitoren (NS5A.I): HCV-NS5A ist ein Phosphoprotein. Es hat keine enzymatischen Funktionen, aber eine entscheidende Rolle in der HCV-Replikation. NS5A hat drei strukturelle Domänen. Domäne I ist essentiell für die HCV-Replikation und Domäne II für die Bindung an das zelluläre Zyklophilin A. Die Domäne III soll für die Zusammensetzung der Viruspartikel wichtig sein (12). Der erste Vertreter dieser Klasse ist Daclatasvir (vgl. 3, 6). Andere sind in Entwicklung, und verschiedene Kombinationen mit anderen Wirkstoffen werden geprüft (s. Tab. 1 und 2).
Wirtszelle-interagierende Substanzen (WIA): Zyklophiline sind eine hochkonservierte Familie humaner Enzyme, die an verschiedenen zellulären Prozessen wie Proteinfaltung, Transport und Sekretion sowie an Funktionen der Mitochondrien und Immunantworten beteiligt sind (13). Das Hepatitis-C-Virus nutzt diese Enzyme als Kofaktor für die Replikation. In den Hepatozyten verbinden sich Zyklophilin A und B mit den viralen Proteinen NS5A, NS5B und NS2 und formen einen Replikationskomplex (13). Alisporivir ist ein nicht-immunsuppressiver Typ der Zyklophilin-Inhibitoren und wirkt stark gegen viele Genotypen des Hepatitis-C-Virus (14). Allerdings traten in einer Phase-III-Studie mit Alisporivir vermehrt Pankreatitiden auf, von denen eine fatal ausging bei Behandlung mit dieser Substanz in Kombination mit einem Proteaseinhibitor (15). Zwei weitere Vertreter dieser Klasse (SCY-635, NIM-811) sind derzeit in der Entwicklung und gelten als aussichtsreich für eine zukünftige Kombinationstherapie ohne Peginterferon alfa (s. Tab. 1).
Zukünftige Therapie: Es wird damit gerechnet, dass noch in diesem Jahr zehn weitere Substanzen aus den vorgestellten Wirkstoffklassen zur Behandlung der chronischen Hepatitis C zugelassen werden. Die Zukunft der Therapie wird in der Kombination verschiedener Wirkstoffe dieser Klassen liegen und wahrscheinlich langfristig ohne Interferon alfa auskommen. Es ist das Ziel – wie bei Behandlung der HIV-Infektion – die Wirkstoffe in einer einmal täglich einzunehmenden Tablette zu kombinieren. Die Therapie wird dadurch wesentlich einfacher und sicherer wie z.B. bei der Kombi-Tablette aus Sofosbuvir und Lepidasvir (7).
Kosten: Sofosbuvir (Sovaldi®) ist der erste Vertreter aus den neuen Wirkstoffklassen. Er wurde Ende 2013 in den USA und im Januar 2014 in Europa zugelassen. Der Preis ist mit ca. 84.000 US-$ (in den USA) für die gesamte Therapiedauer von 12 Wochen im Vergleich zu den Herstellungskosten von ca. 100-250 US-$ enorm hoch und somit für viele Menschen in der Welt nicht erschwinglich (2). Ca. 90% der 170-200 Mio. infizierten Patienten leben in Ländern mit niedrigen bis mittleren Einkommen. Für den größten Teil der Weltbevölkerung, der mit dem Hepatitis-C-Virus infiziert ist, werden also die neuen Therapieformen nicht zur Verfügung stehen. Ein Hoffnungsschimmer für diese Menschen könnten Generika-Firmen in Indien sein, die sich gerade darum bemühen, Sofosbuvir herstellen zu dürfen. Diese Strategie hat schon bei den HIV-Arzneimitteln die Preise stark reduziert (2). Ein weiteres Hindernis auf dem Weg der weltweiten Eradikation des Hepatitis-C-Virus ist auch die hohe Dunkelziffer dieser Infektion in den Entwicklungsländern.
Literatur
- Lauer, G.M., und Walker, B.D.: N.Engl. J. Med. 2001, 345, 41. Link zur Quelle
- AMB 2009, 43,36 Link zur Quelle . AMB 2010, 44, 68 Link zur Quelle . AMB 2011, 45,44 Link zur Quelle . AMB 2011, 45, 51. Link zur Quelle
- AMB 2012, 46,11a. Link zur Quelle
- AMB 2013, 47, 28b. Link zur QuelleAMB 2013, 47, 59a. Link zur Quelle
- Anonymous: Lancet2014, 383, 281. Link zur Quelle
- Sulkowski, M.S., et al.:N. Engl. J. Med. 2014, 370, 211. Link zur Quelle
- Lawitz, E., et al.(LONESTAR): Lancet 2014, 383, 515. Link zur Quelle
- Cheng, G., et al.: Link zur Quelle
- Fusco, D.N., und Chung, R.T.: J.Hepatol. 2011, 54, 1087 Link zur Quelle . Erratum: J. Hepatol. 2011, 55, 952.
- Wedemeyer, H., et al.:Hepatology 2013, 58, 524. Link zur Quelle
- Gane, E.J., et al.: J.Hepatol. 2010, 52 Suppl. 1, S16. Vgl. Link zur Quelle
- Suk-Fong Lok, A.: Clin. Liver Dis. 2013, 17,111. Link zur Quelle
- Flisiak, R., et al.: Hepatology 2008, 47,817. Link zur Quelle
- Alberti, A., et al.:J. Hepatol. 2012, 56 Suppl. 2, S553. Link zur Quelle
- Wendt, A., et al.: Clin.Pharmacol. 2014, 6, 1. Link zur Quelle