Zusammenfassung: Die Therapiestrategien der chronischen lymphatischen Leukämie (CLL), der häufigsten Leukämie bei Erwachsenen in Deutschland, haben sich in den letzten 5 Jahren deutlich verändert. Grund hierfür ist die Zulassung neuer Arzneimittel, die durch Hemmung von Kinasen (z.B. Ibrutinib, Idelalisib) die Signalübertragung über den B-Zell-Rezeptor bei Patienten mit CLL unterbrechen bzw. das antiapoptotisch (programmierter Zelltod) wirkende Protein BCL-2 hemmen (Venetoclax). Diese neuen Arzneimittel wurden zunächst bei Patienten mit rezidivierter bzw. refraktärer CLL untersucht, inzwischen aber auch bei Patienten in der Erstlinientherapie verglichen mit der bisherigen Standardtherapie: Kombination verschiedener Zytostatika, z.B. Chlorambucil, Fludarabin, Cyclophosphamid, Bendamustin, mit monoklonalen Antikörpern (moAk), die gegen das CD20-Antigen auf B-Lymphozyten gerichtet sind.
Die bisher vorliegenden Ergebnisse aus mehreren randomisierten kontrollierten Studien in der Erstlinientherapie der CLL sprechen für eine bessere Wirksamkeit von Ibrutinib gegenüber dem bisherigen Standard (Chemo-/Immuntherapie), belegen jedoch nicht eindeutig einen Vorteil der Kombination von Ibrutinib mit anti-CD20 moAk gegenüber der Monotherapie mit Ibrutinib. Offene Fragen zu Ibrutinib betreffen vor allem das Nebenwirkungsprofil bei langfristiger Anwendung und den Verlauf der CLL nach Absetzen bei schweren Nebenwirkungen. Venetoclax kann derzeit hinsichtlich Wirksamkeit, Sicherheit und Überlegenheit gegenüber Therapiealternativen in der Erstlinientherapie der CLL nicht sicher beurteilt werden, denn die Nachbeobachtungsdauer der vorliegenden Studien ist zu kurz und – mit einer Ausnahme – fehlen aussagekräftige Ergebnisse randomisierter kontrollierter Studien. Beide Arzneimittel, Ibrutinib und Venetoclax, sind sehr teuer; die Jahrestherapiekosten für die Monotherapie liegen bei ca. 80.000 €.
Die Alternativen in der medikamentösen Therapie von Patienten mit behandlungspflichtiger chronischer lymphatischer Leukämie der B-Zellreihe (B-CLL) haben sich in den letzten Jahren deutlich erweitert. Wichtige Voraussetzung für die Entwicklung neuer Wirkstoffe waren experimentelle Untersuchungen, die zu einem besseren Verständnis der Funktion des B-Zell-Rezeptors (B-cell receptor = BCR) und des über den BCR vermittelten Signalwegs für Proliferation und Überleben von normalen B-Lymphozyten sowie malignen Zellen der B-CLL geführt haben. Über die Inhibitoren der Bruton Tyrosinkinase (BTK) Ibrutinib (Imbruvica®) bzw. der Phosphatidylinositol-3-Kinase p110 (PI3K) Idelalisib (Zydelig®) hatten wir anlässlich ihrer Zulassung im Jahr 2014 bereits berichtet (vgl. 1). Beide Wirkstoffe wurden zunächst zugelassen für Patienten mit rezidivierter oder refraktärer B-CLL, entweder als Monotherapie oder in Kombination mit Chemo-/Immuntherapie (Fludarabin, Cyclophosphamid bzw. Bendamustin, jeweils in Kombination mit einem gegen CD20 gerichteten monoklonalen Antikörper, z.B. Rituximab oder Obinutuzumab; vgl. 2). Ende 2016 wurde mit Venetoclax (Venclyxto®) ein weiterer neuer Wirkstoff zugelassen, und zwar für Patienten mit B-CLL, deren maligne Zellen prognostisch ungünstige genetische Veränderungen wie eine 17p-Deletion oder TP53-Mutation aufweisen und die für eine Behandlung mit einem Inhibitor des BCR-Signalwegs nicht geeignet sind oder ein Therapieversagen zeigten bzw. bei denen sowohl unter einer Chemo-/Immuntherapie als auch unter einem Inhibitor des BCR-Signalwegs ein Therapieversagen auftrat. Venetoclax ist ein Inhibitor des B-Zell-Lymphom(BCL-2)-Proteins, das den programmierten Zelltod (Apoptose) in B-Zellen hemmt.
Inzwischen wurden mehrere klinische Studien auf internationalen Kongressen der Hämatologen (z.B. American Society of Hematology = ASH) vorgestellt bzw. in renommierten Fachzeitschriften publiziert, die Inhibitoren des BCR-Signalwegs bzw. von BCL-2 in der Erstlinientherapie der B-CLL verglichen haben mit der bisher als Standard geltenden Chemo-/Immuntherapie. Die Ergebnisse dieser Studien sind teilweise bereits in den aktuellen Leitlinien bzw. Empfehlungen zur Erstlinientherapie von Patienten mit B-CLL berücksichtigt worden (3, 4). Bevor auf zwei dieser Studien näher eingegangen wird, soll kurz auf die Behandlungsindikation bei Patienten mit neu diagnostizierter B-CLL und die für die Einleitung einer Erstlinientherapie heute relevanten prognostischen Parameter hingewiesen werden (5). Definitionsgemäß müssen für die Diagnose einer B-CLL ≥ 5.000 maligne B-Lymphozyten/µl im peripheren Blut nachgewiesen werden (6). Die Mehrzahl der Patienten mit neu diagnostizierter B-CLL benötigt initial keine medikamentöse Therapie (sog. „watch and wait“-Strategie), da die Erkrankung häufig asymptomatisch verläuft und eine Verlängerung des Überlebens durch frühzeitigen Beginn einer medikamentösen Behandlung bisher nicht belegt ist. Die Indikation zur medikamentösen Therapie hängt vor allem ab von der Symptomatik (z.B. progrediente Vergrößerung der Lymphknoten bzw. Splenomegalie; B-Symptome: Gewichtsabnahme > 10% innerhalb von 6 Monaten, extreme Schwäche, Fieber über 2 Wochen ohne Anhalt für eine Infektion, Nachtschweiß; autoimmunhämolytische Anämie oder Autoimmunthrombozytopenie), der klinischen Stadieneinteilung (z.B. Übergang in ein Stadium Binet C; d.h. Hämoglobin < 10 g/dl und Thrombozyten < 100 G/l infolge einer zunehmenden Insuffizienz des Knochenmarks durch Verdrängung der normalen Hämatopoese) sowie der Verdopplungszeit der malignen B-Lymphozyten (< 6 Monate). Da das klinische Stadium zusammen mit den Symptomen über die Einleitung einer medikamentösen Therapie entscheidet, sollte bei jeder Vorstellung eines Patienten mit B-CLL neben einer gründlichen anamnestischen Befragung und Analyse des Blutbilds auch eine körperliche Untersuchung, insbesondere der Lymphknoten und der Milz erfolgen.
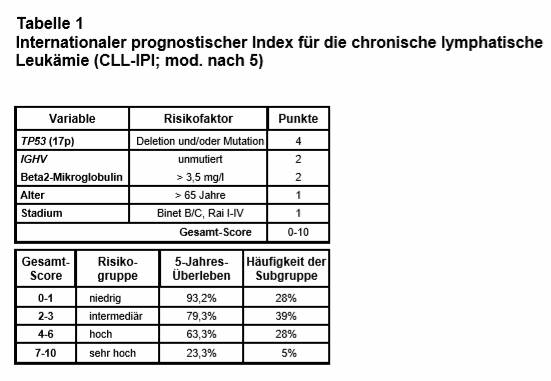
Um die Prognose vor Einleitung einer Erstlinientherapie von Patienten mit B-CLL besser abschätzen zu können, wird heute meist der sog. CLL-IPI (IPI = International Prognostic Index) bestimmt. Er berücksichtigt die in Tab. 1 genannten Variablen und bestimmt anhand des Gesamt-Scores insgesamt 4 Risikogrupen, die sich im 5-Jahres-Überleben deutlich unterscheiden. (5-7). Sowohl das Fehlen einer somatischen Hypermutation im Gen, das die variable Region der schweren Ketten der Immunglobuline kodiert (immunoglobulin heavy-chain variable region = IGHV) als auch die Deletion des kurzen Arms von Chromosom 17 (del[17p]) bzw. Mutationen der TP53-Gens gelten heute als gesicherte genetische Risikofaktoren, die bei CLL mit einer ungünstigen Prognose bzw. Resistenz gegenüber Zytostatika assoziiert sind.
Sofern eine Therapieindikation vorliegt, orientiert sich die Auswahl der Erstlinientherapie für einen Patienten mit B-CLL heute an der Komorbidität. Sie wird meist durch die Cumulative Illness Rating Scale ermittelt (CIRS; 8), ist aber auch abhängig vom Vorliegen genetischer Risikofaktoren, an der Nierenfunktion und weniger – als noch vor einigen Jahren – am kalendarischen Alter. Während für jüngere Patienten mit B-CLL ohne relevante Begleiterkrankungen bzw. ungünstige genetische Veränderungen eine Chemo-/Immuntherapie (heute meist mit Fludarabin, Cyclophosphamid plus einem gegen CD20-gerichteten monoklonalen Antikörper; 6) als Standard gilt, werden neue, besser wirksame medikamentöse Therapien vor allem für Patienten mit deutlichen Komorbiditäten und/oder ungünstigen genetischen Veränderungen dringend benötigt.
In einer von klinischen Prüfern am M.D. Anderson Cancer Center in Houston (USA) geplanten, offenen Phase-II-Studie wurde deshalb die Frage untersucht, ob eine Kombination von Ibrutinib mit Venetoclax wirksam und gut verträglich ist für nicht vorbehandelte Patienten mit B-CLL und Nachweis ungünstiger genetischer Veränderungen (del[17p]), mutiertes TP53, nicht mutierte IGHV) bzw. ältere Patienten (≥ 65 Jahre) unabhängig von genetischen Veränderungen (9). Die Studie wurde finanziell unterstützt von AbbVie, dem pharmazeutischen Hersteller von Venetoclax, und verschiedenen wissenschaftlichen Institutionen in den USA. Von insgesamt 80 Patienten (medianes Alter: 65 Jahre), die zunächst eine medikamentöse Monotherapie mit Ibrutinib (420 mg einmal täglich) für 3 Zyklen begannen, beendeten 5 Patienten diese Therapie vorzeitig. Ab Zyklus 4 erhielten dann 75 Patienten zusätzlich Venetoclax, von denen 6 die Kombinationstherapie vorzeitig beendeten. Die Gründe für die vorzeitige Beendigung der Mono- bzw. Kombinationstherapie waren sehr unterschiedlich und sind in der Publikation genau angegeben. Die Dosis von Venetoclax wurde wöchentlich gesteigert, von einer Anfangsdosis 20 mg einmal täglich über 7 Tage bis hin zu einer Zieldosis von 400 mg einmal täglich. Jeder Therapiezyklus dauerte 28 Tage. Das Design (Beginn mit 3 Zyklen Monotherapie Ibrutinib, 5-wöchiges Aufdosierungsschema von Venetoclax) wurde gewählt, um das Risiko für eine gefürchtete Nebenwirkung (NW) von Venetoclax (Tumorlyse-Syndrom) zu reduzieren (9, 10). Die kombinierte Gabe von Ibrutinib und Venetoclax erfolgte über 24 Zyklen. Patienten, bei denen am Ende der 24 Zyklen anhand einer Immunphänotypisierung mit Durchflusszytometrie im Knochenmark eine minimale Resterkrankung (minimal residual disease = MRD) der B-CLL nachweisbar war, konnten weiterhin Ibrutinib bis zum Progress der Erkrankung bzw. dem Auftreten inakzeptabler toxischer NW erhalten. Das Ansprechen wurde gemäß den Kriterien des International Workshop on Chronic Lymphocytic Leukemia (IWCLL 2008) beurteilt (11).
Nach einer medianen Nachbeobachtung von 14,8 Monaten erreichten 59 Patienten (74%) eine komplette Remission (complete remission = CR) oder CR mit inkompletter Erholung des Blutbilds. Bei 40% dieser Patienten konnte eine MRD nach 6 Zyklen der Kombinationstherapie im Knochenmark nicht mehr nachgewiesen werden. Die älteren Patienten zeigten ebenfalls ein gutes Ansprechen auf die Kombinationstherapie: 74% erreichten eine CR oder CR mit inkompletter Erholung des Blutbilds, und bei 44% der Patienten war im Knochenmark nach 6 Zyklen keine MRD mehr nachweisbar. Das geschätzte Überleben ohne Progression (progression-free survival = PFS) bzw. Gesamtüberleben (overall survival = OS) lag bei 98% bzw. 99%! Bei 60% der Patienten traten schwere NW (Common Terminology Criteria for Adverse Events = CTCAE: Grad 3 oder höher) auf, darunter am häufigsten hämatologische, wie Neutropenie Grad 3 oder 4 bei 29 Patienten (39%) und neutropenes Fieber bei 4 Patienten. Es traten aber auch nicht hämatologische NW auf, wie Vorhofflimmern und arterielle Hypertonie – charakteristisch für Ibrutinib (12) – bei jeweils 8 Patienten (10%). Die Dosierung von Ibrutinib musste bei 35 der 80 Patienten reduziert werden, häufig infolge der zuvor genannten hämatologischen bzw. nicht hämatologischen NW.
Die Autoren der Studie halten aufgrund der Ergebnisse ihrer unkontrollierten Phase-II-Studie die Kombination von Ibrutinib plus Venetoclax für eine gut wirksame Therapie bei nicht vorbehandelten Patienten mit CLL und ungünstigen genetischen Veränderungen bzw. älteren Patienten (9). In einem Editorial zu dieser Studie werden die Ergebnisse dieser Phase-II-Studie als „eindrucksvoll“ dargestellt, gleichzeitig aber zu Recht auf die noch offenen Fragen hingewiesen, wie beispielsweise: Kann die Kombinationstherapie tatsächlich nach 24 Zyklen sicher beendet werden? Können prognostisch ungünstige Untergruppen identifiziert werden, die eine zusätzliche Therapie benötigen? Welche Mechanismen sind verantwortlich für das Auftreten einer Resistenz gegenüber Ibrutinib und/oder Venetoclax (13)? Eine endgültige Einschätzung der Wirksamkeit und Sicherheit dieser neuartigen Therapiestrategie erfordert natürlich eine deutlich längere Nachbeobachtung, um die Ergebnisse nach Abschluss der 24 Zyklen der Kombinationstherapie bei den noch in der Studie verbliebenen Patienten zu beurteilen, aber auch eine Bestätigung dieser positiven Ergebnisse für die Kombination Ibrutinib plus Venetoclax in einer randomisierten kontrollierten Studie.
Eine offene, randomisierte kontrollierte Studie hat ebenfalls den therapeutischen Stellenwert von Venetoclax in der Erstlinientherapie der B-CLL untersucht. Sie wurde von der Deutschen CLL-Studiengruppe geplant und das Design von den beiden Sponsoren, F. Hoffmann-La Roche und AbbVie, gebilligt (14). Die Studie wurde in insgesamt 21 Ländern an 196 Krankenhäusern bzw. Praxen durchgeführt. Patienten mit Stadium Binet C oder symptomatischer Erkrankung wurden eingeschlossen. Auch Patienten mit TP53-Deletion oder Mutation konnten nach Ermessen der klinischen Prüfer eingeschlossen werden. Die Patienten mussten einen CIRS (vgl. 8) von > 6 haben oder eine Kreatinin-Clearance (berechnet nach der Cockcroft-Gault-Formel) < 70 ml/min. Die Patienten erhielten nach 1:1-Randomisierung entweder Venetoclax plus Obinutuzumab (V + O) oder Chlorambucil plus Obinutuzumab (C + O): Die Therapie wurde begonnen mit der Gabe des monoklonalen Antikörpers (O: 100 mg an Tag 1, 900 mg an Tag 2 (oder 1.000 mg an Tag 1), 1.000 mg an Tag 8 und 1.000 mg an Tag 15 von Zyklus 1 und anschließend 1.000 mg nur an Tag 1 der Zyklen 2-6. Chlorambucil wurde peroral (0,5 mg/kg Körpergewicht) jeweils an den Tagen 1 und 15 jedes Zyklus bis zur Komplettierung von insgesamt 12 Zyklen gegeben. Die tägliche Einnahme von Venetoclax begann an Tag 22 von Zyklus 1 mit 20 mg und derselben Aufdosierung bis zu einer Dosis von 400 mg täglich wie in der Studie zu Venetoclax plus Ibrutinib (9). Auch Venetoclax wurde für insgesamt 12 Zyklen gegeben. Primärer Endpunkt war das von den klinischen Prüfern beurteilte PFS. Sekundäre Endpunkte waren u.a. das von einem unabhängigen Review-Komitee beurteilte PFS, der fehlende Nachweis von MRD im Knochenmark und peripherem Blut sowie das Ansprechen 3 Monate nach Beendigung der medikamentösen Therapie. Komplettes und partielles Ansprechen wurden entsprechend den Empfehlungen des IWCLL 2008 beurteilt (11). Nach Beendigung der Therapie wurden Progression der CLL bzw. Sicherheit der Behandlung alle 3 Monate in den ersten 2 Jahren und anschließend alle 6 Monate analysiert. Insgesamt wurden von den 432 Patienten jeweils 216 Patienten in den Arm mit V + O bzw. C + O randomisiert, von denen 212 tatsächlich V + O und 214 C + O erhielten. Das mediane Alter der Patienten betrug 72 Jahre; 13,8% der Patienten hatten eine TP53-Deletion und/oder -Mutation oder beide genetische Veränderungen und 59,8% ein nicht mutiertes IGHV. Etwa 78% im V + O- und 75% im C + O-Arm erhielten die geplanten 12 Behandlungszyklen, fast immer in der vorgesehenen Dosisintensität. Nach einer medianen Nachbeobachtung von 28,1 Monaten waren 30 primäre Endpunkte (Progression oder Tod) im V + O-Arm und 77 im C + O-Arm aufgetreten (Hazard Ratio: 0,35; 95%-Konfidenzintervall = CI: 0,23-0,53; p < 0,001). Dementsprechend war auch der Prozentsatz an Patienten mit PFS nach 24 Monaten signifikant höher im V + O-Arm (88,2%; CI: 83,7-92,6) im Vergleich zum C + O-Arm (64,1%; CI: 57,4-70,8). Die bessere Wirksamkeit von V + O war erkennbar auch bei Patienten mit TP53-Deletion und/oder -Mutation und bei Patienten mit nicht mutiertem IGHV. Ein signifikanter Unterschied in der Letalität – unabhängig von der Ursache – konnte jedoch nicht nachgewiesen werden (V + O: 9,3%, C + O: 7,9%). Die Analyse der unerwünschten Ereignisse (Sicherheit) in beiden Therapiearmen zeigten keine neuen Signale bzw. Hinweise auf eine höhere Inzidenz der bereits bekannten NW. Allerdings traten tödliche unerwünschte Ereignisse (CTCAE Grad 5) während oder nach Abschluss der Behandlung häufiger auf unter V + O (n = 16; 7,5%) als unter C + O (n = 8; 3,7%). Nach Beginn der Behandlung mit Obinutuzumab und der langsamen Aufdosierung von Venetoclax trat ein Tumorlyse-Syndrom nicht häufiger auf als im Vergleichsarm.
Die Autoren dieser Studie vergleichen ihre Ergebnisse mit drei kürzlich publizierten Studien, die Wirksamkeit und Sicherheit einer kontinuierlichen Therapie mit Ibrutinib verglichen haben mit der lange Zeit als Standard in der Behandlung von CLL-Patienten geltenden Chemo-/Immuntherapie. In diesen Studien wurde Ibrutinib (teilweise in Kombination mit Rituximab) – allerdings an Studienkollektiven, die sich hinsichtlich Alter und genetischen Risikofaktoren teilweise deutlich unterschieden – verglichen mit Bendamustin bzw. Fludarabin, jeweils plus Rituximab. Wir werden auf die Ergebnisse dieser Studien ausführlich eingehen, sobald alle drei Studien als Vollpublikationen vorliegen. Sie ergaben übereinstimmend eine Überlegenheit von Ibrutinib in der Erstlinientherapie der CLL gegenüber einer Chemo-/Immuntherapie, konnten allerdings den Nutzen einer zusätzlichen Gabe eines anti-CD20 moAk (Rituximab oder Obinutuzumab) zum BCR-Inhibitor nicht zweifelsfrei belegen (15-17).
Grundsätzlich sind diese therapeutischen Fortschritte in der Erstlinientherapie von CLL-Patienten natürlich zu begrüßen. Künftige Therapieentscheidungen werden jedoch sicher schwieriger angesichts der inzwischen zur Verfügung stehenden medikamentösen Alternativen (BCR-Inhibitoren; Venetoclax, evtl. in Kombination mit anti-CD20 monoklonalen Antikörper; Chemo-/Immuntherapie). Sie sollten sich deshalb vor allem orientieren an der Qualität und Aussagekraft der klinischen Studien sowie der teilweise sehr unterschiedlichen akuten oder bei langfristiger Einnahme auftretenden Toxizität bzw. den zahlreichen Arzneimittelwechselwirkungen beider neuer Wirkstoffe (1, 10, 12, 18, 19). Nur Ibrutinib ist derzeit in der Erstlinienbehandlung der CLL als Monotherapie uneingeschränkt zugelassen (12). Demgegenüber darf Venetoclax in der Erstlinientherapie nur Patienten mit 17p-Deletion oder TP53-Mutation verordnet werden, die für eine Behandlung mit BCR-Inhibitoren nicht geeignet sind (10). Bei diesen Therapieentscheidungen müssen aber auch immer die Präferenzen der Patienten berücksichtigt werden, die vor allem Parameter wie Wirksamkeit, NW, aber auch die Therapiekosten – besonders in den USA – unterschiedlich priorisieren (20).
Literatur
- AMB 2014, 48, 59 Link zur Quelle . AMB 2015, 49, 02. Link zur Quelle
- AMB 2016, 50, 36. Link zur Quelle
- https://www.awmf.org/uploads/ tx_szleitlinien/018-032OLl_S3_ Chronisch-lymphatische- Leukaemie_2018-04.pdf Link zur Quelle
- https://www.onkopedia.com/de/onkopedia/guidelines/ chronische-lymphatische-leukaemie-cll/ @@guideline/html/index.html Link zur Quelle
- Hallek, M., et al.: Blood 2018, 131, 2745. Link zur Quelle
- von Tresckow, J., et al.: Dtsch. Arztebl. Int. 2019, 116, 41. Link zur Quelle
- https://www.qxmd.com/calculate/cll-ipi Link zur Quelle
- Salvi, F., et al.: Richtlinien für das Scoring der Modified Cumulative Illness Rating Scale (CIRS). Link zur Quelle
- Jain, N., et al.: N. Engl. J. Med. 2019, 380, 2095. Link zur Quelle
- https://www.fachinfo.de/suche/fi/021277 Link zur Quelle (Venetoclax, Juni 2019).
- Hallek, M., et al.: Blood 2008, 111, 5446. Link zur Quelle . Erratum: Blood 2008, 112, 5259.
- https://www.fachinfo.de/suche/fi/022468 Link zur Quelle (Ibrutinib, März 2019).
- Wiestner, A.: N. Engl. J. Med. 2019, 380, 2169. Link zur Quelle
- Fischer, K. et al.: N. Engl. J. Med. 2019, 380, 2225. Link zur Quelle
- Woyach, J.A., et al.: N. Engl. J. Med. 2018, 379, 2517. Link zur Quelle
- https://lymphomahub.com/medical-information/ash -2018-ibrutinib-plus-rituximab- provide-superior-outcomes-than-fcr-in-naive-cll-patients-results- from-the-ecog-acrin-phase-iii-trial-e1912 Link zur Quelle
- Moreno, C., et al. (iLLUMINATE): Lancet Oncology 2019, 20, 43. Link zur Quelle
- Coutre, S.E., et al. (RESONATE und RESONATE-2): Blood Adv. 2019, 3, 1799. Link zur Quelle
- Brown, J.R.: Blood 2018, 131, 379. Link zur Quelle
- Mansfield, C., et al.: Blood Advances 2017, 1, 2176. Link zur Quelle