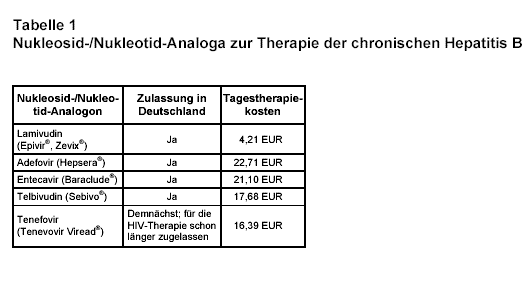
Die chronische Hepatitis B ist eine gefährliche Infektionskrankheit mit ca. 350 Mio Betroffenen weltweit und besonders hoher Inzidenz in den asiatischen Ländern. Es wird geschätzt, dass ca. eine Mio Menschen jährlich an den direkten Folgen der chronischen Hepatitis B sterben. Der beste Schutz vor dieser Infektion ist die Impfung. Die therapeutischen Möglichkeiten sind trotz der mittlerweile sechs zugelassenen Substanzen eingeschränkt. Eine anhaltende Elimination des Virus kann noch am ehesten durch eine Interferon-Behandlung erreicht werden (vgl. 1). Dies gelingt allerdings nur in einem kleinen Prozentsatz. Aus diesem Grund sind viele Patienten mit chronischer Hepatitis B auf die dauerhafte Behandlung mit Nukleosid-/Nukleotid-Analoga angewiesen (s. Tab. 1). Ein Hauptproblem hierbei ist jedoch die Entwicklung von Resistenzen, die zur Unwirksamkeit der betreffenden Substanz führen. Daher ist die Entwicklung neuer Medikamente zur Behandlung der Hepatitis B notwendig. Kürzlich wurde eine Behandlungsstudie (2) und ein lesenswerter Kommentar (3) zu einem auch in Deutschland neu zugelassenen Nukleosid-Analogon (Telbivudin = Sebivo®) in den Ann. Intern. Med. publiziert.
In einer prospektiven, randomisierten Studie (2) wurden 135 bis dato nicht therapierte HBe-Ag-positive Erwachsene mit chronischer Hepatitis B in drei Gruppen aufgeteilt. Dabei erhielt Gruppe A Telbivudin (n = 45), Gruppe B Adefovir (Hepsera®) jeweils für 52 Wochen (n = 44). Die Gruppe C wurde in den ersten 24 Wochen mit Adefovir behandelt und danach für weitere 28 Wochen auf Telbivudin umgestellt (n = 46). Die Studie wurde in China durchgeführt, einem Land mit hoher Inzidenz der chronischen Hepatitis B. Alle Patienten hatten erhöhte Leberwerte, und die Viruslast war in den drei Gruppen ähnlich hoch.
Von den eingeschlossenen 134 Patienten beendeten 131 die Studie nach 52 Wochen. Eine Patientin schied wegen Schwangerschaft aus, ein anderer auf eigenen Wunsch (beide aus Gruppe A), zwei weitere aus Gruppe B blieben im Laufe der Studie den Untersuchungsterminen fern. In keiner Gruppe traten schwere UAW auf. Die Autoren beschreiben nach 24 Wochen eine deutlichere Reduktion der HBV-DNA verglichen mit dem Ausgangswert (primärer Endpunkt) in der Telbivudin-Gruppe (A) gegenüber der Adefovir-Gruppe (B). Allerdings war dieser Unterschied nach 52 Wochen nicht mehr signifikant. Auch der Anteil der Patienten mit nicht mehr nachweisbarer HBV-DNA im Blut war in den drei Gruppen nicht mehr signifikant unterschiedlich (60% in A, 40% in B und 54% in C; A/B p = 0,07 und B/C p = 0,20) ebenso wie die HbeAg-Serokonversion nach 52 Wochen (A: 30%, B: 21% und C: 36%). Die Normalisierung der Transaminasen war in allen drei Gruppen – sowohl nach 24 als auch nach 52 Wochen – gleich. Bei keinem Patienten (A, B und C) kam es im Beobachtungszeitraum (24 und 52 Wochen) zu einer Serokonversion von HbsAg.
In dem Editorial zu dieser Arbeit werden die Ziele der Behandlung bei chronischer Hepatitis B und die Rolle der nun verfügbaren verschiedenen Nukleosid-/Nukleotid-Analoga diskutiert (3). Die Autoren betonen – was bei Pharmaindustrie-initiierten Studien häufig nicht genügend berücksichtigt wird – dass das Hauptziel die Verhinderung der Langzeitfolgen der chronischen Hepatitis B, d.h. Leberzirrhose und Leberzellkarzinom, sein muss. Da diese Endpunkte wegen der notwendigen langen Beobachtungszeit nur schwer zu erfassen sind, muss auf „weniger harte” Surrogat-Marker zurückgegriffen werden: Reduktion der Viruslast, Serokonversion von HBeAg und HBsAg. Ganz wichtig sind auch die Ergebnisse ein Jahr nach Ende der Behandlung. Sie werden bei den Studien mit Nukleosid-/Nukleotid-Analoga meist nicht angegeben, weil durch diese Substanzen in der Regel keine anhaltende Viruselimination erreicht wird („sustained response”).
Die hier vorgestellte Studie demaskiert deutlich die Taktik der von der Pharmaindustrie gesteuerten Studien zur Behandlung chronischer Virusinfektionen, speziell Hepatitis B, C und HIV. Anstelle der wichtigen Langzeitergebnisse werden Erfolge hervorgehoben, die in Kurzzeitbeobachtungen erzielt wurden. So wird zwar mit Telbivudin ein besseres Ergebnis nach 24 Wochen erzielt, das jedoch nach 52 Wochen nicht mehr signifikant ist. Die wichtige Information zu den virologischen Daten nach Absetzen der Therapie wird gar nicht erwähnt. Die 24-Wochen-Ergebnisse zeigen nur die Dynamik des Ansprechens, was angesichts einer chronischen Infektion nur als Zwischenergebnis zu werten ist. In diesem Zusammenhang wird häufig über die Verkürzung der Zeit bis zur Entwicklung von Resistenzen gesprochen. Dies ist jedoch schlecht zu belegen, da das Virus durch die Therapie nicht eliminiert wird. Bei den unterschiedlichen Preisen der Nukleosid-/Nukleotid-Analoga zur Behandlung der chronischen Hepatitis B sollte man sich daher die Initialtherapie sehr gut überlegen und sich nicht von 24-Wochen-Ergebnissen blenden lassen. Ein Wechsel von einer Substanz zur nächsten ohne Not birgt die Gefahr, Mutationen des Virus zu erzeugen und dadurch zukünftige Therapieoptionen für den Patienten unwirksam machen.
Fazit: Telbivudin ist ein neu zugelassenes Nukleosid-Analogon zur Behandlung der chronischen Hepatitis B, das schneller als Adefovir zu einer Reduktion der HBV-DNA führt. Nach 52 Wochen Behandlung ist der Unterschied jedoch nicht mehr signifikant. Bei der Behandlung der chronischen Hepatitis B mit Nukleosid-/Nukleotid-Analoga sind aber vor allem die Langzeitergebnisse wichtig. Diese fehlen häufig in Studien, die von der Pharmaindustrie initiiert sind. Ein Wechsel der Therapie ohne Not von einer Substanz zur nächsten birgt die Gefahr von Virusmutationen, die weitere Therapieoptionen unwirksam machen können.
Literatur
- AMB 2005, 39, 25. Link zur Quelle
- Chan,H.L, et al. (018 study group): Ann. Intern. Med. 2007, 147, 745. Link zur Quelle
- Feld, J.J., und Ghany, M.G.: Ann. Intern. Med. 2007, 147, 806. Link zur Quelle