In einem Cochrane-Review wurde der Effekt von Strontiumranelat zur Prävention der postmenopausalen Osteoporose außerordentlich positiv bewertet (1). Laut Cochrane konnten in drei Studien mit 5254 Frauen durch die tägliche Einnahme von 2 g Strontiumranelat über drei Jahre Wirbelfrakturen zu 37% verhindert werden (RR: 0,63; 95%-Konfidenzintervall = CI: 0,56-0,71). In zwei Studien mit 6572 Frauen (2 g/d drei Jahre lang) konnten nicht-vertebrale Frakturen um 14% reduziert werden (RR: 0,86; CI: 0,75-0,98). Bei der getrennten Auswertung von Frakturen der Hüftregion zeigte sich kein signifikanter Vorteil von Strontium.
Auch die Knochendichte wurde in diesem Review untersucht. Sie steigt dosisabhängig an, wobei aber zu beachten ist, dass durch die höhere Absorption der Röntgenstrahlen durch das eingelagerte Strontium ein Messfehler bei der DXA (Dual X-ray absorptiometry) auftritt. Hierfür wurde zwar im Cochrane-Review ein Anpassungsfaktor auf der Basis des Strontiumgehalts in der Knochenbiopsie angewendet. Der tatsächliche Anteil dieses Artefakts an der Erhöhung der gemessenen Werte unter der Therapie ist jedoch noch unklar (1).
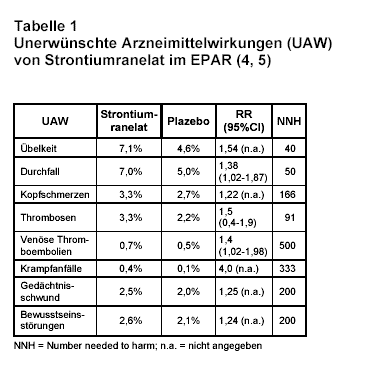
Die Studienabbrüche wegen UAW werden als nicht signifikant gegenüber Plazebo angegeben (drei Studien mit 6847 Patienten; Einnahme von 2 g Strontiumranelat/d; RR: 0,98; CI: 0,91-1,05). Die häufigste UAW war Diarrhö. Diese trat in der Therapiegruppe mit 6,5% im Vergleich zur Plazebo-Gruppe mit 4,7% signifikant häufiger auf (RR: 1,38; CI: 1,02-1,87; Number needed to harm = NNH: 56; 1).
Trotz dieser positiven Cochrane-Bewertung muss die Therapie mit Strontium kritisch betrachtet werden. Die Übersicht stützt sich praktisch ausschließlich auf die SOTI- und TROPOS-Studie, beides Phase-III-Studien, die auch für die europäische Zulassung eingereicht wurden (2, 3). Der Beurteilungsbericht der europäischen Arzneimittelbehörde (European Public Assessment Report = EPAR), eine Zusammenfassung der wissenschaftlichen Erkenntnisse der Zulassungsbehörden, zitiert jedoch noch weitere Daten aus diesen beiden Studien (4, 5). Dem EPAR wurden offenbar Verlaufsdaten über fünf Jahre zugrunde gelegt, während die im Cochrane-Review verwendeten Publikationen der beiden Studien nur Daten der ersten drei Therapiejahre beinhalten. Die im EPAR aufgeführten UAW von Strontiumranelat sind in Tab. 1 aufgeführt. In beiden Studien werden laut EPAR vertebrale Frakturen signifikant vermindert, nicht-vertebrale Frakturen – der primäre Endpunkt in der TROPOS-Studie – jedoch nicht. Der EPAR kommt in diesem Punkt also zu einem anderen Ergebnis als der Cochrane-Review.
Hüftfrakturen werden in der Gesamtgruppe der TROPOS-Studie ebenfalls nicht signifikant beeinflusst (RR: 0,85; CI: 0,61-1,19). Die Studie war allerdings auf diesen Endpunkt nicht primär angelegt und somit auch nicht hinreichend dafür „gepowert”. In einer nachträglich definierten Subgruppe aller Frauen von mindestens 74 Jahren mit erniedrigter Knochendichte an der Hüfte (3) ergibt sich für Strontium ein nominell knapp signifikanter Vorteil (RR: 0,64; CI: 0,412-0,997). Als nachträglich definierte Subgruppe in einer primär negativ ausgefallenen Studie hat dieses Ergebnis unseres Erachtens jedoch keine Aussagekraft. Dies gilt auch für eine gepoolte Auswertung von SOTI- und TROPOS-Studie in der nachträglich definierten Subgruppe der mindestens 80-jährigen Frauen, bei denen Strontiumranelat das Risiko nicht-vertebraler Frakturen signifikant senken soll (6).
In beiden Phase-III-Studien fällt der hohe Anteil der in der Nachbeobachtung verloren gegangenen Patientinnen auf: In der SOTI-Studie sind es 23,6%, in der TROPOS-Studie sogar 34,8% (2, 3). Die Vertrauenswürdigkeit der noch ausstehenden Publikation der Fünf-Jahres-Daten ist in Anbetracht dieses Patientenschwunds stark eingeschränkt. Wegen des marginal signifikanten Ergebnisses beim primären Endpunkt (nicht-vertebrale Frakturen) und wegen der hohen Verluste in der Nachbeobachtung in den beiden Phase-III-Studien lassen sich Aussagen über einen klinischen Nutzen von Strontiumranelat bisher nur mit großer Unsicherheit treffen. Zudem gibt es eine Reihe von UAW, wobei vor allem die schweren vaskulären (venöse Thromboembolien) und zentralnervösen UAW (z.B. Kopfschmerzen, Bewusstseinsstörungen, Krampfanfälle) unter Strontium beunruhigend sind. Nach Einschätzung der EMEA ist weiter unklar, ob auch beim Menschen bei Langzeiteinnahme von Strontium die im Tierversuch schädlichen Auswirkungen auf den Knochen eine Rolle spielen können (Osteomalazie mit Spontanfrakturen). Offen ist zudem die klinische Bedeutung der signifikanten Zunahme von Karzinomen der Calcitonin-sezernierenden C-Zellen der Schilddrüse bei männlichen Ratten.
Aktuell wurde von der EMEA eine Warnung herausgegeben, dass es unter der Einnahme von Strontiumranelat zu Überempfindlichkeitsreaktionen wie Stevens-Johnson-Syndrom und dem mit Beteiligung innerer Organe einhergehenden Hypersensitivitätssyndrom (DRESS = Drug Rash with Eosinophilia and Systemic Symptoms = Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen) kommen kann (7, 8).
Sowohl Kosteneffektivität als auch Sicherheit von Bisphosphonaten sind nach Ansicht eines Health Technology Assessments als deutlich höher zu bewerten (9). Die Tagestherapiekosten von Protelos® sind mit etwa 1,70 EUR/d knapp dreimal so hoch wie die von Alendronat (0,60 EUR/d bei wöchentlicher Gabe). Es besteht daher bisher in der Regel keine Veranlassung, postmenopausalen Frauen mit Osteoporose Strontiumranelat statt Bisphosphonat zu rezeptieren. Aus diesem Grunde wurde Strontiumranelat von der FDA bisher auch nicht zugelassen.
Fazit: Angesichts der nicht mit Sicherheit auszuschließenden lebensbedrohlichen thromboembolischen und schwerwiegenden zentralnervösen Komplikationen und des durch klinische Studien nicht belegten zusätzlichen Nutzens bewerten wir die Nutzen-Risiko-Relation von Strontiumranelat derzeit als negativ, zumal eine besser abgesicherte Therapie (Bisphosphonate) zur Verfügung steht.
Literatur
- Cochrane Review: O’Donell, S., Cranney, A., Wels, G.A.: Strontium ranelate for preventing and treating postmenopausal osteoporosis. Cochrane Database of Systematic Reviews 2006, Issue 4.
- Meunier, P.J., et al. (SOTI = Spinal Osteoporosis Therapeutic Intervention): N. Engl. J. Med. 2004, 350, 459 Link zur Quelle; s.a. AMB 2004, 38, 30b. Link zur Quelle
- Reginster, J.Y., et al. (TROPOS = TReatment Of Peripheral OSteoporosis): J. Clin. Endocrinol. Metab. 2005, 90, 2816. Link zur Quelle
- EMEA: Protelos: Anhang I. Zusammenfassung der Merkmale des Arzneimittels Link zur Quelle
- EMEA: Scientific Discussion Link zur Quelle
- Seeman, E., et al.: J. Bone Miner. Res. 2006, 21, 1113. Link zur Quelle
- EMEA press release: EMEA recommends changes in the product information for PROTELOS/OSSEOR, 16. Nov. 2007; Link zur Quelle
- Agence francaise de sécurité sanitaire des produits de santé (Afssaps): Communiqué de presse PROTELOS, 19. Nov. 2007; Link zur Quelle
- Stevenson, M., et al.: Health Technology Assessment 2007, Vol. 11, Number 4; Link zur Quelle