Zusammenfassung: Das therapeutische Vorgehen bei Patienten mit hepatozellulärem Karzinom oder mit Lebermetastasen kolorektaler Karzinome hängt im wesentlichen von der Zahl, Größe und Lokalisation der Leberläsionen, vom Stadium der eventuell zugrundeliegenden Lebererkrankung sowie vom Allgemeinzustand ab. Patienten mit kleinem, solitärem hepatozellulärem Karzinom können bei ausreichender Leberfunktion durch Resektion, ausgewählte Patienten auch durch Lebertransplantation kurativ behandelt werden. Bei Lebermetastasen sind im Vergleich zum hepatozellulären Karzinom ausgedehntere Resektionen möglich, da hier meist keine Leberzirrhose vorliegt. Bei inoperablen Patienten oder fortgeschrittenem Tumorstadium mit großen oder multiplen Läsionen stehen verschiedene palliative Möglichkeiten zur Verfügung: perkutane Ethanol-Injektion (PEI) und/oder transarterielle Chemotherapie mit oder ohne Embolisation (TACE). Diese Maßnahmen können, gezielt eingesetzt, wahrscheinlich zu einer Lebensverlängerung führen. Mit neuen „ablativen Techniken“, wie z.B. Thermo- oder Kryosonden konnten in Pilotstudien bei fokalen malignen Leberläsionen günstige Ergebnisse erzielt werden. Vor einer Verbreitung dieser Techniken muß ihre Wirksamkeit in kontrollierten Studien evaluiert werden.
Bei primär nicht resektablen Lebermetastasen kolorektaler Karzinome ist die systemische Chemotherapie mit 5-Fluorouracil und Folinsäure etabliert. Das optimale therapeutische Vorgehen muß in Abhängigkeit vom Allgemeinzustand des Patienten, dem Tumorstadium und der Leberfunktion individuell festgelegt werden. Wegen der vielfältigen Behandlungsansätze sollte ein erfahrenes Zentrum in die Planung und Durchführung der Therapie einbezogen bzw. die Patienten in kontrollierte klinische Studien eingeschlossen werden.
Einleitung: Zur Therapie des hepatozellulären Karzinoms (HCC) und der Lebermetastasen beim kolorektalen Karzinom stehen chirurgische und nichtchirurgische Verfahren zur Verfügung. Resektion und orthotope Lebertransplantation bei ausgewählten Patienten sind die einzig kurative Therapie. Bei der Erstdiagnose eines HCC ist bei den meisten Patienten das Tumorstadium oder die Leberinsuffizienz jedoch so weit fortgeschritten, daß ein chirurgisches Vorgehen nicht mehr indiziert ist. Bei ca. 80% der Patienten mit HCC besteht eine Assoziation mit Leberzirrhose. Die Leberzirrhose ist deshalb als Präkanzerose zu betrachten.
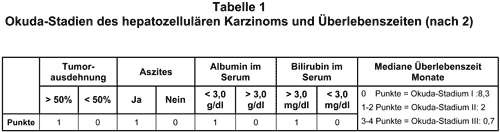
Stadieneinteilung und Prognose: Das HCC ist klinisch hochmaligne. Unbehandelt ist die Prognose sehr schlecht. Sie wird im wesentlichen bestimmt durch Tumorgröße, Zahl der Tumorherde, mögliche Gefäßinvasion oder Pfortaderthrombose, Höhe des Alpha-Fetoproteins (AFP) im Serum und Schweregrad der Leberfunktionsstörung (1). Die durchschnittliche Überlebenszeit der Patienten, die bei Diagnosestellung meist schon Symptome haben, beträgt gewöhnlich nur einige Monate. Okuda, K., et al. definierten ein Punktesystem zur Stadieneinteilung des HCC mit prognostischer Aussagekraft (2; s. Tab. 1). Die TNM-Klassifikation berücksichtigt neben der Größe des Primärtumors auch die intrahepatische Metastasierung, die Lokalisation, die Gefäßinvasion sowie Lymphknoten- und Fernmetastasen (3). Unsicherheiten bei der Einordnung in die TNM-Klassifikation ergeben sich bei nicht operierten Patienten dadurch, daß die Evaluation des Lymphknotenstatus wegen der geringen Sensitivität der bildgebenden Verfahren eingeschränkt ist. Auf der TNM-Klassifikation basierend wird das HCC nach der „Union International contre le Cancer“ in vier Stadien eingeteilt. Das Ausmaß der Leberfunktionsstörung bei Leberzirrhose wird mit dem Child-Pugh-Score klassifiziert (4). Auf die diagnostischen Strategien fokaler LeberIäsionen kann hier nicht weiter eingegangen werden (Übersicht bei 5).
Transarterielle Chemoembolisation (TACE): Die TACE hat bei der palliativen Behandlung inoperabler Patienten mit HCC, die primär nicht für eine perkutane Ethanol-lnjektion geeignet sind, weite Verbreitung gefunden (6-8). Grundlage der TACE ist die besondere Blutversorgung der HCC, die zu fast 80% über die A. hepatica erfolgt. Im Gegensatz dazu wird normales Lebergewebe zu ca. 75% über die Pfortader und zu nur 25% über die A. hepatica versorgt. Nach transfemoraler Sondierung der A. hepatica propria wird eine ölige Emusion, bestehend aus Lipiodol und einem Chemotherapeutikum (z.B. Mitomycin C) injiziert. Lipiodol dient dabei als Trägersubstanz, die sich in den Tumorzellen anreichert; daneben hat Lipiodol auch einen Antitumor-Effekt. Durch die Kombination mit dem Chemotherapeutikum wird dessen Verweildauer bzw. Konzentration im Tumor erhöht (9). Danach erfolgt die passagere Embolisation der Tumorgefäße mit z.B. kleinen Gelatinepartikeln. Die portal-venöse Leberperfusion wird durch TACE nicht negativ beeinflußt. Um einen optimalen therapeutischen Effekt zu erreichen, sind in der Regel mehrere TACE-lnterventionen im Abstand von 8 bis 12 Wochen erforderlich. Als sog. Post-Embolisations-Syndrom können abdominelle Schmerzen, Erbrechen, subfebrile/febrile Temperaturen, Anstieg der Entzündungsparameter bzw. der Transaminasen und eine passagere Verschlechterung der Leberfunktion auftreten. Kontraindiziert ist die TACE bei Thrombose des Pfortaderhauptstamms bzw. bei Patienten mit retrogradem Pfortaderfluß. Durch TACE wurde über ein signifikant längeres Überleben im Vergleich zu unbehandelten Patienten berichtet (8). Dabei korrelierte die Lipiodolspeicherung mit der mittleren Überlebenszeit. So wurde durch TACE die Ein-Jahres-Überlebensrate von 18% auf 64% und die Drei-Jahres-Überlebensrate von 5% auf 27% im Vergleich zur unbehandelten Kontrollgruppe verbessert (8); allerdings handelte es sich um historische Kontrollen. Im Gegensatz dazu konnte in einer prospektiven, kontrollierten Studie kein signifikanter Effekt der TACE gezeigt werden (10; s.a. AMB 1995, 29, 67). Durch die Behandlung wurde zwar eine signifikante Abnahme der Tumorgröße bzw. der AFP-Konzentration erreicht, gleichzeitig verschlechterte sich jedoch deutlich die Leberfunktion. Trotz Rückgangs des HCC war die Überlebensrate in der TACE-Gruppe (38% nach 2 Jahren) durch die eingetretene Leberinsuffizienz gegenüber den unbehandelten Patienten (26% nach 2 Jahren) nur gering besser (10). Da diese Studie multizentrisch und mit nur 50 Patienten in 24 Zentren in 3 Ländern durchgeführt wurde, sind diese Ergebnisse als vorläufig zu werten. Weitere prospektive, kontrollierte Studien zur Wirksamkeit der TACE sind deshalb erforderlich. In einer retrospektiven, vergleichenden Analyse von 122 Patienten mit HCC im Okuda-Stadium 1 war die Fünf-Jahres-Überlebensrate in den Behandlungsgruppen mit TACE, Resektion bzw. orthotoper Lebertranspantation mit ca. 45% sehr ähnlich und wesentlich besser als in der nicht behandelten Gruppe. Rezidive des HCC bzw. eine diffuse Metastasierung waren in der TACE-Gruppe am niedrigsten (6).
Das Konzept einer regionalen Chemotherapie inoperabler Lebermetastasen kolorektaler Karzinome beruht auf dem Befund, daß Lebermetastasen überwiegend arteriell perfundiert werden. Durch die Gabe von Zytostatika in die A. hepatica kann somit lokal eine deutlich höhere und damit potentiell effektivere Konzentration erreicht werden. Als Chemotherapeutika kommen die fluorierten Pyrimidine 5-Fluoro-2-deoxyuridin (FUDR) und 5-Fluorouracil (5-FU) in Frage wegen ihrer hohen hepatischen Eliminationsrate. In randomisierten Studien konnten zwar höhere Remissionsraten gegenüber der systemischen Chemotherapie erreicht werden, hinsichtlich der Überlebensrate ergab sich jedoch kein signifikanter Unterschied (11, 12). Nachteile der regionalen Chemotherapie sind die notwendige Laparotomie, hohe Kosten (Pumpen), chirurgische und technische Probleme (z.B. des Pumpen-, Port- und Kathetersystems) sowie Nebenwirkungen (sklerosierende Hepatitis usw.). Die regionale Chemotherapie ist als experimentelle Therapie zu betrachten und sollte nur innerhalb klinischer Studien erfolgen.
Perkutane Ethanol-lnjektion (PEI): Zu Beginn der achtziger Jahre wurde erstmals aus Japan über die Behandlung des HCC durch wiederholte ultraschallgesteuerte PEI berichtet (13). Nach der Instillation diffundiert der Alkohol in das Tumorgewebe und erzeugt lokal eine Koagulationsnekrose. Die Schädigung der Tumorzellen ist indirekt und erfolgt durch Thrombose der kleinen tumorversorgenden Gefäße mit konsekutiver lschämie. Der toxische Effekt des Alkohols wurde histologisch im Tierversuch und bei HCC-Patienten demonstriert. Es liegen inzwischen Daten von mehreren tausend PEI-Behandlungen bei HCC-Patienten vor. In zahlreichen, allerdings retrospektiven Studien konnte die Wirksamkeit dieser Behandlungsmethode durch eine Verbesserung der Überlebensraten gezeigt werden (14-17). Die einfach durchzuführende und kostengünstige PEI ist bei Patienten mit maximal drei Tumorherden mit einem Durchmesser bis zu 5 cm bei guter Leberfunktion (Child-Pugh A oder B) indiziert (18). Fernmetastasen und Thrombose des Pfortaderhauptstamms sind Kontraindikationen. Die PEI ist komplikationsarm. Vorübergehend können Schmerzen und Fieber auftreten. Stichkanal-Metastasen nach PEI sind selten und bisher nur in Fallberichten dokumentiert. Offenbar verringert der in den Punktionskanal zurücklaufende Alkohol nach Entfernen der Nadel die Aussaat von Tumorzellen. Die Drei-Jahres-ÜberIebensraten betragen nach PEI bei kleinem HCC 72% bis 76% (Child-Pugh A) und sind vergleichbar mit den Ergebnissen nach Resektion (19, 20). Ähnlich wie bei der Resektion beeinflussen Tumorgröße, Anzahl der Läsionen und Leberfunktion den Therapieerfolg. Beispielsweise profitieren Patienten mit Leberzirrhose im Child-Pugh-Stadium C aufgrund ihrer primär schlechten Prognose (tumorunabhängiger Tod durch Leberinsuffizienz) in der Regel nicht von der PEI. Gute Drei- bzw. Fünf-Jahres-Überlebensraten nach PEI bei solitären HCC (Duchmesser < 5 cm) und Leberzirrhose zeigt eine kürzlich publizierte Studie: Child-Pugh A (n = 293): 79% bzw. 47%; Child-Pugh B (n = 149): 63% bzw. 29% und Child-Pugh C (n = 20): 12% bzw. 0% (21). In einer weiteren Studie wurden 105 HCC-Patienten mit 125 Leberläsionen (82 Patienten mit solitärem HCC, Durchmesser < 5 cm und 23 Patienten mit multinodulärem HCC, Durchmesser < 3 cm) mit PEI behandelt (22). Die Drei-Jahres-Überlebensrate betrug in der Child-A-Gruppe 87%, in der Child-B-Gruppe 53%. Während der Nachbeobachtung entwickelten 52% ein HCC-Rezidiv. Die HCC-Rezidive waren zu 94% außerhalb des Primärtumors lokalisiert und sind damit in Wirklichkeit Tumorneubildungen in der meist zirrhotischen Leber. Ähnliche Rezidivraten nach primär erfolgreicher PEI bzw. Resektion wurden auch in anderen Studien gezeigt (23). Da bisher keine prospektive, randomisierte Studie zum direkten Vergleich der Resektion versus PEI beim HCC bei Leberzirrhose vorliegt, hat die Abteilung Gastroenterologie/Hepatologie der Medizinischen Universitätsklinik in Zusammenarbeit mit der Chirurgischen Universitätsklinik Freiburg i. Br. seit Anfang 1997 eine kontrollierte Studie zu dieser Frage begonnen. Aufgrund der positiven Erfahrungen mit PEI beim HCC wurde diese Therapie auch bei Patienten mit Lebermetastasen durchgeführt. In einer Studie wurden 55 Lebermetastasen überwiegend kolorektalen Ursprungs (maximal 3 Metastasen pro Patient, Durchmesser < 5 cm) bei insgesamt 40 Patienten mit PEI behandelt (24). Eine komplette Nekrose konnte bei 55% der Läsionen erreicht werden. Die mittlere Überlebenszeit aller 40 Patienten betrug 21 Monate, entsprechend einer Drei-Jahres-Überlebensrate von 40%. Bemerkenswert ist, daß Patienten mit kompletter Tumornekrose nach PEI eine signifikant längere Überlebenszeit hatten (38 Monate versus 21 Monate bei inkompletter Nekrose). Da zur PEI bei Lebermetastasen nur wenig Daten vorliegen, sollte diese Therapieform nur in klinischen Studien angewandt werden. Therapie: Die systemische Mono- oder Polychemotherapie des HCC mit Zytostatika alleine oder in Kombination mit Interferon alpha führte zu keiner signifikanten Verbesserung der Überlebenszeit (25-27). Vielmehr traten vor allem unter den Kombinationen zum Teil erhebliche toxische Nebenwirkungen auf. Eine Verbesserung der Überlebenszeit bei ausgedehntem HCC durch Behandlung mit dem Anti-Östrogen Tamoxifen wurde in einigen Studien gezeigt (28, 29). Die bisher größte, doppeltblinde, plazebokontrollierte Studie zu diesem Thema konnte jedoch keinen signifikanten Vorteil der Tamoxifen-Behandung nachweisen (30).
Die wirksamste Substanz in der Behandlung metastasierter kolorektaler Karzinome ist 5-FU. Als Monotherapie brachte 5-FU jedoch nur geringe Remissionsraten (unter 20%) und keine Verlängerung der Überlebenszeit. Modifikationen der Applikation, der Therapiedauer und der Dosis des 5-FU ergaben ebenfalls keine Vorteile. Trotz signifikant höherer Remissionsraten bei Dauerinfusion gegenüber der iv. Bolusgabe von 5-FU waren die Überlebenszeiten nicht besser (31). Auch Kombinationen mit anderen Zytostatika führten nicht zu längerem Überleben. Zur Verbesserung der antitumoralen Wirksamkeit des 5-FU wurden viele Substanzen erprobt („biochemische Moduation“; Übersicht bei 32). Die meisten Erfahrungen liegen zur Kombination von 5-FU mit Folinsäure (FS) vor (s.a. AMB 1994, 28, 94). In kontrollierten Studien wurden höhere Remissionsraten mit dieser Kombination im Vergleich zu 5-FU-Monotherapie erzielt. Einige Studien ergaben allerdings keinen Überlebensvorteil (33). Die Frage nach dem besten Behandlungsprotokoll wird noch diskutiert. Als Standard gilt derzeit die Gabe von 5-FU (425 mg/m2) plus FS (20 mg/m2) jeweils als i.v. Bolus am Tag 1 bis 5 mit einer Wiederholung alle vier Wochen (32). Die Wirksamkeit weiterer biochemischer Modulatoren des 5-FU wird z.Z. in klinischen Studien untersucht. Die Indikationen für eine palliative Chemotherapie bei gutem Allgemeinzustand des Patienten sind Tumorprogredienz, tumorbedingte Symptome sowie ausdrücklicher Wunsch des Patienten.
Strahlentherapie: Zur externen Strahlentherapie des HCC liegen nur wenige Daten vor. Trotz der hohen Strahlendosis von 50 bis 70 Gy sprachen nur drei von sieben Patienten partiell an (34). Bei der Autopsie zeigte sich bei allen noch vitales Tumorgewebe und eine erhebliche Atrophie des nichttumorösen Lebergewebes, die klinisch bei vier von sieben Patienten zu einer Leberinsuffizienz führte. In den letzten Jahren wurde deshalb eine „interne“ Radiotherapie durch intraarterielle Injektion von 131Jod-Lipiodol entwickelt. Aufgrund einer hohen selektiven Tumordosis (12-43 mGy/Mbq; 44-160 rad/mCi) bei akzeptablem Tumor/Nichttumor-Verhältnis (1,21/1 bis 4,7/1) wurde ein therapeutischer Einsatz möglich. In Studien wurde eine palliative Wirkung gezeigt. Eine mögliche Indikation könnte bei HCC-Patienten mit Pfortaderthrombose bestehen, da durch die Radio-Lipiodoltherapie die arterielle Perfusion der Leber nicht wesentlich beeinträchtigt wird (35). Nach mehrmaliger Applikation von jeweils 2,2 GBq (60 mCi) 131Jod-Lipiodol während eines Zeitraums von 12 Monaten war das Sechs-Monats-Überleben signifikant besser als bei nicht-behandelten Patienten (48% vs. 0%). Nebenwirkungen oder Komplikationen traten innerhalb der kurzen Nachbeobachtungsphase nicht auf (35).
Neuere Entwicklungen und multimodale Therapie: Ein neuer Weg zur Lokalbehandung fokaler maligner Leberläsionen ist die Verwendung anderer Substanzen statt des hochprozentigen Alkohols. So wurde z.B. die ultraschallgesteuerte, perkutane Injektion von heißer NaCI-Lösung oder Essigsäure bei HCC-Patienten evaluiert (36). Der therapeutische Effekt scheint dem der PEI sehr ähnlich zu sein. Die Ergebnisse lokaler Thermo- oder Kryo-Tumorablation mit verschiedenen technischen Varianten (z.B. MikrowelIen-Koagulation, ultraschallgesteuerte perkutane, Iaparoskopische oder operative Laser- oder Radio-Frequenz-Gewebsablation) beim HCC und bei Lebermetastasen sind erfolgversprechend, müssen aber in kontrollierten Studien evaluiert werden (37). Die Kombination der TACE mit ultraschallgesteuerter PEI verbesserte die Effektivität und verminderte die Toxizität gegenüber der Monotherapie, insbesondere bei ausgedehnten Tumoren (38). Die Analyse der Ergebnisse nicht-operativer Therapieverfahren bei HCC-Patienten der Freiburger Universitätsklinik (n = 77) läßt unter der Kombinationstherapie PEI plus TACE (n = 22) bei größeren und/oder multiplen HCC ebenfalls einen günstigen Trend erkennen. Muto et al. berichteten kürzlich über eine geringere lnzidenz von Zweit-HCC bei Patienten, die nach primär erfolgreicher Leberresektion oder PEI kleiner, solitärer HCC postinterventionell mit einem synthetischen Vitamin-A-Säure-Derivat behandelt wurden (39). Vor einer abschließenden Beurteilung dieser interessanten Beobachtung sind weitere kontrollierte Studien mit größeren Fallzahlen erforderlich. Gentherapeutisch gibt es bereits mehrere Konzepte zur Behandlung des HCC. Diese molekularen Therapiestrategien sind jedoch noch nicht für den klinischen Einsatz verfügbar und werden wahrscheinlich Teil multimodaler Behandlungskonzepte sein.
Tomudex (ZD 1694) ist ein neues Zytostatikum, das durch direkte Hemmung der Thymidilat-Synthese die Thymidin- und damit die DNA-Synthese blockiert. Die bisherigen Studien mit Tomudex bei Patienten mit fortgeschrittenem kolorektalem Karzinom und Lebermetastasen bei ca. 80% der Patienten zeigten eine gute Wirksamkeit und ein günstiges Nebenwirkungsprofil (40, 41). Im direkten Vergleich von insgesamt 439 Patienten mit der Standardtherapie 5-FU/FS war die Ansprechrate unter Tomudex signifikant höher, die Toxizität vermindert, die Überlebenszeit jedoch nicht länger. Bedingt durch die günstige Applikationsweise (Kurzinfusion über 15 Minuten alle 3 Wochen, Dosierung: 3 mg/m2 Körperoberfäche) war die Verweilzeit im Krankenhaus bei Behandlung mit Tomudex deutlich niedriger (40). Eine Weiterentwicklung der fluorierten Pyrimidine ist das oral applizierbare Capecitabin. Es wurde bereits in Phase-Il-Studien mit guter Wirksamkeit und akzeptabler Toxizität eingesetzt. Zur weiteren Beurteilung dieser Substanz müssen aber die Ergebnisse derzeit laufender klinischer Studien abgewartet werden.
Literatur
1. Barbara, L., et al.: Hepatology 1992, 16, 132.
2. Okuda, K., et al.: Cancer 1985, 56, 918.
3. Liver (including intrahepatic bile duct). In: American Joint Committee on Cancer. Manual for Staging of Cancer. Lippincott CP Company, Philadelphia 1992, S. 89.
4. Pugh, R.N.H., et al.: Br. J. Surg. 1973, 60, 646.
5. Allgaier, H.-P., et al.: Schweiz. Med. Wochenschr. 1996,126, 1975.
6. Bronowicki, J.P., et al.: J. Hepatol. 1996, 24, 293.
7. Bismuth, H., et al.: Am. J. Surg. 1992, 163, 387.
8. Stefanini, G.F., et al.: Cancer 1995, 75, 2427.
9. Kanematsu, T., et al.: Hepatol. Gastroenterol. 1990, 37, 442.
10. Groupe d Etude et de Traitement du Carcinome Hepatocellulaire: N. EngI. J. Med. 1995, 332, 1256.
11. Chang, A.E., et al.: Ann. Surg. 1987, 206, 685.
12. Martin, J.K. Jr., et al.: Arch. Surg. 1990, 125, 1022.
13. Sugiura, N., et al.: Acta Hepatol. Jpn. 1983, 24, 920.
14. Livraghi, T., et al.: Cancer 1992, 69, 925.
15. Okuda, K.: J. Surg. Oncol. Suppl. 1993, 3, 97.
16. Solmi, L., et al.: Hepatol. Gastroenterol. 1993, 40, 505.
17. Shiina, S., et al.: Am. J. Roentgenol. 1987, 149, 949.
18. Allgaier, H.-P., et al.: Schweiz. Rundschau Med. (Praxis) 1997, 86, 86.
19. Castells, A., et al.: Hepatology 1993, 18, 1121.
20. Kotoh, K., et al.: Am. J. Gastroenterol. 1994, 89, 194.
21. Livraghi, T., et al.: Radiology 1995, 197, 101.
22. Lencioni, R., et al.: Cancer 1995, 76, 1737.
23. Ebara, M., et al.: J. Gastroenterol. Hepatol. 1990, 5, 616.
24. Giovannini, M., und Seitz, J.F.: Cancer 1994, 73, 294.
25. Cheirsilpa, A., et al.: Cancer Chemother. Pharmacol. 1989, 24, 50.
26. Falkson, G., et al.: Cancer 1987, 60, 2141.
27. Thongprasert, S., et al.: Eur. J. Cancer Clin. Oncol. 1988, 24, 1795.
28. Cerezo, F.J.M., et al.: J. Hepatol. 1994, 20, 702.
29. Engstrom, P.F., et al.: Cancer 1990, 65, 2641.
30. Castells, A., et al.: Gastroenterology 1995, 109, 917.
31. Weinerman, B., et al.: Proc. Am. Soc. Clin. Oncol. 1990, 9, 103.
32. Moertel, C.G.: N. Engl. J. Med. 1994, 330, 1136.
33. Poon, M.A., et al.: J. Clin. Oncol. 1989, 7, 1407.
34. Aoki, K., et al.: Hepatol. Gastroenterol. 1994, 41, 427.
35. Raoul, J.L., et al.: J. Nucl. Med. 1994, 35, 1782.
36. Ohnishi, K., et al.: Hepatology 1996, 23, 994.
37. Rossi, S., et al.: AJR 1996, 167, 759.
38. Koda, M., et al.: Hepatol. Gastroenterol. 1994, 41, 25.
39. Muto, Y., et al.: N. Engl. J. Med. 1996, 334, 1561.
40. Cunningham, D., et al.: Eur. J. Cancer 1995, 31 A, 1945.
41. Zalcberg, J.R., et al.: J. Clin. Oncol 1996, 14, 716.