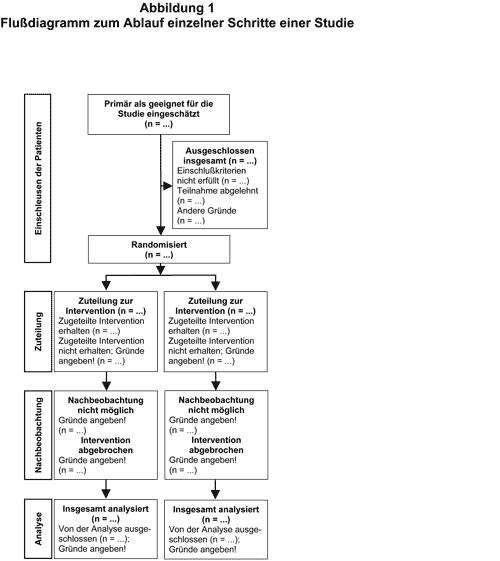
Randomisierte klinische Studien gelten heute neben Metaanalysen als höchste Kategorie der Evidenz hinsichtlich der Beurteilung eines Medikaments bzw. einer therapeutischen Maßnahme. Wir sind kürzlich ausführlich auf die weitreichenden Anforderungen an die Qualität großer klinischer Studien und auf Faktoren, die deren Aussagefähigkeit gefährden, eingegangen (vgl. AMB 1999, 33, 25). Eine internationale Gruppe von Klinikern, Statistikern, Epidemiologen und Herausgebern biomedizinischer Zeitschriften hat 1996 erstmalig CONSORT(Consolidated Standards of Reporting Trials)-Richtlinien erarbeitet, die eine Checkliste zu verschiedenen inhaltlichen Punkten sowie zur Darstellung klinischer Studien und ein Flußdiagramm zur Beschreibung von Therapieausschlüssen, Studienabbrüchen und zur Zahl der tatsächlich analysierten Patienten beinhalten (1). Ziele dieser in verschiedene Sprachen übersetzten Richtlinien waren insbesondere die verbesserte Darstellung randomisierter Studien und eine dadurch für den Leser verbesserte Transparenz hinsichtlich Design, Durchführung, Analyse und Interpretation. Zahlreiche biomedizinische Zeitschriften haben sie in ihre Vorgaben für Autoren übernommenen. Inzwischen wurden die Checkliste und das Flußdiagramm überarbeitet und als revidierte Fassung der CONSORT-Richtlinien zeitgleich in drei führenden medizinischen Zeitschriften publiziert (2) sowie in einem Editorial kommentiert (3). Die aktuelle Checkliste mit inhaltlichen Erläuterungen und den rationalen Grundlagen zu jedem einzelnen Punkt der Checkliste sowie das Flußdiagramm (s. Abb. 1) sind auch im Internet verfügbar (4). Es bleibt zu hoffen, daß sich möglichst viele, insbesondere auch deutsche biomedizinische Zeitschriften an diesen aktuellen CONSORT-Richtlinien orientieren und daß dadurch die Qualität der Publikationen sowie die Einschätzung der Validität von Studienergebnissen verbessert wird. Dies könnte dann nicht nur das rasche Umsetzen von Ergebnissen großer Studien in die klinische Praxis erleichtern, sondern auch die zunehmende Flut der in Hochglanzbroschüren der pharmazeutischen Industrie unkritisch, häufig auch tendenziös dargestellten Studienergebnisse eindämmen.
Literatur
1. Begg, C.B., et al.: JAMA 1996, 276, 637.
2. Moher, D., et al.: JAMA 2001, 285, 1987; Lancet X2001, 285, 1987; Ann. Intern. Med. 2001, 134, 657.
3. Moher, D., et al.: JAMA 2001, 285, 1992.
4. www.consort-statement.org