Zusammenfassung: Ezetimib (Ezetrol) ist ein neuer, effektiver Cholesterin-Resorptionshemmer, über dessen Wirkungen auf Arteriosklerose-bedingte Mortalität und Morbidität noch keine Daten vorliegen. Sein Einsatz ist unseres Erachtens zur Zeit nur dann gerechtfertigt, wenn Statine und die anderen gut bekannten Alternativen, wie Fibrate, Austauschharze oder Nikotinsäure-Derivate, und nicht zuletzt ein konsequenter Wechsel des Lebensstils nicht zum Erfolg führen. Wegen der geringen Erfahrungen mit dem Wirkstoff sollten Patienten nur im Rahmen begleitender wissenschaftlicher Untersuchungen damit behandelt und darüber informiert werden. Auf UAW muß sorgfältig geachtet werden, vor allem auf Erhöhung der Transaminasen, denn noch liegen keine Daten zu Wirkungen auf Progression der Atherosklerose und UAW bei Langzeitbehandlung vor.
HMG-CoA-Reduktase-Hemmer (Statine) zur Cholesterinsenkung sind ein Fortschritt in der präventiven Medizin. Viele große Studien haben gezeigt, daß Statine zur primären und sekundären Prävention bei Patienten mit erhöhtem Arterioskleroserisiko von Nutzen sind (s. AMB 2001, 35, 6a). Welche Therapiestrategie sollte man jedoch verfolgen, wenn die Standarddosierung der Statine nicht ausreicht, um die LDL-Serumkonzentration unter die angestrebten Zielwerte zu drücken, oder eine Unverträglichkeit vorliegt?
Seit Herbst letzten Jahres ist eine Zusammenfassung des National Cholesterol Education Program (NCEP) und Adult Treatment Panel III der USA im Internet abrufbar (1). Sie ist zwar sehr umfangreich, gibt jedoch eine gute Übersicht über Diagnostik und Therapie von Fettstoffwechselstörungen. Aktuelle deutsche Leitlinien von Fachgesellschaften zu diesem Thema sucht man vergeblich. Die im NCEP empfohlenen (sehr strengen) Therapieziele sind in Tab. 1 dargestellt. Studien zeigen, daß nur ca. 60% der Patienten diese Ziele mit der Standarddosis eines Statins erreichen. Bei den übrigen 40% kann eine Eskalation der Therapie erwogen werden. Dazu stehen neben der Verdopplung der Statindosis eine Reihe unterschiedlicher Substanzen zur Verfügung. Tab. 2 zeigt eine Übersicht dieser Medikamente mit dem zu erwartenden Effekt auf die Lipidkonzentrationen.
In den letzten Monaten wird in Kliniken und Praxen intensiv für Ezetimib (Ezetrol) geworben. Es handelt sich dabei um einen neuen Cholesterin-Resorptionshemmer, der seit letztem Herbst in Deutschland, der Schweiz und den USA zur Mono- oder kombinierten Therapie mit Statinen bei primärer und familiärer Hypercholesterinämie zugelassen ist.
Pharmakokinetik und Pharmakodynamik: Ezetimib gehört zur Substanzgruppe der Azetidinone; es ist ein Prodrug und wird nach oraler Applikation zügig resorbiert. Im Dünndarm und in der Leber wird es zu dem pharmakologisch wirksamen Ezetimib-Glukuronid konjugiert, über die Galle ausgeschieden und gelangt in den enterohepatischen Kreislauf. Ezetimib-Glukuronid inhibiert die Resorption von Nahrungscholesterin und endogenem biliärem Cholesterin im Bürstensaum der Dünndarmenterozyten. Der molekulare Wirkmechanismus ist bisher nicht geklärt. Die Aufnahme von Triglyzeriden und fettlöslichen Vitaminen wird nicht gestört. Die maximale Plasmakonzentration wird etwa eine Stunde nach Einnahme erreicht. Die effektive Halbwertszeit schwank individuell zwischen 13 und 21 Stunden. Es wird zu 78% über die Faeces und zu 11% renal eliminiert (3). Eine Dosierung von 10 mg Ezetimib einmal täglich hat sich als optimal herausgestellt. Die Einnahme kann unabhängig von der Nahrungsaufnahme erfolgen.
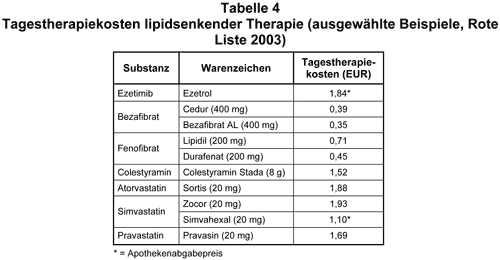
Sudhop et al. haben in einer Studie mit 18 Probanden gezeigt, daß Ezetimib zwar die Aufnahme des Cholesterins beim Menschen bis zu 54% hemmt, jedoch andererseits die hepatische Cholesterinsynthese um 89% steigert (4). Dieser gegenläufige Effekt resultiert in einer LDL-Senkung um 24% bei Monotherapie. Die Kombination mit Cholesterinsynthese-Hemmern (Statinen) scheint theoretisch günstig. Ob jedoch die gesteigerte Cholesterinsynthese langfristig negative Effekte auf kardiovaskuläre Erkrankungen hat, ist gegenwärtig nicht klar. Die Triglyzeride bessern sich, ebenso wie das HDL-Cholesterin, nur leicht. Die Tagestherapiekosten liegen bei 1,84 EUR (s. Tab. 4).
Klinische Studien: Die Ergebnisse der ersten größeren randomisierten, plazebokontrollierten Doppeltblindstudien bei Patienten mit essentieller und familiärer, homozygoter Hypercholesterinämie liegen vor (5-8).
Dujovne et al. (5) veröffentlichten im November 2002 eine multizentrische Studie mit 892 Patienten mit essentieller Hypercholesterinämie (LDL > 130 mg/dl und Triglyzeride < 350 mg/dl). In einer 2-12wöchigen ”Washout-Phase” wurde die bestehende cholesterinsenkende Medikation abgesetzt; danach folgte eine 4-8wöchige Einführungsphase mit Plazebo und die Randomisierung. Anschließend erhielten die Probanden 12 Wochen lang entweder Plazebo oder 10 mg Ezetimib/d.
In der Verum-Gruppe kam es zu einem signifikanten Abfall der LDL-Konzentration um 16,9% und der Triglyzeride um 5,7%; das HDL stieg um 1,3%. UAW traten bei 63% in der Verum- bzw. bei 64% in der Plazebo-Gruppe auf. ”Allergische” Hautreaktionen sind gehäuft in der Ezetimib-Gruppe beobachtet worden. Jedoch sistierten diese Hauterscheinungen trotz Weitergabe der Medikation. Bei 4% bzw. 3% der Teilnehmer in Ezetimib- bzw. Plazebo-Gruppe wurden die Nebenwirkungen als so ernst eingestuft, daß diese Patienten von der Studie ausgeschlossen wurden. Bei zwei Patienten wurde Ezetimib gestoppt, weil die Lebertransaminasen stark angestiegen waren.
Gagné et al. (6) berichten von 769 Probanden mit primärer Hypercholesterinämie, die trotz Standarddosierung von Statinen die Zielwerte des NCEP nicht erreicht hatten und 8 Wochen lang zusätzlich zur unverändert weiterlaufenden Statinmedikation 10 mg Ezetimib/d oder Plazebo erhielten. In der Verum-Gruppe sanken die LDL-Konzentration signifikant um 25,1% und die Triglyzeride um 14,0%; das HDL stieg um 2,7% im Vergleich zur vorausgegangenen Monotherapie mit Statinen. Die erzielten Wirkungen waren vom Statintyp unabhängig. Nach 8 Wochen erreichten 71,5% der Patienten LDL-Konzentrationen, die den Empfehlungen des NECP entsprechen. In der Plazebo-Gruppe besserte sich das Lipidprofil leicht; das LDL verringerte sich um 3,7%, die Triglyzeride um 2,9%, und das HDL nahm um 1,0% zu. Es sei erwähnt, daß bei 20% aller Probanden die Statindosierung im unteren Bereich lag. Bei 5% in der Verum- bzw. bei 2% in der Plazebo-Gruppe kam es nach Einschätzung der Studienbetreuer zu schwerwiegenden UAW. Bei vier Patienten der Verum-Gruppe wurde ein starker Transaminasenanstieg festgestellt, der nach Absetzen der Medikation reversibel war. In der Plazebo-Gruppe traten bei einem Patienten erhöhte Leberwerte und bei einem anderen pathologische CK-Werte auf. Über Ergebnisse aus dem sechswöchigen Beobachtungszeitraum nach Absetzen der Studienmedikation wird leider nicht berichtet. Ein Reboundphänomen von Ezetimib mit Anstieg des LDL durch die induzierte erhöhte endogene Cholesterinsynthese ist denkbar und sollte untersucht werden.
Im Dezember 2002 erschien eine Studie von Davidson et al. (7). 668 Patienten mit primärer Hypercholesterinämie durchliefen eingangs eine 2-12-wöchige „Washout-Phase“ und wurden anschließend vier Wochen lang mit Plazebo behandelt und danach in zehn Gruppen randomisiert. Darauf erhielten sie 12 Wochen lang 10, 20, 40 oder 80 mg Simvastatin/d jeweils als Monotherapeutikum oder in Kombination mit Ezetimib. Eine Gruppe erhielt nur 10 mg Ezetimib/d und eine weitere Plazebo. Die Ergebnisse sind in Tab. 3 dargestellt. Die verschiedenen Simvastatindosierungen wurden in der Studie jeweils in Gruppen zusammengefaßt. Den klinisch relevanten Vergleich der Statin-Hochdosis mit Statin plus Ezetimib muß man jedoch in den Untergruppen betrachten. Erhöht man die Statindosis von 40 mg auf 80 mg, so vermindert man die LDL-Konzentration um ca. 8%. Durch die zusätzliche Gabe von Ezetimib zu Simvastatin 40 mg oder 80 mg verringert sich das LDL zusätzlich um durchschnittlich 15%.
Von den Patienten, die mit Ezetimib plus 20 mg Simvastatin/d behandelt wurden, starb ein Patient nach einem Monat an einem Apoplex, der wohl nicht im Zusammenhang mit der Studienmedikation stand. Vier Patienten, die neben Simvastatin auch Ezetimib einnahmen, mußten die Studie vorzeitig wegen erhöhter Transaminasen abbrechen. In der Simvastatin-Gruppe (20 mg und 40 mg) klagten zwei Patienten, jeweils mit und ohne Ezetimib-Komedikation, über Myopathien.
Ein Studie zur Behandlung der familiären, homozygoten Hypercholesterinämie ist im Mai 2002 in Circulation erschienen (8). Gagné et al. publizierten Ergebnisse von 50 Patienten, die täglich 40 mg Atorvastatin oder Simvastatin erhielten, und von denen die Hälfte zusätzlich mit LDL-Apherese behandelt wurden. Nach Randomisierung in drei Gruppen wurde 12 Wochen lang entweder die Statindosis auf 80 mg/d verdoppelt oder zusätzlich 10 mg Ezetimib gegeben oder beides. Die Verdopplung der Statindosis führte zu einer Verminderung der LDL um 6,7%, die zusätzliche Gabe von Ezetimib zu Statin 40 mg/d senkte das LDL um 14%. Die Erhöhung der Statindosis auf 80 mg plus Gabe von Ezetimib führten zu einer 27,5%igen Reduktion der LDL-Konzentration. Der LDL-Unterschied zwischen Verdopplung der Statindosis und Gabe von Ezetimib zu Statin 40 mg war nicht signifikant, wohl aber im Vergleich dazu die Gabe von 80 mg Simvastatin/d plus Ezetimib. Zwei von 33 Patienten (6%) aus der Gruppe, die mit Ezetimib plus Statin behandelt wurden, mußten die Studie wegen starker Erhöhung der Transaminasen abbrechen.
Schering-Plough, der Hersteller von Ezetimib, sponserte alle Studien, und Mitarbeiter der Firma arbeiteten auch als Koautoren an den Publikationen mit. Die Originalartikel im JACC und im American Journal of Cardiology sind von Editorials begleitet, in denen zu Ezetimib kritisch Stellung genommen wird (9, 10).
Für zwei klinische Szenarien kommt Ezetimib in Frage, nämlich wenn Statine nicht vertragen werden oder Statine in Standarddosierung das Cholesterin nicht ausreichend senken. Aber auch dann gibt es mehrere Alternativen zu Ezetimib in Form von Fibraten, bei denen auf eine mögliche Myopathie als UAW geachtet werden muß. Austauschharze und Nikotinsäure-Derivate sind ebenfalls Alternativen, werden aber wegen ihrer UAW von den Patienten gelegentlich abgelehnt.
Laut Herstellerfirma sind bereits mehrere Studien mit einigen tausend Probanden, teils mit kardialen Endpunkten und über einen langen Behandlungszeitraum, geplant bzw. schon initiiert. Solange diese Ergebnisse nicht vorliegen, sollte aus folgenden Gründen Vorsicht bei der Verschreibung von Ezetimib gelten:
· In den Studien fallen Transaminasenerhöhungen unter Ezetimib auf; deshalb müssen die Leberwerte regelmäßig kontrolliert werden. Keine dieser Studien dauerte länger als 12 Wochen, und die Gesamtzahl der Probanden ist klein. Somit sind klinischer Nutzen und Häufigkeit von UAW bei Langzeitbehandlung bisher unklar.
· Der molekulare Wirkmechanismus von Ezetimib ist noch nicht aufgeklärt und die Bedeutung der gesteigerten Cholesterinsynthese für die Atherogenese unklar.
· In den Studien waren Angina pectoris, Myokardinfarkt oder eine Intervention an den Koronarien in den drei bis sechs Monaten zuvor ein Ausschlußkriterium. Gerade bei diesen Patienten wird in der Praxis aber häufig eine cholesterinsenkende Therapie eingeleitet. Es ist nicht geklärt, ob diese speziellen Patienten von der Therapie mit Ezetimib profitieren.
Literatur
- Executive summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III): http://www.nhlbi.nih.gov/guidelines/cholesterol/
- http://ekc130.unimuenster.de/taskforce/framingham.asp?iSprache=2&iVersion=1&iSiVersion=0
- Sudhop, T., und von Bergmann, K.: Drugs 2002, 62, 2333.
- Sudhop, T., et al.: Circulation 2002, 106, 1943.
- Dujovne, C.A., et al.: Am. J. Cardiol. 2002, 90, 1092.
- Gagné, C., et al.: Am. J. Cardiol. 2002, 90, 1084.
- Davidson, M.H., et al.: J. Am. Coll. Cardiol. 2002, 40, 2125.
- Gagné, C., et al.: Circulation 2002, 105, 2469.
- Sacks, F.M.: J. Am. Coll. Cardiol. 2002, 40, 2135.
- Grundy, S.M.: Am. J. Cardiol. 2002, 90, 1135.