Zusammenfassung: Die mitClostridium difficile (C. diff.) assoziierten Erkrankungen (CDAD) haben in den letzten Jahrzehnten deutlich zugenommen. Sie erklären –als einer der wenigen fassbaren Faktoren –die Zunahme der Letalität in den Krankenhäusern der Industrieländer. Die hohe Letalität der CDAD betrifft besonders ältere Menschen. Dem Robert Koch-Institut wurden im Jahr 2016 insgesamt 2.337 schwere Erkrankungen in Deutschland gemeldet. Vorsichtige Schätzungen gehen von 500.000 CDAD pro Jahr in den USA aus. Hauptursache ist die Verordnung von Antibiotika. Daher sollten strenge Indikationen für Antibiotika beachtet und unnötige antibiotische Prophylaxen vermieden werden. Wichtigste Wirkstoffe zur Behandlung schwer verlaufender CDAD sind nach wie vor Vancomycin und Metronidazol. Möglicherweise können künftig Erkrankungen bei Risikopatienten durch Immunisierung vermieden werden.
Allgemeines:Die CDAD betrifft in der Regel den Dickdarm, dessen Schleimhaut durch Toxine des Erregers geschädigt wird. C. diff.ist auch in der Darmflora (Mikrobiom) gesunder Erwachsener in geringer Menge vorhanden, kann aber durch Anwesenheit von Antibiotika einen Wachstumsvorteil erlangen und sich stärker ausbreiten. Außerdem wird durch Antibiotika die Toxinproduktion von C. diff.induziert. Der Nachweis von Toxin A und/oder B im Stuhl ist daher auch der diagnostische Goldstandard bei Patienten mit entsprechenden Symptomen und Risikofaktoren. Das führende klinische Symptom der CDAD ist Diarrhö. Bei schwer Erkrankten können sich auf der Dickdarmschleimhaut sog. Pseudomembranen ausbilden (Pseudomembranöse Kolitis). Sie sind ein leicht erkennbarer und unverwechselbarer endoskopischer Befund. Es kann allerdings im Verlauf der Erkrankung auch zu einem toxischen Megakolon kommen, bei dem die Diarrhö nicht mehr im Vordergrund steht, sondern ein akutes Abdomen, manchmal sogar mit Perforation. Bei Patienten, bei denen während eines stationären Krankenhausaufenthalts Diarrhö auftritt, sollte immer an eine CDAD gedacht werden (Übersicht bei 1; vgl. Tab. 1).
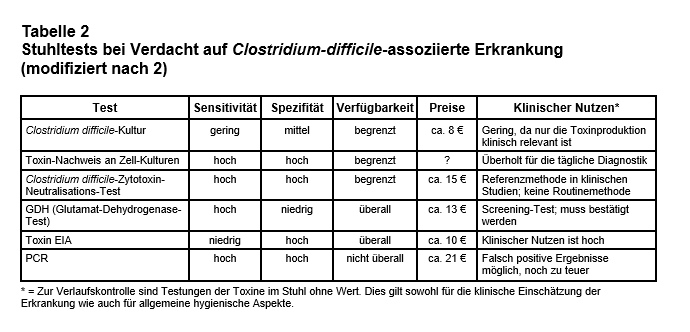
Diagnostik:Das Wichtigste sind der klinische Untersuchungsbefund und die Anamnese. Entwickelt ein Patient die oben beschriebenen Symptome während oder nach einer antibiotischen Therapie im Krankenhaus oder ambulant, steht bei der Differenzialdiagnose die CDAD weit oben. Dabei kann die antibiotische Therapie schon Monate zurückliegen oder sogar nur als Einzeldosis („single shot“) erfolgt sein. Etwas weniger als die Hälfte der gastrointestinalen Nebenwirkungen (NW) von Antibiotika ist eine CDAD (45). Finden sich bei der Kolonoskopie Pseudomembranen, ist die Diagnose sicher. Bei schwer Erkrankten mit klinischem Verdacht auf eine CDAD sollte die Therapie sofort beginnen, auch wenn die Stuhldiagnostik noch auf dem Weg ist. Aus einer möglichst frischen, breiig-flüssigen Stuhlprobe, welche rasch transportiert und bis zur Testung von C. diff.bzw. seinen Toxinen bei einer Temperatur zwischen +2 bis +8°C gelagert werden sollte, können die in Tab. 2 zusammengefassten Tests durchgeführt werden. Von größtem diagnostischem Nutzen ist hierbei der Nachweis der Toxine A und B. Wegen der nicht sehr hohen Sensitivität kann bei fraglicher Diagnose als schneller und kostengünstiger Suchtest der Nachweis der Glutamat-Dehydrogenase (GDH) eingesetzt werden. Dies ist aber bei schwer Erkrankten eher die Ausnahme. Ein positiver Test ohne Symptome ist klinisch nicht relevant. Keiner der Tests ist zur Verlaufskontrolle geeignet, und auch hygienische Maßnahmen (s.u.) sollten sich nicht am Testergebnis, sondern nur an der klinischen Symptomatik orientieren.
Epidemiologie und Risikofaktoren:Die CDAD zählt zu den wenigen identifizierbaren Ursachen, die in den letzten Jahren zu einem Anstieg der Morbidität und Letalität in Krankenhäusern geführt haben (3-7). Man geht in den USA von 500.000 Erkrankten pro Jahr aus, von denen 29.000 an den Folgen sterben (8). Die Letalität infolge CDAD ist zwischen 2000 und 2007 um 400% gestiegen (4). Sie betrifft vor allem Patienten > 80 Jahre (9). In München und Nürnberg war in den Jahren 2013-2016 etwa jeder 100. Todesfall mit CDAD assoziiert (45). Die in Deutschland entstehenden Kosten werden auf jährlich 464 Mio. € geschätzt (46), in den USA auf 436 Mio. bis 6 Mrd. US$ (10).
Nach wie vor ist der Einsatz von Antibiotika der größte Risikofaktor für eine schwer verlaufende CDAD (11). Studien zeigen, dass bei ca. 20-30% der Antibiotika-Therapien in Krankenhäusern keine Indikation besteht, d.h. die Therapie ist nicht nur überflüssig, sondern sogar gefährlich (12-16). Die Gründe für diesen Missstand sind vielfältig; ungenügende Ausbildung, Unsicherheit und ungerechtfertigtes Sicherheitsgefühl bei der Verschreibung von Antibiotika gehören dazu. Oft wird verdrängt, dass Antibiotika zum Teil erhebliche NW verursachen können. Ca. 30% der NW, die innerhalb von 90 Tagen nach Gabe von Antibiotika auftreten, sind CDAD (16, 17). Zu beachten ist, dass alle Antibiotika diese NW verursachen können, wobei es Hinweise gibt, dass die Assoziation mit oralen Cephalosporinen und Clindamycin besonders stark und die mit Co-trimoxazol und Doxycyclin geringer ist. Die Wahl des Antibiotikums ist zwar immer vom Erreger der Infektion abhängig, aber angesichts der Häufigkeit und Bedeutung dieser NW kann die Meinung vertreten werden, dass es für orale Cephalosporine bei Erwachsenen kaum eine klare Indikation gibt. Andere bekannte und von uns schon früher referierte Risikofaktoren für die CDAD sind: parenterale Ernährung, Einnahme von Protonenpumpenhemmern und Schweregrad der zu Grunde liegenden Erkrankung (18). Im Gegensatz zu Nordamerika fand sich in Europa keine so eindeutige Korrelation des Schweregrads der Erkrankung mit den PCR-Ribotypen 027 von C. diff.(19, 20).
Neben Antibiotika sind auch interne Faktoren (Wirtsfaktoren) an der Entstehung und dem Schweregrad der CDAD beteiligt. Bilden Patienten im Rahmen einer CDAD vermehrt Antikörper gegen C. diff.-Toxine, sind Rezidive seltener (21-23). Aus diesem Befund leiten sich zwei neue therapeutische Strategien ab: aktive Immunisierung sowie Injektion von Antikörpern gegen diese Toxine (34; s.u.). Neben den häufigeren Komorbiditäten wird auch die Alterung des Immunsystems ( Immunoseneszenz) als Ursache für die schweren Verläufe bei alten Patienten angenommen.
Therapie:Wir haben mehrfach über die verschiedenen Therapieoptionen berichtet (24-29). Die Therapie orientiert sich vorwiegend an den Symptomen und Risikofaktoren.
Metronidazol und Vancomycin (vgl. 24, 25):Die initiale Überlegung bei einer Antibiotika-induzierten CDAD muss immer sein, ob das Antibiotikum abgesetzt werden kann und ob dies als therapeutische Maßnahme bereits genügt. Bei multimorbiden älteren Patienten reicht dies allein oft nicht aus. Zudem gibt es Patienten, die durch die CDAD stark gefährdet sind: z.B. Patienten > 65-70 Jahre, mit Colitis ulcerosa, Immundefizienz, nach gastrointestinalen Operationen, Hypalbuminämie, Malnutrition, Einnahme von Protonenpumpenhemmern und solche mit mehreren Begleiterkrankungen. Diese Risikopatienten bedürfen bei klinischem Verdacht neben supportiven Maßnahmen (Substitution von Flüssigkeit und Elektrolyten) rasch einer spezifischen Therapie, d.h. noch bevor die Ergebnisse der Stuhldiagnostik vorliegen, wobei Wirkstoffe kontraindiziert sind, die die Darmmotilität hemmen (z.B. Loperamid). Bei diesen Patienten kann sich der Zustand sehr schnell verschlechtern. Nach wie vor sind Metronidazol und Vancomycin in dieser Situation der Gold-Standard. Die Wahl zwischen beiden Wirkstoffen hängt wesentlich von der klinischen Einschätzung ab. Ist der Verlauf der CDAD nicht rapide und die Symptomatik (noch) nicht schwer (s. Tab. 1), kann Metronidazol in der Dosierung von zwei- bis dreimal 500 mg/d per os für 10-14 Tage eingesetzt werden. Metronidazol ist auch i.v. wirksam.
Metronidazol per os hat gegenüber Vancomycin jedoch einen pharmakodynamischen Nachteil, denn es muss zunächst resorbiert und dann zum Wirksamwerden im Darm sezerniert werden. Diese Verzögerung besteht bei der oralen Vancomycin-Therapie nicht. Daher werden Patienten mit schwerer und komplizierter CDAD mit Vancomycin per os in der Dosierung viermal 125 mg/d über 10-14 Tage behandelt (30). Für eine bessere Wirksamkeit höherer Dosierungen fand sich keine Evidenz aus Studien. Vancomycin wirkt direkt im Darm und wird nicht resorbiert, was den Vorteil hat, dass es nicht zu systemischen Wirkungen und NW kommt. Für die orale Anwendung können die für die i.v. Therapie zugelassenen Trockensubstanzen kostengünstig eingesetzt werden. Für eine bessere Wirksamkeit der Kombination von Metronidazol plus Vancomycin gibt es keine gesicherte Evidenz. Trotzdem wird bei schwerkranken Patienten häufig Metronidazol i.v. und Vancomycin oral gegeben. Bei schwerkranken Patienten, die nicht schlucken können, kann Vancomycin antegrad über Duodenalsonde oder retrograd als Einlauf verabreicht werden. Primär sprechen 75-95% der Patienten auf Metronidazol oder Vancomycin an. Bisher gibt es keine Studien bei Patienten mit schwerer oder komplizierter CDAD, in denen Metronidazol, Vancomycin und Fidaxomicin direkt verglichen werden. Es gibt nur indirekte Vergleiche (31). Bei Peritonitis und Darmperforation kann die Kolektomie lebensrettend sein, wenn sie nicht zu spät, z.B. im septischen Schock, erfolgt (32). Dieser chirurgische Eingriff wird derzeit als ultima ratio eingestuft; die Letalität ist mit 41% sehr hoch (32).
Fidaxomicin:Wir haben mehrfach über Fidaxomicin berichtet (vgl. 25). Theoretisch hat der Wirkstoff den Vorteil, dass er möglicherweise das Mikrobiom des Patienten weniger schädigt als andere nichtresorbierbare Antibiotika (33), denn Rezidive waren nach Fidaxomicin seltener (25). Die sehr hohen Kosten von Fidaxomicin im Vergleich zu Vancomycin oder Metronidazol sind allerdings ein Grund, warum es sehr selten eingesetzt wird, in der Regel nur als Reservemedikament bei Patienten mit mehr als einem Rezidiv oder speziellen klinischen Problemen.
Monoklonale Antikörper gegen C. diff.-Toxine:Wir haben vor kurzem über Bezlotozumab berichtet (34). Dieser humanisierte monoklonale Antikörper gegen C. diff.-Toxin B zeigte in ersten klinischen Studien einen Vorteil hinsichtlich der Häufigkeit von Rezidiven, nicht jedoch hinsichtlich des initialen Ansprechens. Der Antikörper wurde daher zur Behandlung von Rezidiven in Kombination mit einem wirksamen Antibiotikum für Erwachsene zugelassen. Das Ziel einer Behandlung mit Antikörpern ist jedoch, dass diese als Monotherapie ausreichen und somit die Mikrobiota des Patienten nicht geschädigt werden. Dieser Weg ist langfristig – neben der (präventiven) Impfung – wahrscheinlich die beste Option, die CDAD und Rezidive zu vermeiden. Warum Actoxumab, ein Antikörper gegen Toxin A, in dieser Studie (34) nicht wirksam war, ist noch nicht geklärt.
Impfungen:Impfstoffe befinden sich zurzeit in klinischen Phase-II/III-Studien. In einer Phase-III-Studie wird die Induktion von Antikörpern gegen Toxin A und B untersucht. Mit ersten Ergebnissen ist Ende 2017 zu rechnen. In diese Studie gehen zwei große Patientenkohorten ein: Eine wurde mindestens zweimal im Jahr stationär systemisch mit Antibiotika behandelt, die andere wurde nach der Impfung zu einer geplanten größeren Operation ins Krankenhaus aufgenommen (35). Die EU fördert zurzeit eine Studie zur Entwicklung eines sublingualen Impfstoffs gegen C. diff.(36). Hierzu werden nichtpathogene Sporen von C. diff.verwendet, die auf ihrer Oberfläche die entsprechenden Antigene zur Induktion einer Immunantwort tragen.
Stuhltransplantation:Über diese etwas ungewöhnliche Behandlung haben wir wiederholt berichtet (28). In einigen Fallserien wurden günstige Ergebnisse bestätigt. Inzwischen wurde ein Modell entwickelt, das eine gute Vorhersage erlaubt, welche Patienten von einer Stuhltransplantation (fäkaler Mikrobiomtransfer) profitieren. Leider sind es die schwerkranken und komplizierten Patienten, die auf diese Behandlung schlecht ansprechen (37). Auch sind die Stuhltransplantate noch schlecht charakterisiert, und das Wissen über die wirksamen Bestandteile ist gering. Es hat sich gezeigt, dass mit den Stuhlpräparationen mancher Spender bessere Resultate zu erzielen sind als mit anderen. Vielleicht könnten auch durch zwischengeschaltete Kulturen oder aus den Überständen der bakteriellen Kulturen Faktoren ermittelt werden, die den positiven Effekt bewirken. Um einen besseren Überblick über die Patienten zu behalten, die sich einer Stuhltransplantation unterzogen haben, wurden in den USA vom NIH Mittel für die Einrichtung eines nationalen Registers zur Verfügung gestellt (38).
Probiotika:Die Ergebnisse der Behandlung und Prophylaxe der CDAD mit Probiotika (Lakto-/Bifidobakterien) sind bisher wenig überzeugend (39; vgl. 29). Obwohl eine Cochrane- Analyse von 23 qualitativ mäßigen Studien zum Schluss kam, dass Probiotika in dieser Indikation effektiv und sicher sind (40), hat die amerikanische Gesellschaft für Infektionserkrankungen Probiotika nicht in ihre Empfehlungen aufgenommen: Es fehlten gute Studien und es bestünde die Gefahr von Blutinfektionen mit Probiotika bei schwerkranken Patienten. Wir sehen zurzeit keine Indikation für Probiotika in der Prophylaxe oder in der Therapie der CDAD.
Therapie bei Rezidiven:CDAD-Rezidive ereignen sich bei 15-35% der Patienten. Die häufigste Ursache ist eine erneute Behandlung mit einem Antibiotikum, nicht selten ohne klare Indikation. Das erste Rezidiv kann wie die primäre Erkrankung behandelt werden. Resistenzen von C. diff.gegen Vancomycin und Metronidazol sind nicht bekannt. Beim zweiten und bei weiteren Rezidiven ist eine ausschleichende Vancomycin-Therapie indiziert. Leider gibt es hierfür keine gute Evidenz aus klinischen Studien. Folgendes Vorgehen kann ab dem zweiten Rezidiv empfohlen werden: viermal 125-500 mg/d für 14 Tage, danach zweimal 125-500 mg/d für 7 Tage, danach einmal 125-500 mg für 7 Tage, danach 125-500 mg jeden 2. Tag für 7 Tage und abschließend 125-500 mg jeden 3. Tag für 2-8 Wochen, also eine minimale Therapiedauer von 7 Wochen. Die Idee hinter diesem Schema ist die Tatsache, dass Vancomycin die Sporen von C. diff.nicht bekämpft. Durch die intermittierende Gabe könnte es den Sporen ermöglicht werden, sich in vegetative Formen umzuwandeln, die dann von dem Antibiotikum eliminiert werden.
Bei Patienten mit Rezidiv(en) sind auch die (teuren) Wirkstoffe Fidaxomicin (Dificlir®; per os zweimal 200 mg/d für 10 Tage; vgl. 25; 41) oder Bezlotoxumab (Zinplava®; i.v. einmal 10 mg/kg über eine Stunde; vgl. 34) plus Vancomycin zu erwägen.
Verhinderung der CDAD:Vermeiden von Antibiotikaprophylaxen:Bei Patienten, die sich operativen Eingriffen unterziehen, reicht häufig eine einzige prä- oder perioperative Gabe eines Antibiotikums aus, eine CDAD auszulösen. In USA wird die Zahl solcher Antibiotika-Gaben vorsichtig auf 25 Mio./Jahr geschätzt (42). Bei vielen Eingriffen besteht keine sichere wissenschaftliche Grundlage für dieses Vorgehen. Hier sind dringend Studien nötig, um bestimmte Patientengruppen und Eingriffe besser zu charakterisieren, die von einer solchen Prophylaxe profitieren.
Hygienische Aspekte:Wenn möglich, sollten die Patienten mit CDAD einzeln oder in Kohorten isoliert werden. Bei Pflege und Behandlung sollten Handschuhe und Schutzkittel getragen werden. Stethoskope und anderes Untersuchungsgerät sollte nach dem Gebrauch bei solchen Patienten desinfiziert werden. Die Hände- und Flächendesinfektion sollte mit sporoziden Mitteln erfolgen (43). Allerdings haben systematische Untersuchungen gezeigt, dass die Übertragung von Toxin-bildenden C. diff. im Krankenhaus gering war, wenn die Erkrankten nicht inkontinent waren und eigene Toiletten benutzten (44).
Literatur
-
Schneider, T., et al.: Dtsch. Arztebl. 2007, 104, A-1588. Link zur Quelle
-
Surawicz, C.M., et al.: Am. J. Gastroenterology 2013, 108, 478. Link zur Quelle
-
Redelings, M.D., et al.: Emerg. Infect. Dis. 2007, 13, 1417. Link zur Quelle
-
Hall, A.J., et al.: Clin. Infect. Dis. 2012, 55, 216. Link zur Quelle
-
Hensgens, M.P., et al.: Clin. Infect. Dis. 2013, 56, 1108. Link zur Quelle
-
Gao, T., et al.: Am. J. Infect. Control. 2015, 43, 1316. Link zur Quelle
-
Barbut, F., et al.: J. Hosp. Infect. 2017 Jul [Epub ahead of print]. Link zur Quelle
-
Lessa, F.C., et al.: N. Engl. J. Med. 2015, 372, 825. Link zur Quelle
-
Zilberberg, M.D., et al.: Emerg. Infect. Dis. 2008, 14, 929. Link zur Quelle
-
Nguyen, G.C., et al.: Am. J. Gastroenterol. 2008, 103, 1443. Link zur Quelle
-
Deshpande, A., et al.: Infect. Control Hosp. Epidemiol. 2015, 36, 452. Link zur Quelle
-
Hecker, M.T., et al.: Arch. Intern. Med. 2003, 163, 972. Link zur Quelle
-
Camins, B.C., et al.: Infect. Control Hosp. Epidemiol. 2009, 30, 931. Link zur Quelle
-
Ingram, P.R., et al.: Intern. Med. J. 2012, 42, 719. Link zur Quelle
-
Cosgrove, S.E., et al.: Infect. Control Hosp. Epidemiol. 2012, 33, 374. Link zur Quelle
-
Tamma, P.D., et al.: Clin. Infect. Dis. 2017, 64, 537. Link zur Quelle
-
Tamma, P.D., et al.: JAMA Intern. Med. 2017, 177, 1308. Link zur Quelle
-
AMB 2008, 42, 49. Link zur Quelle
-
Warny, M., et al.: Lancet 2005, 366, 1079. Link zur Quelle
-
Walker, A.S., et al. (IORD = Infections in Oxfordshire Research Database): Clin. Infect. Dis. 2013, 56, 1589. Link zur Quelle
-
Owens, R.C., et al.: Clin. Infect. Dis. 2008, 46 Suppl. 1, S19. Link zur Quelle
-
Kyne, L., et al.: Lancet 2001, 357, 189 Link zur Quelle . Vgl. AMB 2010, 44, 12. Link zur Quelle
-
Leav, B.A., et al.: Vaccine 2010, 28, 965. Link zur Quelle
-
AMB 2006, 40, 68a. Link zur Quelle
-
AMB 2013, 47, 70 Link zur Quelle . AMB 2013, 47, 63b Link zur Quelle . AMB 2011, 45, 30a. Link zur Quelle
-
AMB 2010, 44, 12a. Link zur Quelle
-
AMB 2007, 41, 63a. Link zur Quelle
-
AMB 2016, 50, 23 Link zur Quelle . AMB 2013, 47, 14. Link zur Quelle
-
AMB 2013, 47, 69b. Link zur Quelle
-
Zar, F.A., et al.: Clin. Infect. Dis. 2007, 45, 302. Link zur Quelle
-
Nelson, R.L., et al.: Cochrane Database Syst. Rev. 2017 Mar 3;3:CD004610. Link zur Quelle
-
Bhangu, A., et al.: Br. J. Surg. 2012, 99, 1501. Link zur Quelle
-
Louie, T.J., et al.: Antimicrob. Agents Chemother. 2009, 53, 261. Link zur Quelle
-
Wilcox, M.H., et al. (MODIFY I und II): N. Engl. J. Med. 2017, 376, 305 Link zur Quelle. AMB 2017, 51, 13. Link zur Quelle
-
Foglia, G., et al.: Vaccine 2012, 30, 4307. Link zur Quelle
-
Goldberg, E.J., et al.: Am. J. Health Syst. Pharm. 2015, 72, 1007. Link zur Quelle
-
Fischer, M., et al.: Am. J. Gastroenterol. 2016, 111, 1024. Link zur Quelle
-
AGA receives NIH funding for first national FMT registry (2017). Link zur Quelle
-
Allen, S.J., et al. (PLACIDE = Probiotic Lactobacilli and bifidobacteria in Antibiotic-associated diarrhoea and Clostridium dIfficile Diarrhoea in the Elderly): Lancet 2013, 382, 1249. Link zur Quelle
-
Goldenberg, J.Z., et al.: Cochrane Database Syst. Rev. 2013, CD006095. Link zur Quelle
-
https://www.akdae.de/Arzneimitteltherapie/NA/Archiv/201304-Dificlir.pdf Link zur Quelle
-
Napolitano, L.M., und Edmiston, C.E.: Surgery 2017, 62, 325. Link zur Quelle
-
http://www.rki.de/DE/ Content/Infekt/Krankenhaushygiene/ Erreger_ausgewaehlt/Clostridium/ Clostridium_pdf_02.pdf?__blob=publicationFile Link zur Quelle
- Widmer, A.F., et al.: Clin. Infect. Dis. 2017, 64, 393. Link zur Quelle
- Gleich, S., et al.: Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2017 Aug 29. doi: 10.1007/s00103-017-2605-y. [Epub ahead of print]. Link zur Quelle
- Grube, R.F., et al.: Z. Gastroenterol. 2015, 53, 391. Link zur Quelle