Eptacog alfa (NovoSevenÒ) ist ein rekombinantes aktiviertes Faktor-VII-Präparat (rFVIIa). Es ist in Deutschland unter anderem zugelassen für die Behandlung von Blutungen im Zusammenhang mit chirurgischen oder invasiven Eingriffen bei Patienten mit angeborener Hämophilie mit Hemmkörpern gegen die Blutgerinnungsfaktoren VIII oder IX, starkem Anstieg des Hemmkörpers, angeborenem Faktor-VII-Mangel und bei Patienten mit Thrombasthenie Glanzmann, die früher oder aktuell auf Transfusionen von Thrombozytenkonzentraten refraktär waren. In den USA erfolgte die Zulassung 1999 für ein vergleichbares Indikationsspektrum. Eptacog alfa wird seitdem jedoch zunehmend außerhalb der geltenden Anwendungsgebiete zur Kontrolle schwerwiegender Blutungen unterschiedlicher Genese eingesetzt (1). Berichten über therapeutische Erfolge stehen begrenzte Daten zur Sicherheit des Wirkstoffs, ein mögliches therapieassoziiertes Thromboserisiko sowie erhebliche Kosten bei nur kurzer Halbwertszeit von Eptacog alfa gegenüber. So übersteigen z.B. die für Eptacog alfa anfallenden Kosten in zahlreichen US-amerikanischen Krankenhäusern 500000 $ pro Jahr, meist wegen Off-Label-Verwendung (2).
Im Auftrag der Society for the Advancement of Blood Management (SABM) und des University HealthSystem Consortium (UHC) erarbeitete deshalb eine Gruppe nordamerikanischer Experten Empfehlungen zum Off-Label-Einsatz von Eptacog alfa, um eine rationale Entscheidung für oder gegen den Einsatz zu ermöglichen (3). An dem Gremium waren Anästhesisten, Intensivmediziner, Transfusionsmediziner, Chirurgen, Neurologen und Pharmazeuten beteiligt. Alle Mitglieder hatten relevante Interessenkonflikte verneint. Erschwert wurde die Arbeit des multidisziplinären Gremiums durch die Tatsache, dass nach gründlichen Literaturrecherchen zwar zahlreiche Kasuistiken und Fallserien, jedoch lediglich vier prospektive randomisierte Studien zum Einsatz von Eptacog alfa veröffentlicht worden waren (3). Bei dieser unbefriedigenden Datenlage entschlossen sich die Experten zu folgendem Vorgehen: Nach entsprechenden Literaturrecherchen zur Wirksamkeit und Sicherheit von Eptacog alfa wurde eine Liste klinischer Szenarien erarbeitet, in denen ein therapeutischer Nutzen des Präparates vorstellbar wäre.
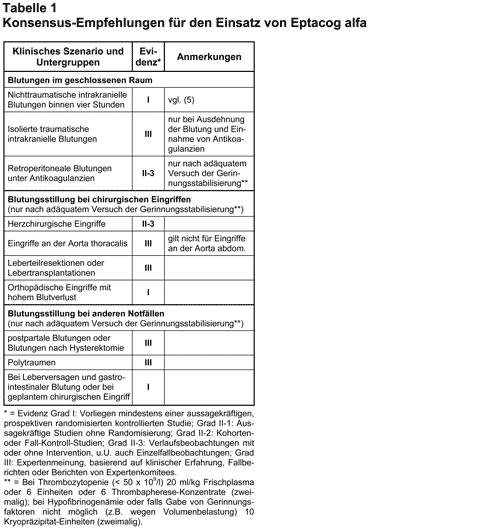
Die Auswahl der klinischen Szenarien (s. Tab. 1) basierte, wie die Autoren betonten, auf ihrer eigenen klinischen Erfahrung. Anlass für die Berücksichtigung einer speziellen Situation war die Notwendigkeit, Frischplasma, Thrombozytenkonzentrate oder Kryopräzipitate zu verabreichen. Eine Empfehlung für die Gabe von Eptacog alfa wurde ausgesprochen, wenn „die erwarteten gesundheitlichen Vorteile der Therapie die erwarteten negativen gesundheitlichen Konsequenzen in einem Umfang übertreffen, welcher die Verordnung des Arzneimittels in einem Umfeld limitierter finanzieller Ressourcen rechtfertigt” (3). Zum Einsatz von Eptacog alfa bei Kindern wurde nicht Stellung bezogen.
Unter letztlich 32 klinischen Szenarien mit möglichem Einsatz von Eptacog alfa wurde dessen Verwendung in 11 Fällen als “geeignet”, in 14 Fällen als “nicht geeignet” und in 7 Fällen als “unsicher” eingestuft. Die Empfehlungen sind in Tab. 1 zusammengefasst. Keine oder nur eine unsichere Indikation für Eptacog alfa sahen die Experten z.B. bei einer aktiven gastrointestinalen Blutung per se oder bei Thrombozytopenie mit einer schweren und konventioneller Therapie gegenüber refraktären Blutung. Auch ein prophylaktischer Einsatz vor operativen Eingriffen wurde nicht empfohlen.
Als Dosierung empfahl das Gremium 20-40 µg/kg zur Antagonisierung der Wirkung von Antikoagulanzien (Fondaparinux = Arixtra®, Faktor-Xa-Inhibitoren) sowie 41-90 µg/kg bei allen anderen Off-Label-Verwendungen. Dosierungen über 90 µg/kg wurden nicht empfohlen. Die Empfehlungen bewegen sich somit am unteren Rand der in der Fachinformation zu Eptacog alfa genannten Dosierung und deutlich unter kürzlich publizierten Empfehlungen zum Off-Label-Einsatz (4).
Generell sollten, wie auch bei anderen Off-Label eingesetzten Arzneimitteln, alle Patienten unter Therapie mit Eptacog alfa genau dokumentiert werden. Die Daten zur Wirksamkeit und Sicherheit von Eptacog alfa sollten möglichst zu einem Register zusammengefasst und biometrisch ausgewertet werden. So könnten prospektiv Informationen gesammelt werden, die in ihrem Wert zwar hinter dem von randomisierten Studien zurückbleiben, aber wertvoller sind als der Konsensus von „erfahrenen” Klinikern. So hat zum Beispiel erst ein Therapieregister auf das außergewöhnliche Risikoprofil von Aprotinin (Trasylol®) hingewiesen (6).
Fazit: Der Gerinnungsfaktor Eptacog alfa wird zunehmend jenseits der zugelassenen Indikationen und teilweise in nicht adäquater Dosierung eingesetzt. Dies ist immer mit erheblichen Kosten verbunden. Die Empfehlungen eines multidisziplinär besetzten nordamerikanischen Expertengremiums sind eine wichtige Hilfe für den sinnvollen therapeutischen Einsatz dieses Gerinnungsfaktors. Selbstverständlich müssen diese Konsensus-Empfehlungen rasch aktualisiert werden, wenn weitere, dringend benötigte randomisierte klinische Studien zum Einsatz von Eptacog alfa vorliegen.
Literatur
- O’Connell, N.M.: Transfusion 2003, 43, 1711.
- MacLaren, R.: Transfusion 2005, 45, 1434.
- Shander, A.: P&T 2005, 30, 644.
- Martinowitz, U.: J. Thromb. Haemost. 2005, 3, 640.
- AMB 2005, 39, 42.
- AMB 2006, 40, 20.