Zusammenfassung: Eine ”Eradikation“ von Helicobacter pylori nach einem erprobten Dreifachschema gilt zur Zeit als Standardtherapie der Ulkuskrankheit, wenn eine Infektion des Magens und/oder des Duodenums mit diesem Bakterium nachgewiesen ist. Gelingt seine Ausmerzung nicht, muß neben einer primären Resistenz auch an mangelnde Compliance des Patienten gedacht werden. Eine zweite Behandlung sollte durch vorherige bakterielle Kultur mit Antibiogramm abgesichert sein. Pragmatisch kann eine wismuthaltige Vierfachkombination versucht werden. Gelingt auch damit die Eradikation nicht, bleibt als Ultima Ratio die Dauertherapie mit einem Protonenpumpeninhibitor. Kommt es nach Jahren zu einem Rezidiv des Ulkus und der Infektion, ist von einer Neuinfektion auszugehen. In diesem Fall kann nach dem ursprünglichen Schema behandelt werden.
Ein gestörtes Gleichgewicht zwischen defensiven und aggressiven Faktoren in der Mukosa soll die Ursache von Ulcus ventriculi und duodeni sein. Allgemein wird akzeptiert, daß eine chronische Infektion mit Helicobacter pylori (HP) wesentlich an der Ulkusentstehung im Magen (bei ca. 70-80% der Patienten) und Duodenum (bei ca. 80-90% der Patienten) beteiligt ist. Daneben wird die HP-Infektion auch für andere Erkrankungen (z.B. Gastritis, Dyspepsie, Magenkarzinom, MALT-Lymphom) mitverantwortlich gemacht. Die als ”Eradikation“ bezeichnete Eliminierung von HP wird von verschiedenen Fachverbänden als Standardtherapie bei den in Tab. 1 aufgeführten Erkrankungen angesehen (1).
Zur Eradikation von HP hat sich eine Dreifachtherapie (sogenannte Tripeltherapie) etabliert, die aus einem Protonenpumpeninhibitor (PPI), kombiniert mit Clarithromycin plus Amoxicillin (nicht Ampicillin) oder Metronidazol (bzw. Tinidazol) besteht (Tab. 2; s.a. AMB 1993, 27, 28; 1994, 28, 59; 1995, 29, 67 und 1996, 30, 13). Für diese Therapieform spricht die gute Wirksamkeit, die kurze Therapiedauer und die meist tolerablen Nebenwirkungen, die nur selten zum Therapieabbruch führen. Bei konsequenter Durchführung dieser Therapie wurden in klinischen Studien Eradikationsraten von über 90% erreicht (Übersicht bei 1, 2). Der wesentliche therapeutische Fortschritt besteht darin, daß mit der Eradikation oft eine langdauernde Heilung der Ulkuskrankkeit erreicht werden kann. Eine Zweifachtherapie (Omeprazol plus Amoxicillin oder Clarithromycin) ist trotz niedriger Kosten und etwas geringerer Nebenwirkungen wegen signifikant niedrigerer Erfolgsrate und der damit verbundenen Notwendigkeit einer erneuten Therapie mit erneuten Kosten nicht zu empfehlen (1).
Überprüfung des Behandlungserfolges: Grundsätzlich muß nach einer Eradikationstherapie bei Patienten mit kompliziertem Ulkus (z.B. blutendes Ulcus duodeni), Ulcus ventriculi oder MALT-Lymphom der Behandlungserfolg überprüft werden. Bei Patienten, bei denen eine Eradikation aus anderer Indikation durchgeführt wurde, ist eine Kontrolle des Therapieerfolges ratsam, aber nicht obligat. Der richtige Zeitpunkt ist wichtig. Wird unmittelbar im Anschluß an eine Eradikationstherapie überprüft, besteht eine Fehlerquelle darin, daß, obwohl noch Erreger vorhanden sind, ihre Zahl durch Säuresuppression und Antibiose unterhalb der Nachweisgrenze liegt.
Weder die Bestimmung der Ureaseaktivität durch Schnell- oder Atemtest noch die Histologie ergeben dann korrekte Befunde (3). Mit der Therapiekontrolle sollte daher mindestens vier, besser sechs bis acht Wochen gewartet werden. Zu diesem Zeitpunkt ist sowohl der 13C-Harnstoff-Atemtest wie auch die erneute endoskopische Untersuchung mit Biopsie zum Nachweis von HP geeignet. Der Vorteil der endoskopischen Untersuchung ist, daß mit ihr zusätzlich ein makroskopisch-mikroskopischer Befund (z.B. Malignomausschluß beim Ulcus ventriculi zur Verfügung steht. Die Sensitivität des Ureaseschnelltests kann gesteigert werden, wenn zwei separate Biopsien aus Korpus und Antrum entnommen werden. Der 13C-Harnstoff-Atemtest hat neben den niedrigeren Kosten den Vorteil, daß mit ihm eine fokale Besiedlung des Magens mit HP besser erfaßt wird. Die Bestimmung von HP-IgG-Antikörpern (serologische Untersuchung) eignet sich zwar in epidemiologischen Studien als nicht-invasive diagnostische Methode zum Nachweis einer HP-Infektion. Sie eignet sich aber nicht zur Beurteilung des Therapieerfolgs, da auch nach einer erfolgreichen Eradikation der Titer in der Regel erst nach vier bis sechs Wochen signifikant abfällt. Darüber hinaus kann bei einer einzelnen Bestimmung des Titers nicht zwischen einer aktiven und stattgehabten Infektion unterschieden werden.
Faktoren, die den Erfolg einer Eradikationstherapie negativ beeinflussen: Bei 10-20% der Patienten wird im Rahmen der Überprüfung erneut HP nachgewiesen. Die Ursachen für das Versagen der Eradikationstherapie sind in Tab. 3 aufgeführt. Multivarianzanalysen belegen, daß die Compliance der Patienten der wichtigste Faktor für den Therapieerfolg ist (4). Nimmt der Patient mehr als 60% der vorgesehenen Tabletten ein, wird der Eradikationsversuch nicht negativ beeinflußt. Werden weniger als 60% der Tabletten eingenommen, verringert sich der Eradikationserfolg drastisch. Die Patienten müssen also über die Notwendigkeit einer möglichst vollständigen Tabletteneinnahme aufgeklärt werden. Eventuell ist eine ”Kombinationspackung“, die allerdings bisher von der Pharmaindustrie noch nicht angeboten wird, hilfreich.
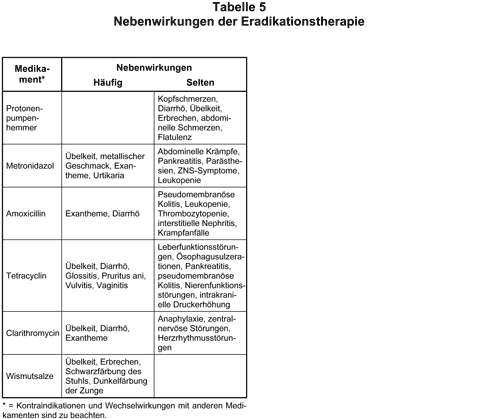
Die Resistenz von HP kann gegenüber vielen gebräuchlichen Antibiotika bestehen. Während Resistenz gegen Metronidazol mit etwa 20-30% in Europa relativ häufig ist, besteht sie gegen Clarithromycin in unseren Breiten mit ca. 2-3% selten (5, 6). Vermutlich beeinflußt eine Resistenz gegen Metronidazol die Wirkung der Therapie weniger als die gegen Clarithromycin (1, 7). Eine erneute Verwendung eines clarithromycinhaltigen Schemas scheint daher problematisch. Von einigen Autoren wird dennoch empfohlen, daß nach primärem Versagen einer Therapie mit Protonenpumpeninhibitor, Clarithromycin und Metronidazol (”Italienische Tripeltherapie“) ein Therapieversuch mit Protonenpumpeninhibitor (vierfache Standarddosis), Clarithromycin und Amoxicillin (”Französische Tripeltherapie“) gemacht wird. Alternativ wird eine Vierfachtherapie (”Quadrupeltherapie“; Tab. 4) empfohlen, die allerdings bei bis zu 80% der Patienten zu Nebenwirkungen führt und somit eine Reservetherapie ist (Tab. 5). Diese Therapie ist auch bei Resistenz gegen Metronidazol erfolgreich, allerdings nur dann, wenn auch eine Behandlung mit einem Protonenpumpeninhibitor durchgeführt wird (1).
Die Vierfachtherapie führt, soweit beurteilbar, zur höchsten bisher erreichten Eradikationsrate (1, 8, 9). Tetracyclin sollte nicht durch Abkömmlinge ersetzt werden; so ist z.B. für Doxycyclin ein geringerer Erfolg beschrieben (10). Von einigen Arbeitsgruppen wird bereits bei nicht gelungener Eradikation nach Ersttherapie (trotz gesicherter Compliance) die Anzucht des Keimes aus einer Biopsie des Antrums und Corpus ventriculi mit Erstellung eines Antibiogramms empfohlen. Anhand der (bisher leider noch nicht vollständig standardisierten) Ergebnisse ist dann eine Kombinationstherapie aus mindestens zwei der als wirksam ausgetesteten Antibiotika in Kombination mit einem Protonenpumpeninhibitor und eventuell Wismut auszuwählen (1).
Als ein weiterer Faktor, der den Erfolg einer Eradikationstherapie verringern kann, gilt nach verschiedenen Studien die Vorbehandlung mit säurehemmenden Medikamenten, besonders Protonenpumpeninhibitoren. So fanden u.a. Labenz, J., et al., daß nach einer Vorbehandlung mit Omeprazol (mindestens 40 mg/d sieben Tage lang) die HP-Eradikationsrate nach einer siebentägigen Zweifachtherapie (Omeprazol/Amoxicillin) nur noch 29% beträgt (11). Es wird angenommen, daß die Vorbehandlung mit Omeprazol einen der antimikrobiellen Therapie nicht zugänglichen Status der Bakterien (”kokkoide Persistenzform“) induziert. Andere Autoren haben diesen negativen Effekt einer Vorbehandlung mit Protonenpumpeninhibitoren nicht bestätigen können. Er ist angesichts der guten Wirksamkeit der neuen Eradikationsschemata (Tab. 2) möglicherweise auch nicht entscheidend für den Therapieerfolg.
Rauchen und Alkoholkonsum können den Erfolg der Eradikationstherapie vermindern. Dabei zeigen Multivarianzanalysen, daß der Einfluß von Rauchen und Alkohol auf die Eradikationsrate unabhängig von der Compliance der Patienten ist (z.B. Eradikationsraten Nichtraucher vs. Raucher nach Omeprazol/Amoxicillin-Zweifachtherapie: 83% vs. 68%; 4). Die Gründe sind nicht klar Es wird vermutet, daß die Transitzeit des Magens verkürzt wird und eine verminderte antisekretorische Wirkung zu suboptimalen pH-Werten und Konzentrationen von Amoxicillin führt.
Beim erneuten Nachweis von HP nach Eradikationstherapie muß zwischen Therapieversagen und erneuter Besiedlung des Magens mit dem Bakterium unterschieden werden. Die Reinfektion tritt meistens im ersten bis zweiten Jahr nach der Eradikation auf. Molekularbiologische Untersuchungen zeigten eine Übereinstimmung der neuen Stämme mit den zuvor behandelten (12). Möglicherweise infiziert sich die erfolgreich behandelte Person erneut bei anderen Personen, z.B. beim gemeinsamen Haushalt. Studien belegen, daß die HP-Stämme bei Familienangehörigen sehr oft identisch sind. In diesem Fall kann das Therapieschema, das initial erfolgreich war, wiederum angewandt werden. Insgesamt ist die Reinfektionsrate mit maximal 1%/Jahr sehr niedrig (13).
Zur Rezidivtherapie stehen die Daten größerer prospektiver Studien noch aus, so daß jede Therapie zur Zeit als experimentell anzusehen ist. Eine Erfolgskontrolle ist dringend anzuraten. Gelingt trotz guter Compliance die Eradikation nicht, bleibt in ausgewählten Fällen nach Abwägung von Nutzen und Risiko die Dauertherapie mit einem säurehemmenden Wirkstoff.
Literatur
- Caspary, W.F., et al.: Z. Gastroenterol. 1996, 34, 392.
- Teiber, G.: Am. J. Gastroenterol. 1996, 91, 246.
- Xia, H.-X., et al.: Gut 1995, 37, 30.
- Labenz, J., et al.: Scand. J. Gastroenterol. 1994, 29, 1070.
- Vakil, N., und Fennerty, M.B.: Am. J. Gastroenterol. 1996, 91, 239.
- Anonymous: Eur. J. Microbiol. lnfect. Dis. 1992, 11, 777.
- Graham, D.Y.: Gastroenterology 1992, 102, 493.
- de Boer, W.A., et al.: Am. J. Gastroenterol. 1994, 89, 1993.
- Soll, A.H.: JAMA 1996, 275, 622.
- Borody, D.J., et al.: Scand. J. Gastroenterol. 1992, 27, 281.
- Labenz, J., et al.: Am. J. Gastroenterol. 1993, 88, 491.
- Xia, H.-X., et al.: Gut 1995, 37, 30.
- Graham, D.Y., et al.: Gastroenterology 1991, 100, 1495.