Mit Abschwächung der ersten COVID-19-Welle steigen persönliche und epidemiologische, aber auch wirtschaftliche und politische Interessen an der Erhebung des SARS-CoV-2-Antikörperstatus vieler Menschen. Dabei sind zwei unterschiedliche Arten von Tests grundsätzlich zu unterscheiden: Labortests und Schnelltests.
Labortests: Es handelt sich um Tests zum Nachweis von SARS-CoV-2-Antikörpern (Ak) mittels Enzyme-Linked-Immunosorbent-Assay (ELISA) oder Elektrochemolumineszenz (ECL)-Immunassay. Sie ermöglichen Medizinlabors einen quantitativen SARS-CoV-2-Ak-Nachweis („Titerbestimmung“) mit potenziell hoher Sensitivität und Spezifität und können automatisiert viele hundert Proben gleichzeitig untersuchen. Mehrere sind bereits kommerziell verfügbar oder stehen kurz vor der Zulassung.
Zuletzt erhielt im Mai ein Ak-Test auf Elektrochemolumineszenz (ECL)-Basis (Elecsys® Anti-SARS-CoV-2, Roche Diagnostics) eine CE-Zertifizierung sowie eine FDA-Notfallzulassung („Emergency Use Authorization“; EUA) und wird seither in geplanten Stückzahlen von mehreren Millionen pro Monat ausgeliefert. Es handelt sich bei Elecsys® um ein gebräuchliches immunologisches Labortest-Verfahren, welches auf weltweit verbreiteten Standard-Laborplattformen rasch und in großer Zahl durchgeführt werden kann. Nach Herstellerangaben lag die Sensitivität des Nachweises von SARS-CoV-2-Ak (> 14 Tage nach positiver PCR!) bei 100% (n = 208) und die Spezifität bei 99,8% (n = 5.272; 1). Die Ergebnisse bzw. die Aussagekraft dieses und anderer Ak-Tests sind jedoch grundsätzlich mit Vorbehalt zu interpretieren (s.u.), da sehr viele Faktoren zum SARS-CoV-2 und zu den immunologischen Reaktionen noch unzureichend bekannt sind.
Schnelltests: Seit einigen Wochen werden von einer zunehmenden Zahl kommerzieller (Online-)Anbieter Kits für Schnelltests auf SARS-CoV-2-Ak angeboten, die auch von Hausärzten, Apotheken und auch von Einzelpersonen selbst durchgeführt werden können (Preislage meist 150-200 €). Diese sogenannten „Point-of-Care (POC)-Tests“ beruhen auf einer Kombination aus Dünnschichtchromatographie und Immunassay. Durch Färbung auf einem Teststreifen (wie z.B. auch bei Schwangerschaft- oder Drogenschnelltests) erfolgt ein qualitativer Nachweis (positiv/negativ) von IgG- und IgM-Ak, die gegen Antigene von SARS-CoV-2 gerichtet sind.
Klinische Validierungen von Anti-SARS-CoV-2-Schnelltests an Probandengruppen sind bisher nicht vorhanden oder unzureichend (z.B. 2). In den USA war die FDA zuletzt gezwungen vor deren Anwendung zu warnen (3), nachdem der US-amerikanische Markt und in weiterer Folge der globale Online-Handel von mangelhaft validierten Produkten – überwiegend aus China – geradezu überschwemmt wurden. Vorangegangen war eine sehr problematische Entscheidung der FDA, nach der ca. 90 Herstellern die Vermarktung ihrer Antikörpertests ohne die in solchen Situationen sonst übliche EUA erlaubt wurde – unter der aus unserer Sicht nicht akzeptablen Auflage, die Validierung eigenverantwortlich durchzuführen (4).
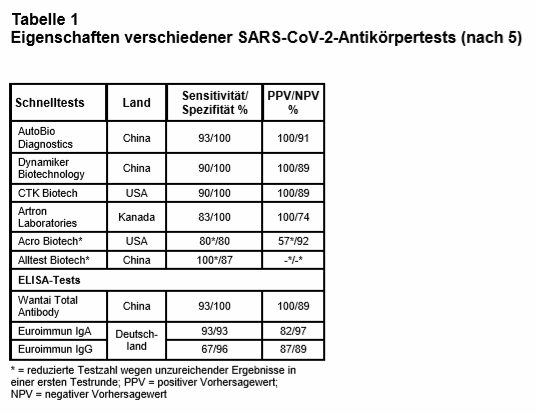
Eine vorerst als Preprint (ohne Peer-Review-Verfahren) publizierte dänische Studie untersuchte an sehr kleinen Stichproben die Sensitivität und Spezifität neun verschiedener, CE-zertifizierter und in Europa zugelassener (auch in Dänemark erhältlicher) Ak-Tests unterschiedlicher Hersteller – sechs POC-Schnelltests und drei ELISA-Tests (5). Die Tests wurden mit Seren von 30 intensivpflichtigen, durch positiven molekularen Virusnachweis mittels Polymerase-Kettenreaktion (PCR) bestätigten COVID-19-Patienten durchgeführt. Als Kontrolle wurden Seren von 10 Gesunden (archiviert vor Ausbruch der Pandemie, keine Reiseanamnese), Seren von insgesamt 50 Patienten mit anderen respiratorischen Infekten (sowohl Corona- als auch Nicht-Coronaviren) und Seren von insgesamt 20 Patienten mit Dengue-Fieber, Epstein-Barr-Virus- oder Cytomegalievirus-Infektion untersucht. Während die drei ELISA-Tests ganz überwiegend zufriedenstellende Ergebnisse zeigten, waren die der neun POC-Tests deutlich heterogener (s. Tab. 1). Im zeitlichen Verlauf der COVID-19-Erkrankung nahmen die Testsensitivitäten erwartungsgemäß tendenziell zu und lagen bei 40-86% in der „frühen“ Phase (7-13 Tage nach Symptombeginn), bei 67-100% in der mittleren Phase (14-20 Tage) und bei 78% in der späten Phase (≥ 21 Tage). Die Testspezifitäten lagen bei einem ELISA- und vier POC-Tests bei 100%, die übrigen zeigten unterschiedliche Kreuzreaktionen mit anderen Viren (Adeno, Dengue, CoV-HKU1).
Als Einschränkung der Ergebnisse ihrer monozentrischen Studie führen die Autoren an, dass als Positivgruppe Intensivpatienten getestet wurden und die Ergebnisse nicht direkt auf Patienten mit milderem oder ganz symptomlosem Verlauf übertragbar sind. Allerdings gäbe es aus anderen Untersuchungen keine Hinweise darauf, dass bei diesen Patientengruppen mit anderen Serokonversionsraten zu rechnen sei. Zu bedenken ist auch, dass die beobachteten Zahlen der Sensitivität und Spezifität nur für die untersuchte, sehr kleine Population mit 30 positiv- und 80 negativ getesteten Patienten gelten und in größeren Populationen naturgemäß mit abweichenden Werten zu rechnen ist. Insbesondere ist nicht von einem so hohen Anteil an 100%iger Spezifität auszugehen. Die Ergebnisse sind als vorläufig zu betrachten, und die Bedeutung der Publikation liegt besonders darin, dass sie erstmals in einer Population mehrere kommerziell verfügbare SARS-CoV-2-Antikörpertests vergleicht.
Für die klinische Interpretation der Ergebnisse von Antikörper-Tests sind grundsätzlich folgende allgemeine Zusammenhänge zu beachten. Dies gilt insbesondere für POC-Tests:
-
Einflüsse auf die Sensitivität: SARS-CoV-2-spezifische Ak der Klasse IgM und IgG sind erst ab der 2. Erkrankungswoche bei 40% der Patienten nachweisbar (IgA etwas früher). Etwa ab der 3. Woche liegt dann die Nachweisbarkeit spezifischer Ak bei > 90% – mit äußerst großen interindividuellen Schwankungen. Bei Patienten mit Immunsuppression ist zu bedenken, dass die Ak-Antwort trotz bestehender oder abgelaufener COVID-19-Erkrankung unterhalb der Nachweisgrenze bleiben kann.
-
Einflüsse auf Spezifität: Da die Struktur von SARS-CoV ausgeprägte Homologien zu anderen Viren aufweist, insbesondere zu anderen humanpathogenen Coronaviren, können Ak-Tests nach trivialen Erkältungserkrankungen Kreuzreaktionen zeigen. Nur ein geringer Anteil der antigenen Virusoberfläche ist SARS-CoV-2-spezifisch, z.B. ein Teil des Spike-Proteins mit der „Receptor-Binding-Domain“ (RBD). Ak, die gegen andere Regionen des Virus oder auch gegen andere Teile des Spike-Proteins gerichtet sind, sind deutlich weniger spezifisch. Für viele Ak-Tests – insbesondere für zahlreiche POC-Tests – ist diese Kreuzreaktivität nur ungenügend charakterisiert.
In folgenden Fragestellungen könnten Ak-Tests auf SARS-CoV-2 nach aktuellem Stand möglicherweise als sinnvoll angesehen werden (6-9). Voraussetzung ist die Verwendung optimal validierter Tests und die an die jeweilige Situation angepasste Interpretation unter Beachtung der Sensitivität und Spezifität:
Symptomatische Patienten: Aufgrund der oben genannten Einschränkungen haben Ak-Tests keinen Stellenwert in der Diagnostik der akuten COVID-19-Erkrankung.
Abschätzung der individuellen Immunität und des Infektionsrisikos asymptomatischer Personen: Dies erscheint primär für Personen sinnvoll, die Kontakt mit vulnerablen und/oder an COVID-19 erkrankten Personengruppen haben, z.B. im Gesundheitswesen, in der Lebensmittelversorgung, im familiären Umfeld. Eventuelle praktische, juristische und ethische Konsequenzen („Immunitätszertifikat?, COVID-Pass“?) sind vorerst jedoch noch völlig unklar und unseres Erachtens kritisch zu sehen.
Seroepidemiologische Untersuchungen und Abschätzung einer Herdenimmunität: Die tatsächliche Zahl der aktuellen und abgelaufenen symptomatischen und asymptomatischen Infektionen in der Gesamtbevölkerung und damit wesentliche epidemiologische Kennzahlen von SARS-CoV-2, wie Manifestationsindex und Infektionsletalität, können erst durch große, repräsentative Stichproben mit hochspezifischen Ak-Tests (Spezifität deutlich > 99%) abgeschätzt werden („Serosurveys, Serosurveillance“). Derartige Untersuchungen sind zurzeit an vielen Forschungsinstituten weltweit im Gange.
Gewinnung von Ak für therapeutische Zwecke: Ak-Tests sind eine Voraussetzung, um potenzielle Spender von Rekonvaleszentenseren zu identifizieren. Diese könnten für die passive Immunisierung schwer kranker COVID-19-Patienten herangezogen werden, wie sie derzeit an mehreren Zentren in ersten Studien evaluiert wird (vgl. 11).
Aufgrund der eingeschränkten Aussagekraft (Sensitivität/Spezifität) und der teilweise fehlenden Validierung raten neben der FDA mittlerweile auch die WHO (8) und das RKI (9) sowie Gesundheitsministerien, Krankenkassen, Apotheker- und Ärzteverbände (10) dringend von der Anwendung von POC-Tests („Schnelltests“, „Selbsttests“, „Streifentests“) in allen genannten Bereichen ab.
Fazit: Die Durchführung serologischer SARS-CoV-2-Antikörpertests sollte definierten klinischen und epidemiologischen Fragestellungen vorbehalten bleiben und in Anbetracht verschiedener noch ungeklärter Fragen außerhalb klinischer Studien mit Zurückhaltung erfolgen. Von der Anwendung sogenannter „Point-of-Care“-Streifentests („Schnelltests“) – insbesondere in der Form von Patienten-Selbsttests – ist dringend abzuraten. Diese sind weder zur Diagnostik in der akuten Erkrankungsphase noch zur verlässlichen Beurteilung der individuellen Immunität geeignet. Eine aktuell publizierte Gegenüberstellung zeigt beträchtliche Unterschiede bei Sensitivität und Spezifität von neun CE-zertifizierten SARS-CoV-2-Antikörpertests.
Literatur
- https://diagnostics.roche.com/ global/en/products/params/ elecsys-anti-sars-cov-2.html Link zur Quelle
- Döhla, M., et al.: Public Health 2020,182,170. Link zur Quelle
- https://www.fda.gov/news-events/ press-announcements/coronavirus-covid -19-update-serological-test-validation -and-education-efforts Link zur Quelle
- https://www.nytimes.com/2020/04/19/ us/coronavirus-antibody-tests.html Link zur Quelle
- Lassaunière, R., et al.: Link zur Quelle
- Abbasi, J.: JAMA 2020. Link zur Quelle
- https://www.oeglmkc.at/corona.html Link zur Quelle
- https://www.who.int/news-room/commentaries/detail/ advice-on-the-use-of-point-of-care- immunodiagnostic-tests-for-covid-19 Link zur Quelle
- https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/ Vorl_Testung_nCoV.html Link zur Quelle
- https://deutsch.medscape.com/artikelansicht/4908825 Link zur Quelle
- AMB 2020, 54, 30. Link zur Quelle