Zusammenfassung: Gastrointestinale Nebenwirkungen nicht-steroidaler Antiphlogistika sind häufig und wichtig. Ein besonderes Risiko hierfür haben ältere Patienten, Patienten mit Ulkusanamnese oder bei gleichzeitiger Kortikosteroid-Medikation. Bei ihnen sollte eine „Magenschutz-Prophylaxe“ durchgeführt werden. Hierfür stehen Protonenpumpenhemmer, Prostaglandin-Analoga und H2-Blocker zur Verfügung. Mit Omeprazol (20 mg/d) lassen sich häufig gastrointestinale Komplikationen verhindern; eine höhere Dosis ist nicht wirksamer. Omeprazol schützt auch – aber nicht immer – wenn die Behandlung mit nicht-steroidalen Antiphlogistika fortgeführt werden muß. Unter einer Prophylaxe mit Misoprostol (4 mal 200 µg/d) kann die Zahl schwerer gastrointestinaler Nebenwirkungen signifikant gesenkt werden. Aber auch durch strenge Indikation, Auswahl der Substanz und bessere Information der Patienten können solche Nebenwirkungen verringert werden. Die Entdeckung zweier Isoformen der Zyklooxygenase (COX 1 und COX 2) wird möglicherweise zur Entwicklung COX-2-selektiver Antiphlogistika mit weniger gastrointestinalen Nebenwirkungen führen.
Etwa 20% aller Arztkontakte erfolgen wegen „rheumatischer“ Symptome; im höheren Alter sind sie häufiger. Analgetika und Antirheumatika stehen mit 97 Mill. Verordnungen/Jahr in Deutschland an der Spitze aller Medikamentengruppen; 40% der Verbraucher sind älter als 60 Jahre (Übersichten bei 1, 2).
Nicht-steroidale Antiphlogistika (NSAID) führen in 20-40% zu gastrointestinalen (GI) Nebenwirkungen. Das Ausmaß dieser – zu speziell – auch als NSAID-Gastropathie bezeichneten Erkrankungen variiert stark: von asymptomatischen, nur endoskopisch nachzuweisenden Mukosaschäden, Magenschmerzen, Sodbrennen, Dyspepsie bis zu bedrohlich blutenden Magen- oder Duodenalulzera. Dabei korrelieren Anamnese, Symptome und endoskopische Befunde allerdings nur mäßig (3). Bei mehr als der Hälfte der Patienten sind schwere GI-Komplikationen sogar die erste Manifestation der NSAID-Gastropathie (4).
In Kurzzeit-Studien (wenige Wochen) finden sich initial asymptomatische Mukosaschäden nach NSAID bei bis zu 80% der Patienten (5); die Inzidenz ernster GI-Komplikationen liegt bei 1-2%/Jahr (6). Unerwünschte Wirkungen im unteren Intestinal-Trakt (Blutungen, Perforationen, Strikturen) sind seltener (7). Etwa 10-20% der mit NSAID behandelten Patienten klagen über dyspeptische Beschwerden (8). Ca. 10% brechen wegen dieser Nebenwirkungen die Behandlung innerhalb eines halben Jahres ab (1). Unter kontinuierlicher NSAID-Einnahme bekommen 15-20% der Behandelten ein Ulkus (6, 7), und 1-3% müssen bei einer Dauertherapie wegen einer GI-Blutung oder Perforation im Krankenhaus behandelt werden. In einer Metaanalyse wurde ein relatives Risiko für ernste GI-Komplikationen von 2,7 berechnet; die Odds ratio für eine chirurgische Intervention beträgt 7,8 (9, 10). In einer Studie, die auf Daten der großen amerikanischen Datenbank ARAMIS basiert, war das Risiko einer schweren GI-Komplikation durch eine NSAID-Therapie 5,5fach erhöht (1). Etwa 10% der deswegen stationär aufgenommenen Patienten sterben (11); die jährliche Sterberate wurde mit 0,2% berechnet (1).
Charakteristika NSAID-bedingter Ulzera: Pathogenetisch und klinisch können NSAID-vermittelte von peptischen Ulzera unterschieden werden (s. Tab. 1).
Verschiedene Studien haben folgende Risikofaktoren für GI-Nebenwirkungen unter einer Therapie mit NSAID identifiziert, die man zum Teil für die Planung einer Prophylaxe heranziehen kann:
- gleichzeitige Kortikosteroid-Therapie
- frühere GI-Nebenwirkungen
- hohe Dosierung und lange Dauer der NSAID-Therapie
- höheres Lebensalter
- Behinderungen
- gleichzeitige Antikoagulanzien-Therapie
Bei diesen Risikofaktoren ist die Indikation einer Therapie mit NSAID sehr gründlich zu prüfen und, falls sie gegeben ist, eine prophylaktische Medikation zu erwägen. Der wichtigste Risikofaktor ist eine gleichzeitige Behandlung mit Kortikosteroiden. Kortikosteroide in niedriger Dosierung sind aber selbst kein sicherer Risikofaktor für GI-Nebenwirkungen (12, 13). Deshalb sind bei einer längerdauernden Therapie der rheumatoiden Arthritis in der Regel niedrige Dosen Prednisolon (= 7,5 mg/d) vorzuziehen, zumal diese Behandlung auch Gelenkerosionen verhindern bzw. verzögern kann (14). Allerdings die Prophylaxe einer Steroid-Osteoporose zu bedenken (Übersichten bei 15). Zunächst sollte versucht werden – und dies nicht nur bei älteren Patienten – mit einem wenig gastrotoxischen Analgetikum, z.B. Paracetamol, bzw. mit niedrigen Dosen eines NSAID auszukommen.
Vergleich der Nebenwirkungen verschiedener NSAID: Die verschiedenen Substanzklassen der NSAID sind in unterschiedlichem Ausmaß mit GI-Nebenwirkungen korreliert. Ein grundsätzliches Problem solcher Studien ist jedoch die Vergleichbarkeit der verwendeten Dosierungen. An Hand verschiedener Studien kann man davon ausgehen, daß die GI-Nebenwirkungen der NSAID in der Reihenfolge Ibuprofen < Diclofenac < Naproxen < Piroxicam < Indometacin < Ketoprofen zunehmen (1). Bei den niedrigen Dosierungen, die diesem Vergleich zugrunde liegen, steht bei Ibuprofen (ähnlich wie bei Azetylsalizylsäure) allerdings die analgetische und nicht die antiphlogistische Wirkung im Vordergrund. Meloxicam, das erst kürzlich eingeführt wurde, ist in dieser Liste noch nicht enthalten, gehört aber nach Ergebnissen mehrerer Studien zu den weniger GI-toxischen NSAID. Dies gilt vor allem für die niedrige Dosierung von 7,5 mg, die ähnlich effektiv wie 100 mg Diclofenac oder 20 mg Piroxicam zu sein scheint (16-18). Eine höhere Dosierung (15 mg/d) führt zu deutlich mehr GI-Nebenwirkungen. Größere vergleichende Studien wurden soeben publiziert (16, 17). In der MELISSA-Studie (16) wurden fast 10000 Patienten entweder mit 7,5 mg Meloxicam/d oder 100 mg Diclofenac/d 4 Wochen lang behandelt. Zu unerwünschten Nebenwirkungen im GI-Trakt kam es bei 19% (incl. 4 Ulzera) in der Diclofenac- vs. 13% in der Meloxicam-Gruppe (kein Ulkus). Bei älteren Patienten waren die Unterschiede etwas deutlicher. 6,1% der Patienten in der Diclofenac- und 3,0% in der Meloxicam-Gruppe brachen die Therapie ab. Diese Unterschiede waren bei der großen Fallzahl signifikant (p < 0,001). Auch in der SELECT-Studie (17) wurden viele Patienten untersucht (n = 8656). Innerhalb von 4 Wochen hatten bei gleicher Effektivität 15% in der mit Piroxicam (20 mg/d) behandelten Subgruppe älterer Patienten (> 65 Jahre) vs. 9% in der Meloxicam-Gruppe (7,5 mg/d) GI-Nebenwirkungen. In der Meloxicam-Gruppe brachen 3,8%, in der Piroxicam-Gruppe 5,3% die Behandlung ab. Auch diese Unterschiede waren statistisch signifikant. In einer anderen ebenfalls multizentrischen Studie an 473 Patienten mit ankylosierender Spondylitis, wurde Meloxicam (15 mg/d) gegen Piroxicam (20 mg/d) geprüft (18). Während eines Jahres kam es bei 23% der Patienten in der Meloxicam- und bei 31% in der Piroxicam-Gruppe zu GI-Nebenwirkungen; Ulzera fanden sich bei 4 bzw. einem Patienten. Die Effektivität war gleich; eine höhere Dosierung von Meloxicam (22,5 mg/d) war nicht überlegen. Ob die Ergebnisse dieser relativ kurzen Studien auch bei längeren Behandlungszeiten und im Hinblick auf ernstere GI-Komplikationen Bestand haben, ist unklar.
Prophylaxe der NSAID-Gastropathie: GI-Nebenwirkungen der NSAID können nicht vermieden werden, indem man die Substanzen als Suppositorien bzw. i.m. oder i.v. gibt, da die Prostaglandinhemmung im Magen vorwiegend systemisch erfolgt (19). Verschiedene vorbeugende medikamentöse Maßnahmen zur Verhinderung einer NSAID-Gastropathie sind inzwischen in prospektiven Studien untersucht. Beim Vergleich der Studienergebnisse muß jedoch der Stellenwert der Nebenwirkungen beachtet werden. Bei Patienten steht zunächst die subjektive Verträglichkeit des Medikaments im Vordergrund. Aus ärztlicher Sicht gilt es darüber hinaus, ernste, möglicherweise sogar tödliche GI-Komplikationen zu verhindern.
Antazida und H2-Antagonisten können zwar recht gut subjektive Beschwerden lindern, jedoch schwere GI-Komplikationen nicht verhindern. In einer prospektiven Studie an 1921 Patienten mit rheumatoider Arthritis (6) mußten asymptomatische Patienten, die prophylaktisch Antazida oder H2-Antagonisten erhielten, sogar häufiger wegen GI-Komplikationen stationär aufgenommen werden als diejenigen ohne Prophylaxe (3,7% vs. 1,4%).
Demgegenüber können durch das synthetische Prostaglandin-E1-Analogon Misoprostol bei 4-6wöchiger Prophylaxe nicht nur asymptomatische Läsionen um 90% reduziert werden (20), sondern, wie in der MUCOSA-Studie (21) gezeigt, auch Ulkusblutungen um 40% vermindert werden. In dieser Studie erhielten insgesamt 8843 Patienten mit rheumatoider Arthritis (mittleres Alter 67,6 Jahre) 6 Monate lang entweder 4 mal 200 µg Misoprostol/d oder Plazebo unter weiterlaufender NSAID-Behandlung. In der mit Misoprostol behandelten Gruppe mußten 14, in der Plazebo-Gruppe 28 stationär behandelt und 7 bzw. 16 sogar operiert werden.
Eine umfangreiche Kosten/Nutzen-Analyse zur Prophylaxe der NSAID-Gastropathie mit Misoprostol auf der Basis der MUCOSA-Studie ergab, daß diese Prophylaxe nur bei Hochrisiko-Patienten eindeutig zu empfehlen ist (22). Hierbei wurde zunächst ein Risikoprofil erstellt (Tab. 2), bei dem allerdings eine gleichzeitige Kortikosteroid-Medikation nicht erfaßt wurde. Danach wurden die durchschnittlichen Kosten berechnet, die bei verschiedenen Behandlungen einer GI-Komplikation entstehen. In Tab. 2 ist abzulesen, wieviel die Verhinderung einer GI-Komplikation kostet, wenn alle Patienten bzw. solche mit höherem Risiko prophylaktisch behandelt würden. Unter Berücksichtigung der Tatsache, daß ein vergleichsweise geringer Prozentsatz der Patienten (etwa 10%) eine schwere GI-Komplikation nicht überlebt, erscheint eine generelle Prophylaxe nicht vernünftig und ökonomisch nicht vertretbar. Bei Hochrisikopatienten (Alter > 75 Jahre bzw. mit Ulkusanamnese) erscheint diese jedoch gerechtfertigt. Leider sind unerwünschte Wirkungen von Misoprostol aber häufig und die Abbruchrate hoch. Bereits bestehede GI-Beschwerden werden durch Misoprostol nicht gebessert. Die Tageskosten dieser Prophylaxe (4 mal 200 µg) betragen 3,45 DM.
Präparate mit fixer Kombination eines NSAID plus Misoprostol (z.B. Misoprostol/Diclofenac = Arthotec überzeugen nicht, weil Änderungen der Dosierung erschwert werden. Außerdem werden die Symptome nicht gebessert und die Nebenwirkungen zum Teil vermehrt, was die Compliance behindert (23).
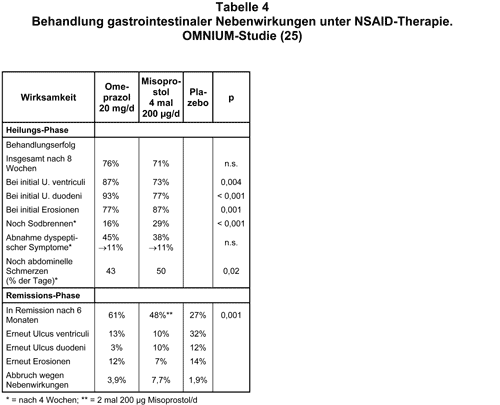
Fortführen der NSAID-Medikation bei NSAID-Gastropathie oder Ulkus: Der Protonenpumpenhemmer Omeprazol war in zwei großen Vergleichsstudien Misoprostol und Ranitidin überlegen (24, 25). Beide Studien wurden von Astra unterstützt. Es wurde die Wirksamkeit von Omeprazol (20 mg bzw. 40 mg/d) vs Ranitidin (2 mal 150 mg/d; ASTRONAUT-Studie, 24) bzw. vs. Misoprostol (4 mal 200 µg/d; OMNIUM-Studie, 21) bei Patienten untersucht, die wegen chronischer Arthritis unter einer Dauerbehandlung mit mindestens 50 mg Diclofenac/d oder 50 mg Indometacin, 100 mg Ketoprofen/d bzw. 500 mg Naproxen/d standen und gastroskopisch duodenale oder gastrale Ulzera > 3 mm bzw. mehr als 10 Erosionen hatten. In diesen multizentrischen Studie wurden 541 bzw. 935 rheumatologische Patienten zunächst 4 oder (je nach Erfolg) 8 Wochen doppelblind und randomisiert mit einem der beiden Säuresekretionshemmer bzw. Misoprostol behandelt, wobei die ca. 50% Helicobacter-positiven Patienten keine Eradikationstherapie erhielten. Der Therapieerfolg war definiert als Abwesenheit eines Ulkus bzw. Präsenz von < 5 Erosionen und allenfalls "milde Dyspepsie". Zwischen den beiden Omeprazol-Dosierungen wurde kein signifikanter Unterschied gefunden. Die wichtigsten Ergebnisse sind in Tab. 5 und 6 wiedergegeben. Omeprazol ist offenbar kurzfristig das wirksamste Medikament zur Behandlung von NSAID-Nebenwirkungen, wenn es um Magen- und Duodenalulzera geht. Auch Misoprostol und Ranitidin sind zur Ulkusprophylaxe deutlich wirksamer als Plazebo. Die Omeprazol-Dosis von 20 mg/d ist optimal und eine Dosissteigerung nicht sinnvoll. Omeprazol ist auch unter Fortführung der NSAID-Behandlung meist wirksam, wenn bereits eine NSAID-Gastropathie und sogar ein Ulkus vorliegt. Es ist noch ungeklärt, ob unter Omeprazol oder Ranitidin längerfristig- wie es für Misoprostol belegt ist, auch schwere GI-Komplikationen und Todesfälle verhindert werden. Wahrscheinlich haben andere Protonenpumpenhemmer eine dem Omeprazol vergleichbare Wirksamkeit; dies ist aber bisher nicht durch Studien gesichert. Zwei Faktoren, die das Auftreten und den Verlauf von GI-Komplikationen einer NSAID-Therapie wesentlich beeinflussen, wurden kürzlich in einer großen epidemiologischen Studie mit 112 Hausärzten in Kanada untersucht (26). Ihnen wurden typische Patienten mit chronischen Hüftgelenkschmerzen bzw. NSAID-Gastropathie vorgestellt. Es ergab sich, daß bei > 40% der Patienten NSAID unnötigerweise verschrieben wurden. Eine NSAID-Gastropathie wurde zu 93% korrekt diagnostiziert, aber nur in 77% akzeptabel behandelt. Nicht-Beachten von Kontraindikationen und kurze Visitenzeiten erhöhten das Risiko für einen Behandlungsfehler. In diesen Rahmen paßt auch die kürzlich von A. Herxheimer publizierte Feststellung, daß Patienten, denen NSAID verschrieben werden, nicht ausreichend über Symptome einer möglichen GI-Komplikation (Oberbauchschmerzen, Teerstuhl u.a.) aufgeklärt werden. Sie setzen daher häufig bei solchen Nebenwirkungen das Medikament nicht rechtzeitig ab oder stellen sich zu spät beim Arzt vor (27).
Das Problem, ob trotz NSAID-Gastropathie bzw. Ulkus die Therapie mit NSAID fortgeführt werden soll oder darf, ist bei Patienten mit rheumatoider Arthritis oder ankylosierender Spondylitis nicht selten; gerade diese Patienten sind häufig auf NSAID angewiesen, weil andere Analgetika (z.B. Opiate) nicht vergleichbar gut wirken. Bei dem für Spondylarthropathien typischen „entzündlichen Rückenschmerz“ (meist durch Sakroiliitis) hat ein gutes Ansprechen auf NSAID auch differentialdiagnostische Bedeutung; zudem müssen manchmal sehr hohe Dosen NSAID eingesetzt werden (Übersicht bei 28).
Das Absetzen der NSAID bereitet in solchen Situationen oft erhebliche therapeutische Probleme. Nach den Ergebnissen der OMNIUM-Studie ist nun davon auszugehen, daß selbst bei bereits bestehenden Ulzera durch eine Behandlung mit 20 mg Omeprazol/d bei 76% der Patienten eine Remission zu erreichen ist (25). Dies war auch mit 4 mal 200 µg Misoprostol/d bei 71% der Patienten möglich; allerdings waren die Nebenwirkungen unter Misoprostol deutlich häufiger (Diarrhö 11,4% vs. 4,5%; Bauchschmerzen 8% vs. 1,9%) und die Abbruchrate größer (17% vs. 10%). Die Remission (Beobachtungszeitraum 6 Monate) blieb unter 20 mg Omeprazol/d bei 61% der Patienten erhalten vs. 48% unter 2 mal 200 µg Misoprostol/d (p = 0,001) und bei nur 27% unter Plazebo. Bei einem großen Teil der Patienten, die auf eine regelmäßige NSAID-Medikation angewiesen sind aber ein Ulkus haben, kann unter Omeprazol trotz Weiterbehandlung mit NSAID das Ulkus heilen. Bei blutenden Ulzera muß man jedoch wie bisher das NSAID absetzen. Wie lange dies erforderlich ist, wurde noch nicht systematisch untersucht.
NSAID-Medikation und Nachweis von Helicobacter pylori (Hp): Möglicherweise haben Hp-positive Patienten unter NSAID häufiger dyspeptische Beschwerden (29). Ob diese Patienten auch häufiger Ulzera bekommen, ist aber bislang unklar (30). In einer großen amerikanischen Studie konnte keine Synergie zwischen NSAID-Gebrauch und Hp-Status gefunden werden (31). Die Hypothese, daß bei einer Hp-Infektion die Synthese von Mukosa-Prostaglandinen stimuliert wird, war zusammen mit der Beobachtung, daß bei einer HP-Infektion unter Omeprazol-Therapie höhere intragastrale pH-Werte gemessen werden, Grundlage der OMNIUM- und ASTRONAUT-Studie (24, 25). Es wurde in diesen Studien bei Hp-Infektion auf eine systematische Eradikation verzichtet. Beim der Evaluierung nach 6 Monaten erwies es sich bei den mit Omeprazol Behandelten sogar als Vorteil, wenn Hp nicht eradiziert worden war (83% vs. 73% Heilung); dies war dagegen in der Misoprostol-Gruppe nicht der Fall (69% vs. 74%). Es ist jedoch nicht auszuschließen, daß hierfür eine Patientenselektion verantwortlich ist.
Es ist gut etabliert, daß Patienten mit Hp-positivem Ulkus nach einer antibiotischen Eradikationstherapie in Kombination mit einem Protonenpumpenhemmer weniger Rezidive innerhalb des nächsten Jahres erleiden. Ob Patienten, die so behandelt wurden und danach NSAID einnehmen, seltener oder gar häufiger GI-Nebenwirkungen durch NSAID oder Rezidive bekommen, ist nicht bekannt (30). Auch ist bislang sehr fraglich, ob eine Eradikationstherapie bei Hp-positiven Patienten ohne Ulkus die dyspeptischen Symptome vermindert (46-48). Wegen dieser Unsicherheiten wurde eine routinemäßige Abklärung des Hp-Status vor Beginn einer NSAID-Therapie als grundsätzlich nicht erforderlich angesehen (30). Dem stehen allerdings Ergebnisse einer prospektiven Studie entgegen, in der 100 Hp-positive Patienten vor Beginn einer NSAID-Therapie (750 mg Naproxen/d) randomisiert doppeltblind ein einwöchiges Tripel-Eradikationsregime (4 mal 500 mg Tetracyclin, 4 mal 120 mg Wismutzitrat, 4 mal 400 mg Metronidazol/d) oder Plazebo erhielten (28). Nach acht Wochen hatten 26% in der Plazebo- und 7% in der Verum-Gruppe ein Ulkus entwickelt (p = 0,01).
Für die derzeitige Praxis bietet sich an, Patienten, die unter NSAID-Therapie anhaltend Oberbauchsymptome haben, zu endoskopieren und bei Hp-Nachweis eine Eradikationsbehandlung durchzuführen. Eine prinzipielle Hp-Diagnostik bei symptomfreien Patienten vor oder unter NSAID-Therapie ist aber abzulehnen.
Neue NSAID ohne gastrointestinale Nebenwirkungen? Seit 1971 ist bekannt, daß NSAID durch Hemmung der Zyklooxygenase (COX) zu einer Reduktion proinflammatorischer Prostaglandine führen. Dieser Wirkmechanismus erklärt einerseits die analgetischen und antiphlogistischen Effekte, andererseits aber auch die unerwünschten Wirkungen, vor allem im GI-Trakt und in der Niere, wo sich die NSAID aufgrund ihres Säurecharakters anreichern. In den letzten Jahren wurde gefunden, daß es zwei Isoformen der COX gibt, die unterschiedlich in Geweben verteilt und reguliert sind (33, 34). Während die COX-1 physiologische Funktionen u.a. in Niere und Magen hat und Adaptationsvorgänge reguliert, wird die COX-2 im Rahmen von Entzündungen und anderen Gewebsschädigungen exprimiert (35). Diese Befunde haben eine intensive Suche nach selektiven COX-2-Hemmern ausgelöst. Die verwendeten Testsysteme erwiesen sich jedoch als problematisch (36). Keines der in Deutschland zugelassenen NSAID erwies sich als COX-2-selektiv (34,37). Das stark beworbene Meloxicam (38, 49) und auch das am häufigsten verschriebene Diclofenac hemmen die COX-2 aber immerhin präferentiell.
Die Kristallstruktur der beiden COX-Isoformen ist inzwischen aufgeklärt (39, 40). Der selektive COX-2-Hemmer Celecoxib (SC-58635) befindet sich bereits in der Spätphase klinischer Studien (41). Ob bei diesen Substanzen der Vorteil seltenerer GI-Nebenwirkungen nicht durch den Nachteil geringerer antiphlogistischer Wirksamkeit erkauft wird, bleibt abzuwarten. Darüber hinaus ist keineswegs klar, ob die COX-Selektivitäts-Hypothese allgemeine Gültigkeit hat, da tierexperimentelle Untersuchungen viele Fragen aufwerfen (42, 43). Eine kanadische Arbeitsgruppe fand im Tierexperiment, daß auch die COX-1 wesentlich zur Entzündungsreaktion beiträgt und daß eine Entzündungshemmung mit verschiedenen NSAID nur in einem Dosisbereich zu erzielen war, in dem auch die COX-1 gehemmt wurde (44). Das hat mögliche Implikationen für das Nebenwirkungsspektrum neuer selektiver COX-2-Hemmer. Substanzen, wie das kürzlich in Science publizierte o-(acetoxyphenyl)hept-2-ynyl-Sulfid (APHS), das 100mal selektiver als Azetylsalizylsäure die COX-2 hemmt, lassen natürlich hoffen (45).
Literatur
1. Singh, G., und Ramey, D. R.: J. Rheumatol. X2000, 356, 1219.
2. Blum, A.L., et al.: Dt. Ärztebl. 1998, 95, A-348.
3. Graham, D.Y., und Smith, J.L.: Am. J. Gastroenterol. 1988, 83, 1081.
4. Lichtenstein, D.R., et al.: Arthritis Rheum. 1995, 38, 5.
5. Ehsanullah, R.S., et al.: Brit. Med. J. 1988, 297, 1017.
6. Singh, G., et al.: Arch. Intern. Med. 1996, 156, 1530.
7. Brooks, P.M. und Day, R. O.: N. Engl. J. Med. 1991, 324, 1716.
8. Hardin, J.G., und Longenecker, G.L.: Handbook of drug therapy in rheumatic disease. Pharmacologic and clinical aspects. Little, Brown and Co., Boston, 1992.
9. Gabriel, S.E., et al.: Ann. Intern. Med. 1991, 115, 787.
10. Garcia Rodriguez, L.A., und Jick, H.: Lancet 1994, 343, 769.
11. Fries, F.J.: J. Rheumatol. 1991, 28 Suppl., 6.
12. Piper, J.M., et al.: Ann. Intern. Med. 1991, 114, 735.
13. Hochain, P., et al.: Eur. J. Gastroenterol. Hepatol. 1995, 7, 419.
14. Kirwan, J., et al.: N. Engl. J. Med. 1995, 333, 142.
15. AMB 1993, 27, 60 und 1998, 32, 49.
16. Hawkey, C., et al. (MEloxicam Large-scale International Study Safety Assessment = MELISSA) Br. J. Rheumatol. 1998, 37, 937.
17. Dequeker, J., et al. (Safety and Efficacy Large-scale Evaluation of COX-ihibiting Therapies = SELECT): Br. J. Rheumatol. 1998, 37, 946.
18. Dougados, M., et al.: Poster, 3. APLAR-Kongreß, Januar 1998.
19. Hansen, T.M., et al.: J. Rheumatol. 1984, 11, 484.
20. Graham, D.J., et al.: Ann. Intern. Med. 1993, 119, 257.
21. Silverstein, F.E., et al. (Misoprostol Ulcer Complications Outcome Safety Assessment study = MUCOSA): Ann. Intern. Med. 1995, 123, 241.
22. Maetzel, A., et al.: Arthritis Rheum. 1998, 41, 16.
23. McKenna, F.: J. Rheumatol. 1998, 25 Suppl., 21.
24. Yeomans, N.D., et al. (Acid Suppression Trial: Ranitidine versus Omeprazole for NSAID-Associated Ulcer Treatment study = ASTRONAUT): N. Engl. J. Med. 1998, 338, 719.
25. Hawkey, C.J., et al. (Omeprazole versus Misoprostol for NSAID-Induced Ulcer Management = OMNIUM): N. Engl. J. Med. 1998, 338, 727.
26. Tamblyn, R., et al.: Ann. Intern. Med. 1997, 127, 429.
27. Herxheimer, A.: Brit. Med. J. 1998, 316, 492.
28. Braun, J., und Sieper, J.: Curr. Opin. Rheumatol. 1996, 8, 275.
29. Hawkey, C.J.: In: Helicobacter pylori: basic research to clinical cure. Hunt, R.H., und Tytgat, G.N.J. (Hrsg.). Kluwer Academic, London, 1996.
30. Veldhuyzen van Zanten, S.J.O.: Gastroenterology 1997, 113,S90.
31. Schubert, T.T., et al.: Am. J. Med. 1993, 94, 413.
32. Chan, F.K.L., et al.: Lancet 1997, 350, 975.
33. Vane, J.: Nature 1994, 367, 215.
34. Brune, K., und Hinz, B.: Dt. Ärztebl 1998, 95, A-343.
35. Siegle, I., et al.: Arthritis Rheum. 1998, 41, 122.
36. Patrignani, P., et al.: J. Pharmacol. Exp. Ther. 1994, 271, 1705.
37. Cryer, B., und Feldman, M.: Am. J. Med. 1998, 104, 413.
38. Distel, M., et al.: Brit. J. Rheumatol. 1996, 35, 68.
39. Picot, D., et al.: Nature 1994, 367, 243.
40. Luong, C., et al.: Nature Struct. Biol. 1996, 3, 927.
41. Hubbard, R.C., et al.: Arthritis Rheum. 1996, 39 Suppl., 1188.
42. Dinchuk, J.E., et al.: Nature 1995, 378, 406.
43. Langenbach, R., et al.: Cell 1995, 83, 483.
44. Wallace, J.L., et al.: Gastroenterology 1998, 115, 101.
45. Kalkutgar, A.S., et al.: Science 1998, 280, 1268.
46. McColl, K., et al.: N. Engl. J.Med. 1998, 339, 1869.
47. Blum, A.L., et al.: N. Engl. J. Med. 1998, 339, 1875.
48. Friedman, L.S.: N. Engl. J. Med. 1998, 339, 1928.
49. AMB 1998, 32, 39b.