Drei Medikamentengruppen werden zur initialen Therapie des idiopathischen Parkinson-Syndroms (IPS) empfohlen: Levodopa (L-Dopa), Dopamin-Agonisten (DoA) und MAO-B-Hemmer (MBH; 1). Levodopa ist der Goldstandard. Leider lässt die Wirkung von Levodopa mit der Zeit nach, und es kommt zu motorischen Spätkomplikationen. Daher wurden „Levodopa-sparende“ Alternativen gesucht und propagiert, insbesondere für jüngere Patienten. Man glaubt, durch den primären Einsatz von DoA (z.B. Pramipexol) und MBH (z.B. Selegilin) Levodopa später einsetzen zu können und somit das Problem des Wirkverlusts verzögern zu können. Ob diese Strategie hält, was sie verspricht, ist jedoch nicht klar. Außerdem sind DoA und MBH schlechter verträglich als Levodopa.
Um den Stellenwert der drei genannten Arzneimittelgruppen in der Initialtherapie des IPS zu testen, wurde unter der Leitung von Neurologen aus Oxford und Birmingham die bislang größte randomisierte kontrollierte Studie zur Parkinson-Behandlung durchgeführt (2). Es sollte geklärt werden, welche der genannten Substanzgruppen die Lebensqualität von Parkinson-Patienten am günstigsten beeinflusst und – daraus abgeleitet – welche Initialtherapie zu bevorzugen ist. Die Studie wurde mit öffentlichen Geldern finanziert.
In einem sog. pragmatischen Open-label-Design wurden zwischen November 2000 und Dezember 2009 insgesamt 1620 Patienten mit neu diagnostiziertem IPS an 98 neurologischen und geriatrischen Zentren in Großbritannien und an je einem Zentrum in Tschechien und Russland eingeschlossen. Die Patienten waren entweder noch nicht (92%) oder weniger als sechs Monate behandelt worden, ohne dass festgelegt war, welches Medikament eingenommen werden sollte. Das mittlere Alter der Patienten betrug 70 Jahre, 65% waren Männer. 50% der Patienten befanden sich zu Beginn der Studie im Krankheitsstadium 1-1,5 nach Hoehn und Yahr (leichte Erkrankung, einseitig mit/ohne axiale Beteiligung), 22% in Stadium 2 (beidseitige Erkrankung ohne Gleichgewichtsstörungen) und 28% in den Stadien 2,5-5 (schwerere Formen). Der PDQ-39-Mobility-Score betrug im Mittel 30 Punkte. In diesem Fragebogen beantworten die Patienten 39 Fragen zu ihrer alltagsrelevanten, gesundheitsbezogenen Lebensqualität. Bewertet werden u.a. Mobilität (bis 40 Punkte), Alltagsaktivitäten (bis 24 Punkte), emotionales Wohlbefinden (bis 24 Punkte), soziale Stigmatisierung durch die Erkrankung (bis 16 Punkte) und Notwendigkeit von sozialer Unterstützung (bis 12 Punkte). Der maximale Punktwert beträgt 156 und entspricht einer maximalen Einschränkung.
Die Patienten wurden in drei Gruppen randomisiert: initiale Behandlung mit Levodopa, DoA oder MBH. Welche Präparate jeweils eingesetzt wurden, war den behandelnden Ärzten freigestellt. Diese konnten einen Patienten auch im Vorhinein von einer Randomisierung zu Levodopa, DoA oder MBH ausschließen, wenn ihnen der Patient hierfür als ungeeignet erschien. Das Hinzufügen oder Wechseln auf eine andere Substanzklasse während der Nachbeobachtung war nur erlaubt, wenn die Symptome mit dem primär eingesetzten Mittel nicht zu kontrollieren waren oder bedeutsame Nebenwirkungen auftraten. Primärer Studienendpunkt war der PDQ-39-Score, also die selbst eingeschätzte Lebensqualität. Sekundäre Endpunkte waren u.a. Therapieadhärenz, kognitive Funktionen (gemessen mit der Mini-Mental State Examination = MMSE), Entwicklung einer Demenz, Dyskinesien, Krankenhausaufnahmen und Letalität. Die mediane Nachbeobachtung betrug drei Jahre (0-7 Jahre). Die Ergebnisse wurden nach „intention to treat“ analysiert.
Ergebnisse: Bedingt durch die Möglichkeit, bestimmte Wirkstoffe auszuschließen, wurden 1058 Patienten (65%) für alle drei Medikamentengruppen randomisiert und 562 nur für zwei Medikamentengruppen (348 DoA oder Levodopa und 214 DoA oder MBH). Insgesamt wurden 524 Patienten primär mit Levodopa behandelt (32,6%), 626 mit einem DoA (meist Ropinirol oder Pramipexol) und 447 mit einen MBH (meist Selegilin oder Rasagilin). Die Levodopa-Dosis musste erwartungsgemäß über die Jahre gesteigert werden: die mittlere Tagesdosis betrug im ersten Jahr 347 mg (± 139 mg) und nach sieben Jahren 531 mg (± 229 mg). Aber auch die Dosierungen von DoA und MBH wurden über die Jahre in vergleichbarem Ausmaß gesteigert. Der Wechsel auf ein anderes Präparat oder eine Zweier-Kombination wurde im Studienverlauf deutlich häufiger bei den Levodopa-sparenden Medikamenten erforderlich: 74% mit DoA und 88% mit MBH. Im Levodopa-Stratum wurde eine Therapiemodifikation bei 41% der Patienten als notwendig erachtet. Der mit Abstand häufigste Grund für eine Therapiemodifikation waren Nebenwirkungen. Sie traten unter DoA (28%) und MBH (23%) wesentlich häufiger auf als unter Levodopa (2%). Jede(r) Zehnte entwickelte unter Levodopa-sparender Therapie bedeutsame psychiatrische Probleme, wie Psychosen, Konfusionen und Depressionen (12% bei DoA und 9% bei MBH). Solche Nebenwirkungen waren im Levodopa-Arm deutlich seltener (0,5%). Bei den übrigen Nebenwirkungen handelte es sich überwiegend um Schlafstörungen sowie gastrointestinale Symptome. Die Nebenwirkungen wurden in der Mehrzahl als mild und bei 16 Patienten als schwerwiegend klassifiziert (neun bei DoA, vier bei MBH und drei mit Levodopa). Der zweithäufigste Grund für eine Änderung der initialen Therapie war eine unzureichende Wirksamkeit. Diese war deutlich häufiger unter Levodopa-sparender Medikation: 17,4% bei MBH, 5,6% bei DoA und 0,9% bei Levodopa.
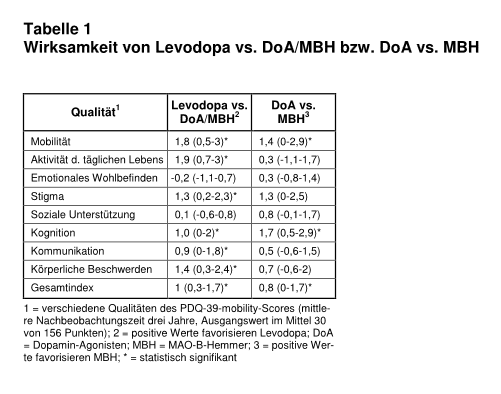
Der selbst bewertete Therapieerfolg bzw. die Lebensqualität nach durchschnittlich drei Jahren war mit Levodopa geringfügig besser als mit den Levodopa-sparenden Arzneimitteln (vgl. Tab. 1). Der PDQ-39-Gesamtscore war statistisch signifikant um einen Punkt besser als mit DoA und MBH. Dieser Vorteil lag jedoch unterhalb der als „minimal important difference“ (MID) definierten Grenze von 1,6 Punkten (Ausgangswert 30 Punkte). Levodopa schnitt gegenüber den DoA und MBH besonders bei der Mobilität, den Aktivitäten des täglichen Lebens und dem Gefühl der Stigmatisierung durch die Erkrankung besser ab. Der einzige Nachteil von Levodopa gegenüber den Levodopa-sparenden Medikamenten waren vermehrt Dyskinesien (Hazard ratio = HR: 1,52; CI: 1,16-2; p = 0,003). Hinsichtlich der motorischen Fluktuationen fanden sich keine Unterschiede. Bei dem Vergleich zwischen DoA und MBH schnitt letzteres etwas besser ab bei der Mobilität, Kognition und Stigma (Tab. 1).
Auch bei den sekundären Endpunkten fanden sich keine wesentlichen Unterschiede zwischen Levodopa und den Levodopa-sparenden Medikamenten. Es zeigten sich geringfügig bessere Werte beim EuroQol EQ-5D-Score (+0,03; CI: 0,01-0,05; p = 0,0002) und beim Verlauf des Hoehn & Yahr-Scores (+0,07; CI: 0,03-0,12; p = 0,0009). Der Abfall im MMSE innerhalb von fünf Jahren betrug sowohl mit Levodopa als auch mit DoA/MBH durchschnittlich 1,9 Punkte. Allerdings entwickelten weniger Patienten im Levodopa-Stratum eine Demenz (HR: 0,81; CI: 0,61-1,08; p = 0,14). Zudem gab es im Levodopa-Arm weniger Krankenhausaufnahmen (HR: 0,86; CI: 0,63-1,18; p = 0,4) und weniger Todesfälle (HR: 0,85; CI: 0,69-1,06; p = 0,17).
Kritisch muss gesehen werden, dass der Beobachtungszeitraum von sieben Jahren (im Mittel drei Jahre) für junge Patienten mit IPS immer noch zu kurz ist, um eine abschließende Bewertung abgeben zu können. Trotzdem ist nach der PD-MED-Studie die Strategie, bei jüngeren Patienten DoA oder MBH vorzuziehen, um die Behandlung mit Levodopa hinauszuzögern, anzuzweifeln. Es besteht also weiter Forschungsbedarf.
Fazit: Levodopa ist das wirksamste Arzneimittel zur Behandlung des idiopathischen Parkinson-Syndroms. Die Strategie, initial mit „Levodopa-sparenden Wirkstoffen“ (Dopamin-Agonisten, MAO-B-Hemmern) zu behandeln, um dem Wirkungsverlust und den motorischen Spätkomplikationen von Levodopa entgegenzuwirken, scheint nach dieser größten Parkinson-Studie keine Vorteile gegenüber einem Therapiebeginn mit Levodopa zu haben. Im Gegenteil: unter Dopamin-Agonisten und MAO-B-Hemmern traten deutlich häufiger Nebenwirkungen auf, und die Therapie musste häufiger modifiziert werden.
Literatur
- S2 Leitlinieder Deutschen Gesellschaft für Neurologie, Link zur Quelle
- PD MedCollaborative Group: Lancet 2014, 384, 1196. Link zur Quelle