Mehr als 1,6 Mrd. Menschen (etwa ein Viertel der Weltbevölkerung) leiden unter einer Anämie (1). Sie ist besonders häufig in Entwicklungs- und Schwellenländern und verantwortlich für knapp 9% der globalen Arbeits- und Berufsunfähigkeit (2). Die Weltgesundheitsorganisation (WHO) schätzt, dass weltweit 42% der Schwangeren, 30% der nichtschwangeren Frauen (im Alter zwischen 15 und 50 Jahren), 47% der Vorschulkinder (im Alter bis zu 5 Jahren) und knapp 13% der Männer im Alter von > 15 Jahren eine Anämie haben. Mit Abstand wichtigste Ursache der Anämie ist ein Eisenmangel (Iron Deficiency Anemia = IDA), der besonders häufig bei Frauen und bei Kindern vor der Schulzeit auftritt.
Trotz ökonomischer Anstrengungen und neuer wissenschaftlicher Erkenntnisse – vor allem die Entdeckung des Hepcidins im Jahre 2001 als entscheidendes, die Eisenhomöostase regulierendes Hormon (4, 5) – ist es bisher nicht gelungen, die Prävalenz der IDA weltweit deutlich zu senken (1). In den letzten Jahren sind zahlreiche Artikel zur IDA erschienen, die sich u.a. mit der Diagnostik und Therapie der ungeklärten IDA beschäftigen und auch die Empfehlungen für die orale Eisensubstitution in Frage stellen (2, 4-7). Diese Artikel waren für uns Anlass, aktuelle Aspekte zur Abklärung der IDA und zur Therapie des Eisenmangels kurz darzustellen.
Physiologie: Die Menge des Körpereisens wird primär durch die intestinale Eisenabsorption aus der Nahrung aufrechterhalten. Normalerweise werden bei gefüllten Eisenspeichern täglich 1-2 mg Eisen aus der Nahrung absorbiert (6, 7). Um die Eisenhomöostase aufrechtzuerhalten, sind jedoch täglich 20-25 mg Eisen erforderlich, u.a. abhängig vom Alter und Geschlecht. Dieser Bedarf wird überwiegend durch das aus alternden Erythrozyten freigesetzte Eisen gedeckt. Das meiste Eisen (ca. 80%) wird für die Bildung von Hämoglobin (Hb) benötigt (8). Auch die Eisenverluste des Organismus variieren mit Geschlecht und Alter. Sie sind besonders bedeutsam bei einem Blutverlust. Aus einem Blutverlust von 1 ml resultiert bei normalem Hb der Verlust von 0,5 mg Eisen. Die physiologischen Verluste von Eisen betragen etwa 1 mg/d und ergeben sich vor allem aus gastrointestinaler und renaler Ausscheidung sowie bei Frauen im reproduktiven Alter durch die Menstruation. 33 ml Blutverlust pro Periode führen zu einem mittleren täglichen Eisenverlust von 1,5 mg. Die Einnahme oraler Kontrazeptiva vermindert, intrauterine Spiralen erhöhen den Eisenverlust (9).
Um eine normale Eisenkonzentration im Plasma aufrechtzuerhalten und die Gewebe mit Eisen zu versorgen, das vor allem über Recycling aus Erythrozyten freigesetzt oder intestinal (Duodenum, oberes Jejunum) resorbiert wurde, bedarf es regulatorischer Mechanismen (4, 5, 9). Eine entscheidende Rolle für die Eisenhomöostase im Gesamtorganismus spielt das in der Leber gebildete Peptidhormon Hepcidin. Es reguliert die duodenale Eisenabsorption, die Freisetzung des Eisens aus Makrophagen nach Phagozytose, den Abbau alternder Erythrozyten sowie die Freisetzung von Speichereisen aus Hepatozyten (4, 5). Dabei werden die Aufnahme, Speicherung und das Recycling von Eisen aus Makrophagen im Sinne eines negativen Feedbacks geregelt: hohe Eisenspiegel fördern die Synthese von Hepcidin in den Hepatozyten, wodurch die Resorption und das Recycling von Eisen gehemmt wird. Aufgrund seiner großen pathophysiologischen Bedeutung für den Eisenstoffwechsel wäre es von großem Nutzen für die Diagnose und Behandlung der IDA, Hepcidin quantitativ zu messen (5). In den letzten Jahren wurden verschiedene Verfahren zur Messung von Hepcidin entwickelt, beispielsweise mittels Massenspektrometrie oder Immunoassays (5). Sie stehen jedoch als Routine in der Klinik noch nicht zur Verfügung.
Ursachen des Eisenmangels: Wenn die Eisenverluste die Aufnahme längere Zeit übersteigen, entsteht ein absoluter Eisenmangel mit leeren Eisenspeichern und niedriger Konzentration von Hepcidin. Die wichtigsten physiologischen und pathologischen Ursachen für diese Situation sind in Tab. 1 aufgeführt. Da der tägliche Eisenbedarf im Wesentlichen durch das Recycling gedeckt wird, ist die Regulation des Austausches zwischen Speichereisen und Funktionseisen im Hämoglobin und in diversen Enzymen von zentraler Bedeutung. Eine Reihe von Erkrankungen kann die Regulation der Eisenhomöostase stören und zu einem funktionellen Eisenmangel mit Anämie führen (s. Tab. 1), d.h. die Eisenspeicher sind voll, die Hepcidinspiegel hoch, aber das blutbildende Knochenmark ist unzureichend mit Eisen versorgt.
Diagnostik bei Verdacht auf Eisenmangel-Anämie: Zur Labordiagnostik bei Verdacht auf Eisenmangel werden in erster Linie folgende Untersuchungen eingesetzt: Biochemische Marker des Eisenstoffwechsels wie Ferritin, löslicher Transferrin-Rezeptor (sTFR), Zinkprotoporphyrin (ZPP), Transferrin-Sättigung (TfS) sowie hämatologische Untersuchungen wie Blutbild, Erythrozytenindices (MCV, MCH, MCHC) und Entzündungsmarker wie CRP (9). Von zentraler Bedeutung zur Diagnose eines Eisenmangels ist das Serumferritin. Ein unter den Grenzwert von 30 µg/l erniedrigtes Serumferritin hat eine hohe Sensitivität (92%) und Spezifität (98%). Ein manifester Eisenmangel liegt vor bei erniedrigter Hämoglobinkonzentration, Mikrozytose (MCV↓) und Hypochromasie (Hbe↓) der Erythrozyten. Ein Problem ergibt sich bei chronischen Entzündungen, denn hierbei kann das Akut-Phase-Protein Ferritin trotz Eisenmangels hoch sein. Deshalb sollte bei einem vermuteten Eisenmangel, aber normalen oder erhöhten Ferritinwerten, zusätzlich der CRP-Wert bestimmt werden. Ist dieser erhöht, ist Ferritin im Serum kein Indikator des Speichereisens, und es sollte der sTfR gemessen werden. Die Konzentration von sTfR wird nicht von Entzündungszuständen im Körper beeinflusst und zeigt bei erhöhten Werten mit einer Sensitivität von 86% und einer Spezifität von 75% einen absoluten Eisenmangel an. Eine sehr genaue Beurteilung der Eisenspeicher kann durch Anfärben des Speichereisens in einem Knochenmarkpunktat erfolgen. Dies wird jedoch in der Regel nur bei Verdacht auf hämatologische Erkrankungen durchgeführt.
Eine ausführliche Darstellung des Eisenstoffwechsels, seiner Störungen, wie beispielsweise bei der IDA, sowie der Aussagekraft biochemischer Marker und hämatologischer Indices des Eisenstoffwechsels findet sich in dem von L. Thomas herausgegebenen Buch „Labor und Diagnose“ (9).
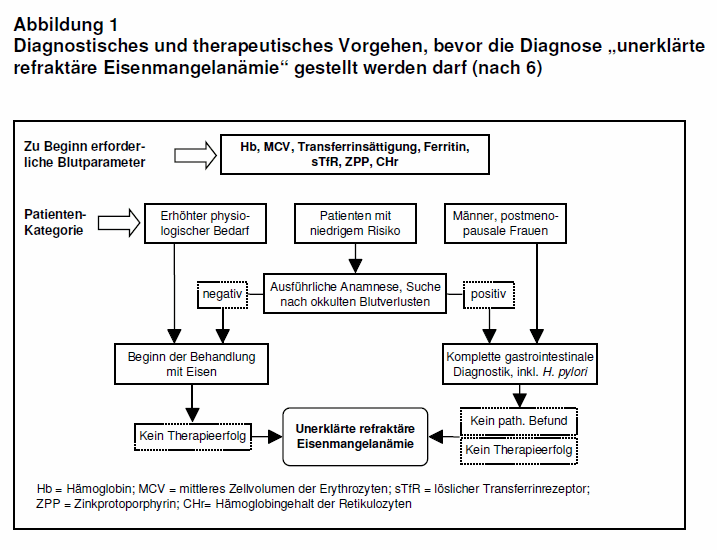
Praktisches Vorgehen: Bei ca. 30% der menstruierenden Mädchen und Frauen besteht ein Eisenmangel. Da dieser Befund einen physiologisch erhöhten Bedarf widerspiegelt und nur selten eine Erkrankung zugrunde liegt, ist es zweckmäßig, bei der Abklärung der Ursachen für einen Eisenmangel differenziert vorzugehen. Die British Society of Gastroenterology empfiehlt in ihren Leitlinien folgendes Vorgehen (10):
- Männer und postmenopausale Frauen
Besteht kein offensichtlicher Blutverlust, wie z.B. Blutspenden oder Zustand nach Operation, sollte eine Magen- und Darmspiegelung durchgeführt werden. Bei unauffälligen Untersuchungsbefunden kann mit einer oralen Eisentherapie begonnen werden. Unter dieser Therapie sollte der Hb-Wert um 0,1 g/dl pro Tag steigen, d.h. nach drei Wochen um ca. 2 g/dl (8). Ist das Ergebnis unzureichend (Definition der Refraktärität: kein adäquater Anstieg des Hb-Werts nach oraler Einnahme von 100 mg Eisen über 4-6 Wochen; 6), sollten im nächsten Schritt die Ursachen für eine therapierefraktäre IDA abgeklärt werden (s.u. und Abb. 1).
- Prämenopausale Frauen
Ist die Anamnese unter Berücksichtigung von Erkrankungen des Gastrointestinaltrakts oder einer B-Symptomatik (unerklärtes Fieber, massiver Nachtschweiß, ungewollter Gewichtsverlust) unauffällig, kann direkt mit einer oralen Eisentherapie begonnen werden. Bei Refraktärität (s.o.) wird eine Magen- und Darmspiegelung empfohlen. Sind diese unauffällig, wird eine weitere Abklärung der therapierefraktären IDA empfohlen (s. Abb. 1).
Als häufigste Ursachen einer unerklärten, therapierefraktären IDA (s.a. Abb. 1) wurden in einer Studie mit 300 Patienten eine Menorrhagie (32%), eine autoimmune, atrophische Gastritis (26%), eine Helicobacter-pylori-Infektion (55%, bei 19% als alleinige Ursache), gastrointestinale Läsionen (10%), eine Zöliakie (5%) oder eine hereditäre mikrozytäre IDA identifiziert (6, 11). Insbesondere bei Patienten mit Zöliakie (100%), einer Typ-A-Gastritis (69%) oder einer Besiedlung mit Helicobacter pylori (68%) war die orale Eisentherapie oft erfolglos. Auch die lang dauernde Einnahme eines Protonenpumpenhemmers muss als Ursache für einen ausbleibenden Therapieerfolg der oralen Eisensubstitution bedacht werden, denn die Eisenresorption ist von einem sauren Milieu abhängig (vgl. 19).
Therapie des Eisenmangels: Verbesserung der Eisenzufuhr durch Optimierung der Ernährung: Der durchschnittliche Eisengehalt einiger eisenreicher tierischer und pflanzlicher Nahrungsmittel ist in Tab. 2 aufgelistet (12). Das zweiwertige Häm-Eisen (Fe2+) aus tierischen Nahrungsmitteln hat eine höhere Bioverfügbarkeit (15-40%) als das dreiwertige Nicht-Häm-Eisen (Fe3+) aus Pflanzen (1-15%). Die Aufnahme von pflanzlichem Fe2+ wird gefördert durch Vitamin-C-haltige Nahrungsmittel und gehemmt beispielsweise durch Kalzium und Phytate (sie sind Bestandteil von Getreide, Gemüse, Linsen und Nüssen) sowie durch Polyphenole (enthalten in Cerealien, Hülsenfrüchten, Tee, Kaffee, Rotwein).
Bei veganer Kost sind die Eisenspeicher und der Hämoglobingehalt in der Regel niedriger als bei „omnivorer“ Mischkost, doch die Prävalenz einer Anämie ist nicht erhöht. Bei Veganer(inne)n mit einem Risiko für einen Eisenmangel, z.B. prämenopausale Frauen, kann das Ferritin im Serum einen latenten Eisenmangel aufdecken. Durch eine geeignete Auswahl, Zubereitung und Kombination der Speisen lässt sich die Eisenaufnahme optimieren (13).
Orale Eisenpräparate: Die orale Substitution von Eisen ist im Allgemeinen die First-line-Therapie. Sie ist kostengünstig und gut verfügbar. In aller Regel wird zweiwertiges Eisen substituiert. Es sind verschiedene Arzneimittel auf dem Markt als Tabletten, Kapseln oder Sirup. Der Gehalt an elementarem Eisen ist sehr unterschiedlich (z.B. zwischen 30 und 325 mg pro Tablette), und es gibt eine Reihe von Beistoffen, die die Resorption erhöhen sollen, einschließlich Ascorbinsäure.
Empfohlen werden 2-4 mg/kg zweiwertiges Eisen in 2-3 Tagesdosen (nüchtern einzunehmen, nicht mit Milch, Tee oder Kaffee). Bei Erwachsenen würde man beispielsweise mit 80-100 mg elementarem Eisen in zwei Tagesdosen beginnen und bei guter Verträglichkeit auf 200 mg ab der zweiten Therapiewoche steigern. Häufigere Einnahme und zu hohe Dosen vermindern möglicherweise die Eisenresorption (2, 8) und erhöhen die Rate von Nebenwirkungen. Eine kürzlich publizierte Untersuchung bei jungen Frauen mit Eisenmangel zum Zusammenhang zwischen Eisensubstitution und Anstieg des Hepcidins lässt vermuten, dass niedrige Dosen (40-80 mg) einmal täglich oder eine alternierende Einnahme von Eisen jeden 2. Tag zu einem besseren Therapieansprechen führen können (2, 8). Die Behandlung dauert meist mindestens drei Monate und sollte die Werte von Hb, MCV und Serumferritin normalisieren. Steigt der Hb-Wert nicht an, sollte die Therapieadhärenz überprüft und auch nach Ursachen der unerklärten, therapierefraktären IDA gesucht werden (vgl. Abb. 1). Eine Komedikation mit L-Dopa, Tetrazyklinen oder Gyrasehemmern kann durch Komplexbildung die Wirkung der Eisensubstitution abschwächen.
Die hohe Rate an Nebenwirkungen von 30-70% (epigastrische Schmerzen, Übelkeit, Diarrhö, Obstipation) lässt sich senken, wenn die Eisenpräparate zu den Mahlzeiten eingenommen werden. Dies führt aber meist zu einer geringeren Resorption. Auch eine Reduktion der Dosis kann die Verträglichkeit bessern (10). Ein Wechsel auf ein anderes Präparat ist wahrscheinlich nicht sinnvoll, denn alle verursachen ähnlich häufig Nebenwirkungen.
Die Eisensubstitution sollte über 3-6 Monate erfolgen bzw. bis die Anämie behoben ist. Die Patienten müssen auf die möglichen Neben- und Wechselwirkungen und auf die zu erwartende schwarze Verfärbung des Stuhls hingewiesen werden. Kontraindikation für eine orale Eisentherapie sind chronisch entzündliche Darmerkrankungen.
Intravenöse Eisenpräparate: Eine Indikation zur parenteralen Eisentherapie ist gegeben, wenn:
- die orale Therapie nicht ausreichend wirksam oder unverträglich ist,
- die körpereigenen Speicher schnell aufgefüllt werden müssen (z.B. präoperativ im Rahmen des „Patientenblut-Managements“; 14),
- eine Indikation zur Bluttransfusion besteht, aber diese aus religiösen Gründen nicht gestattet wird,
- die Eisenverluste die Resorptionskapazität übersteigen (z.B. bei Dialysepatienten oder bei Hämolyse),
- entzündliche Darmerkrankungen oder andere Formen der Malabsorption bestehen (6, 9).
Bei diesen Patienten kann die i.v. Applikation medizinisch sinnvoll und auch kosteneffektiv sein, falls wiederholte Bluttransfusionen dadurch vermieden werden.
In den Infusionslösungen ist das Eisensalz von einem Kohlenhydratmantel umgeben, von dessen Struktur es abhängt, wie schnell das Eisen im Körper freigesetzt wird. Die Galenik bestimmt auch, wie viel Eisen als Einzeldosis gegeben werden kann, ohne toxisch zu wirken. Es gibt mindestens sechs verschiedene Wirkstoffzubereitungen, die sich im Wesentlichen in ihren Bindungspartnern unterscheiden. Eisenglukonat (Ferrlecit®) gibt das Eisen beispielsweise sehr zügig ab. Daher sollten maximal 62,5 mg elementares Eisen auf einmal gegeben werden. Eisencarboxymaltose (Ferinjekt®) dagegen stellt das infundierte Eisen langsamer zur Verfügung. Daher kann das Eisen in Einzeldosen bis zu 1 g appliziert werden. Die Infusionsdauer beträgt je nach Präparat bis zu einer Stunde. Eine intramuskuläre Eiseninjektion wird nicht empfohlen, denn sie ist schmerzhaft, die Resorption unsicher, und es gibt Berichte über eine Assoziation mit Sarkomen.
Die i.v. Eisentherapie birgt die Gefahr von anaphylaktischen Reaktionen. Diese waren bei den früher gebräuchlichen hochmolekularen Eisendextran-Verbindungen häufiger. Die Sicherheit der zurzeit erhältlichen parenteralen Eisenpräparate (s. Tab. 3) wurde von der Europäischen Arzneimittel-Agentur (EMA) 2013 umfassend untersucht (15). Für niedrigmolekulares Eisendextran zeigten klinische Studien nach der Zulassung (Postmarketing-Untersuchungen) eine Häufigkeit von 1,4 lebensgefährlichen allergischen Reaktionen pro 100.000 applizierten Dosen und bei Eisenderisomaltose von 0,8 pro 100.000 Anwendungen. Bei Eisenglukonat hatte der Hersteller bis Ende 2011 Kenntnis von insgesamt 420 lebensbedrohlichen und sechs tödlich verlaufenden Anaphylaxien. Unter Eisencarboxymaltose traten in den publizierten Studien 50 und in Postmarketing-Untersuchungen acht lebensbedrohliche allergische Reaktionen pro 100.000 Infusionen auf sowie ein Todesfall bis Dezember 2011. Bei Eisensaccharose (= Eisensucrose) kam es in den klinischen Studien zu 120 lebensbedrohlichen allergischen Reaktionen pro 100.000 Infusionen.
Neuere Berichte aus Europa und Nordamerika zur Erfassung von Nebenwirkungen nach i.v. Eisensubstitution gehen von 38 schwerwiegenden, lebensbedrohlichen Reaktionen pro eine Million verabreichter Dosen aus und zeigen ein deutlich höheres (etwa 17fach) Risiko für anaphylaktische Reaktion nach Eisendextran i.v. im Vergleich zu Eisensucrose i.v. (6).
Wegen der Möglichkeit einer Anaphylaxie dürfen Eiseninfusionen ausschließlich in Einrichtungen gegeben werden, in denen die personellen und instrumentellen Möglichkeiten zur Reanimation gegeben sind. Die Infusion einer Testdosis ist obsolet, da auch bei unauffälligem Test anaphylaktische Reaktionen aufgetreten sind und ein solches Testergebnis in falscher Sicherheit wiegt. Die Patienten sollten während der Infusion und mindestens noch eine halbe Stunde nach Infusionsende beobachtet werden. Patienten mit einer Allergieneigung und Schwangere im ersten Trimenon sollten möglichst keine Eiseninfusion erhalten (16).
Neben allergischen Reaktionen treten gelegentlich Übelkeit, Juckreiz sowie Kopf-, Brust-, Gelenk- und Muskelschmerzen auf. Eine langsame Injektion senkt die Nebenwirkungsquote. Rheumatische Erkrankungen neigen zur Exazerbation nach parenteraler Eisentherapie. Bemerkenswert ist auch eine erhöhte Infektionsrate nach i.v. Eiseninjektionen im Vergleich zur oralen Einnahme (Relatives Risiko: 1,33; 95%-Konfidenzintervall: 1,10-1,64; 17). Dies wird auf Interaktionen mit dem Hepcidin-Metabolismus zurückgeführt (5).
Transfusion von Erythrozytenkonzentraten: Durch Infusion eines Erythrozytenkonzentrats werden ca. 200 mg Eisen zugeführt (18). Eine Transfusion ist bei Eisenmangelanämien nur dann angezeigt, wenn die Korrektur der Anämie umgehend erfolgen muss.
Literatur
- Pasricha,S.-R., et al.: Blood 2013, 121, 2607. Link zur Quelle
- Moretti, D., et al.:Blood 2015, 126, 1981. Link zur Quelle
- World Health Organization/UNICEF/UNU. Iron Deficiency Anaemia: Assessment, Prevention, and Control. AGuide for Programme Managers.Geneva, Switzerland: World Health Organization;2001. Link zur Quelle
- Ganz, T.: Blood2011, 117, 4425. Link zur Quelle
- Girelli,D., et al.: Blood 2016, 127, 2809. Link zur Quelle
- Hershko,C., und Camaschella, C.: Blood 2014, 123, 326. Link zur Quelle
- Camaschella, C.:N. Engl. J. Med. 2015, 372, 1832. Link zur Quelle
- Schrier, S.L.:Blood 2015, 126, 1971. Link zur Quelle
- Thomas, L.(Hrsg.): Labor und Diagnose, 8. Auflage, TH-Books Verlagsgesellschaft mbH,Frankfurt/Main 2012.
- Goddard, A.F., et al.: Gut 2011, 60,1309. Link zur Quelle
- Hershko, C., et al.: Haematologica2005, 90, 585. Link zur Quelle
- National Institutes of Health, 2015,Iron, Dietary Supplement Fact Sheet. Link zur Quelle
- Hunt, J.R.: Am. J. Clin. Nutr. 2003, 78 (3. Suppl.), 633S. Link zur Quelle
- www.patientbloodmanagement.de Link zur Quelle
- European Medicines Agency.Assessment report for: Iron containing intravenous (IV) medicinal products.2013. Procedure number: EMEA/H/A-31/1322. Link zur Quelle
- Rampton, D., et al.: Haematologica2014, 99, 1671. Link zur Quelle
- Litton, E., et al.: BMJ 2013, 347,f4822. Link zur Quelle
- Goodnough, L.T., et al.: Lancet2013, 381, 1845. Link zur Quelle
- AMB 2008, 42, 49. Link zur Quelle