Eisenmangel („Iron Deficiency Anemia“ = IDA) und Aktivierung des Immunsystems („Anemia of Inflammation“ = AI bzw. „Anemia of Chronic Disease“ = ACD) gelten heute als häufigste Ursachen der Anämie infolge einer Störung der Eisenhomöostase [1], [2], [3], [4], [5], [6]. Die IDA beruht auf einer Verminderung des Gesamtkörpereisens, meist als Folge von Blutverlust, unzureichender alimentärer Zufuhr oder intestinaler Absorption bzw. erhöhtem Bedarf an Eisen [2]. Demgegenüber führt die Aktivierung des Immunsystems – beispielsweise infolge chronischer Entzündungen (ACD) – bei meist normalem oder sogar erhöhtem Gesamtkörpereisen zur Umverteilung des Eisens vom erythropoetischen Knochenmark in das mononukleäre Phagozytensystem der Leber und Milz, den Hauptorganen der Eisenspeicherung [1], [3], [4]. Eine wichtige Bedeutung hierfür haben sowohl die durch Entzündung induzierten Zytokine als auch das Eisen-regulierende Hormon Hepcidin, das heute häufig auch als „master regulator of iron homeostasis“ bezeichnet wird [3]. Darüber hinaus ist das Membrantransport-Protein (Ferroportin = FPN) sehr wichtig für die Regulierung der Eisenhomöostase, da es eine „Gatekeeper“-Funktion in der basolateralen Membran von Epithelzellen (z.B. Duodenalzellen und Hepatozyten) sowie Makrophagen ausübt. FPN bindet Fe2+ und transportiert es in die Blutbahn. Bei Entzündungsprozessen ist die Expression von FPN vermindert, u.a. infolge von proinflammatorisch wirkenden Zytokinen sowie bakteriellen Bestandteilen in Makrophagen und Hepatozyten [4].
Die bei AI bzw. ACD auftretende Anämie resultiert somit aus einer unzureichenden Verfügbarkeit von Eisen, obwohl der Eisengehalt des Organismus normal oder sogar erhöht ist [4], [5]. Für wichtige Funktionen, wie beispielsweise die Erythropoese im Knochenmark zur Bildung von Hämoglobin (Hb), die Bildung von Myoglobin in den Muskelzellen und in den Enzymen, die in den Mitochondrien für die Energiegewinnung verantwortlich sind, steht Eisen dann nicht ausreichend zur Verfügung, da es bei ACD bzw. AI in Makrophagen des retikuloendothelialen Systems und in Hepatozyten sequestriert wird. Daraus resultiert, ähnlich wie beim nutritiven Eisenmangel, eine Anämie mit Verminderung der Leistungsfähigkeit bzw. Lebensqualität [4], [5]. Zu den chronischen Erkrankungen mit Entzündungen (ACD bzw. AI) und verminderter Bildung von Erythropoetin zählen vor allem Infektionen, Autoimmunerkrankungen, fortgeschrittene (meist) metastasierte solide Tumoren, chronische Nierenerkrankungen, mitunter aber auch Diabetes mellitus, Hypertonie und chronisch verlaufende kardiale Erkrankungen [4], [5].
In Blood, der medizinischen Fachzeitschrift der „American Society of Hematology“, sind 2019 und im November 2022 interessante Übersichtsartikel zur Bedeutung des Eisens bei AI erschienen, einer häufigen Komorbidität bei Patienten mit ACD [3], [4]. Entsprechend einem aktuellen Bericht der WHO haben 24,8% der Weltbevölkerung eine Anämie, die meist durch Unter- oder Fehlernährung verursacht wird. Eine vor allem durch chronische Entzündungen ausgelöste Anämie gilt heute bereits als die zweithäufigste Ursache der Anämie, wobei die aktuelle Prävalenz aufgrund der meist gleichzeitig bestehenden IDA schwer zu ermitteln ist [4].
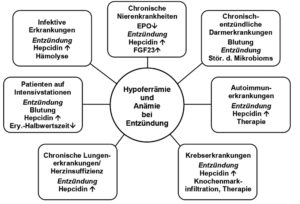
Schwerpunktmäßig beschäftigt sich die 2019 in Blood publizierte Übersichtsarbeit mit den pathophysiologischen Mechanismen der ACD und beschreibt anhand einer sehr informativen Abbildung (s. Abb. 1) die durch systemische Entzündungsprozesse ausgelöste Aktivierung von Zellen des Immunsystems mit Synthese zahlreicher Zytokine [4].
Abbildung 1
Wichtigste pathophysiologische Mechanismen, die bei verschiedenen Erkrankungen zur Hypoferrämie und Anämie führen (mod. nach 4)
Dabei fungieren vor allem Interleukin-6 (IL-6) und IL-1beta ebenso wie Lipopolysaccharide als potenzielle Induktoren der Synthese von Hepcidin in der Leber. Demgegenüber wird die Expression von Transferrin – dem ebenfalls in der Leber gebildeten Glykoprotein zum Transport von Eisen im Blut – reduziert. Ausführlich werden auch die potenziellen Modifikatoren hinsichtlich des Schweregrads der ACD besprochen. Hierzu zählen beispielsweise ein Mangel an Vitaminen, die zu einer verminderten Erythropoese sowie Hämolyse (Cobalamin, Folsäure) führen bzw. zu einer verstärkten Bildung von Hepcidin und Eisenretention (Vitamin D). Der aktuelle Übersichtsartikel in Blood beschreibt ebenfalls die multifaktorielle Pathophysiologie der AI und geht dabei ausführlicher ein auf molekulare Mechanismen, die zur Dysregulation im Eisenstoffwechsel führen [4]. Zudem werden neuere medikamentöse Therapieansätze diskutiert, die aufgrund des besseren Verständnisses der pathophysiologischen Grundlagen der AI entwickelt werden konnten und derzeit in klinischen Studien der Phasen I-III hinsichtlich ihrer Wirksamkeit und Sicherheit geprüft werden [4].
Die aufgrund des Eisenmangels bei IDA bzw. der schlechten Verfügbarkeit des Eisens bei AI verminderte Erythropoese spielt pathophysiologisch eine wichtige Rolle, doch kann die Differenzialdiagnose bei gleichzeitigem Bestehen von IDA und AI schwierig sein. Entsprechend der WHO ist eine Anämie bei Frauen definiert als Hämoglobin (Hb)-Wert < 120 g/l (bzw. bei Schwangeren < 110 g/l) und bei Männern < 130 g/l [4]. Die Nützlichkeit dieser Definition wird jedoch eingeschränkt durch die Abhängigkeit des Hb-Werts von zahlreichen anderen Parametern wie Alter, sozioökonomischem Status, Ethnie oder Höhe des Wohnorts. Während die AI vor allem resultiert aus der Retention von Eisen in Makrophagen und deutlich weniger aus einer verminderten Resorption aus der Nahrung, ist für den absoluten Eisenmangel bei IDA das Ungleichgewicht zwischen Eisenaufnahme aus der Nahrung, Eisenverwertung und Eisenverlust verantwortlich [3], [4].
Bei Patienten mit AI findet sich eine erniedrigte Transferrin-Sättigung sowie normale oder verminderte Transferrin-Werte, wohingegen Patienten mit IDA erhöhte Transferrin-Werte haben [2], [3], [4], [5], [6]. Ferritin-Werte sind bei Patienten mit IDA vermindert und bei Patienten mit AI bzw. ACD erhöht infolge der Akkumulation des Eisens in den Makrophagen, ebenso wie die Entzündungsparameter (z.B. Interleukin-6 und C-reaktives Protein; [2], [3], [4], [5], [6]).
Als derzeit beste Therapieoption der AI bzw. ACD gilt die wirksame Behandlung der Grunderkrankung mit Rückbildung der Entzündung. Darüber hinaus gibt es prinzipiell 3 Therapieoptionen [4]: Transfusion von Erythrozyten, Supplementierung von Eisen und Gabe von Erythropoese-stimulierenden Wirkstoffen (z.B. Erythropoetin); diese stimulieren die Bildung von Erythrozyten im Knochenmark und wirken den antiproliferativen Wirkungen proinflammatorischer Zytokine entgegen. Häufig sind diese Therapien jedoch nicht ausreichend wirksam, vor allem bei Patienten mit weit fortgeschrittenen Entzündungsprozessen und funktionellem Eisenmangel; darüber hinaus können sie bedeutsame Nebenwirkungen auslösen [4]. Deshalb werden derzeit präklinisch und in den Phasen I-III klinischer Studien auch neue medikamentöse Therapiestrategien überprüft. Sie sollen die Entzündungsprozesse aufgrund des besseren Verständnisses der Pathophysiologie von AI bzw. ACD gezielter hemmen, dabei vor allem die Konzentration von Hepcidin im Plasma senken und dadurch die Eisenmobilisierung verstärken.
Bei diesen neuen medikamentösen Therapien handelt es sich vor allem um Antikörper und kleine Moleküle wie das im Jahre 2021 für Erwachsene von der Europäischen Arzneimittel-Agentur (EMA) zugelassene Roxadustat zur Behandlung der Symptome einer Anämie, die durch chronische Niereninsuffizienz verursacht wird [7], [8], [9]. Roxadustat, ein kleines Molekül („small molecule“) hemmt eine Untereinheit des Hypoxie-induzierbaren Faktors (HIF), die HIF-Prolylhydroxylase (PHD), und ahmt dadurch die physiologischen Wirkungen einer Hypoxie nach. Daraus resultiert eine Stimulation der Expression von Genen der Erythropoese [8]. Roxadustat wurde bisher in insgesamt 8 Phase-III-Studien an Patienten mit renaler Anämie, darunter auch Dialysepatienten, untersucht. Diese klinischen Studien ergaben im Vergleich mit Erythropoetin jedoch nur eine therapeutische Gleichwertigkeit [7], [8]). Roxadustat besitzt zahlreiche unerwünschte Wirkungen, wobei es hinsichtlich thromboembolischer Komplikationen mit Erythropoetin vergleichbar war ([7], [8], [9]. Ein Zusatznutzen von Roxadustat bei Patienten mit symptomatischer Anämie bei chronischer Nierenerkrankung ohne oder nach Vorbehandlung mit einem Erythropoese-stimulierenden Wirkstoff ist jedoch nicht belegt [10]. Aussagekräftige Ergebnisse aus klinischen Studien bei Patienten mit anderen Ursachen für eine AI liegen bisher nicht vor.
Darüber hinaus zugelassen sind derzeit von der EMA und der US-amerikanischen Food and Drug Administration (FDA) nur zwei monoklonale Antikörper: Infliximab und Tocilizumab ([4]). Für die beiden monoklonalen Antikörper (Infliximab bei Morbus Crohn bzw. Colitis ulcerosa, Zielstruktur: TNF alpha sowie Tocilizumab bei rheumatoider Arthritis, Zielstruktur: IL-6-Rezeptor) konnten bereits günstige Effekte auf entzündliche Prozesse bei AI in klinischen Studien der Phase III gezeigt werden. Unter der Therapie mit diesen monoklonalen Antikörpern sank die Konzentration von Hepcidin im Blut, und das Serumeisen, Hämoglobin sowie die Erythrozytenzahl stiegen an [4].