Zusammenfassung: Kopfschmerz sollte nach den Kriterien der Internationalen Kopfschmerzgesellschaft (IHS) differentialdiagnostisch abgeklärt werden. Migräne ist nach Spannungskopfschmerzen die häufigste Kopfschmerzdiagnose und auch ihr häufigstes neurologisches Symptom. Der Verlauf ist in der Regel episodisch, seltener chronisch. Bei der akuten Migräneattacke wirken nichtsteroidale Antirheumatika manchmal unzureichend, so dass ein Triptan erforderlich wird. Zur medikamentösen Prophylaxe der Migräne stehen mehrere Stoffe mit gleichwertiger Evidenz für ihre Wirksamkeit zur Verfügung (s. Tab. 1 und 2). Aus einer Migräne oder einem Spannungskopfschmerz kann sich ein Kopfschmerz durch zu häufigen Gebrauch von Medikamenten entwickeln, der durch Analgetikaentzug behandelt werden sollte.
Einleitung: Die Internationale Klassifikation von Kopfschmerzerkrankungen (ICHD) teilt Kopfschmerzen in die großen Gruppen der primären und sekundären Kopfschmerzen ein und listet mehrere Dutzend verschiedener Kopfschmerzsyndrome auf (1). Mit Abstand am häufigsten sind zwei Diagnosen aus der Gruppe der primären Kopfschmerzen: Spannungskopfschmerz (Prävalenz: 60%) und Migräne (Prävalenz: etwa 15%; 2). Aus diesen beiden Kopfschmerzsyndromen kann sich (zusätzlich) ein Kopfschmerz durch zu häufigen Gebrauch von Medikamenten entwickeln. Eine zerebrale Bildgebung sollte bei atypischer Symptomatik und bei Auffälligkeiten in der neurologischen Untersuchung erfolgen. Zur Behandlung und Prophylaxe der Migräne können neben der Pharmakotherapie auch diverse nicht-medikamentöse Verfahren sinnvoll sein, zum Beispiel Entspannungstechniken, Ausdauertraining, Verhaltenstherapie, Umstellung der Ernährung und regelmäßige, ausreichende Schlafphasen (vgl. 31).
Die Pathomechanismen der Migräne sind nicht abschließend geklärt. Mehrere Neurotransmitter und Neuromodulatoren werden bei Attacken vermehrt ausgeschüttet und können auch nach Applikation Attacken auslösen (32), darunter Calcitonin gen-related peptide (CGRP; 33) und Pituitary adenylate cyclase-activating peptide (PACAP; 34).
Diagnose der Migräne: Die Diagnose stützt sich auf die Anamnese häufig halbseitiger und pulsierender Kopfschmerzen, die bei körperlicher Belastung zunehmen und typischerweise mit Übelkeit, Licht- und Geräuschempfindlichkeit assoziiert sind (1). Die Dauer der Episoden beträgt meist 4-72 Stunden. Bei etwa einem Drittel der Migränepatienten lässt sich eine Aura eruieren, die meist die Kopfschmerzphase einleitet. Die häufigste Aura ist das Flimmerskotom; es breitet sich langsam über das Gesichtsfeld aus und dauert 5-60 Minuten. Die chronische Migräne ist eine besonders schwere Variante mit Kopfschmerzen an mindestens 15 Tagen pro Monat über einen Zeitraum von mindestens drei Monaten. An mindestens 8 Tagen muss der Kopfschmerz die Kriterien einer Migräne erfüllen oder auf eine Therapie mit Triptanen ansprechen (1). Die chronische Migräne entwickelt sich meist langsam aus einem episodischen Verlaufstyp; ein wichtiger Risikofaktor hierfür ist ein zu häufiger Gebrauch von Schmerzmitteln. Spannungskopfschmerz kann von Migräne abgegrenzt werden durch dumpf-drückende und bifrontale oder holozephale Kopfschmerzen meist geringerer Intensität sowie allenfalls sehr gering ausgeprägte Begleitsymptome (Übelkeit, Licht- und Geräuschempfindlichkeit).
Medikamentöse Akuttherapie: Prinzipiell gilt: Je früher ein Medikament bei einer Migräneattacke eingenommen wird, umso besser wirkt es.
Analgetika und nichtsteroidale Antirheumatika: Attacken leichter bis mäßiger Intensität können mit Azetylsalizylsäure (1.000 mg als Brausetablette), Paracetamol (1.000 mg als Tablette oder Suppositorium) oder einem nichtsteroidalen Antirheumatikum (NSAID; z.B. Ibuprofen 400 bis 600 mg als Tablette oder Suppositorium) behandelt werden. Analgetika, die zusätzlich Coffein enthalten, sind wirksamer als Monopräparate. Sie erhöhen aber vermutlich das Risiko eines sekundären Kopfschmerzes durch zu häufigen Gebrauch und sollten daher vermieden werden, wenn ein Monopräparat ausreichend wirkt. Die Zugabe von Metoclopramid zu einem Analgetikum bzw. NSAID ist wirksam gegen Übelkeit und Erbrechen (3). Häufige Fehler sind eine unzureichende Dosierung der Analgetika sowie eine orale Applikation bei Übelkeit und Erbrechen. Bei Erbrechen sollten Analgetika als Suppositorien eingenommen werden.
Ergotamine: Vor der Einführung der Triptane waren Ergotamine und Dihydroergotamin Mittel der Wahl bei starken Migränekopfschmerzen. Sie sind jedoch den Triptanen hinsichtlich Wirksamkeit und Nebenwirkungen unterlegen und werden daher kaum noch eingesetzt (4, 5). Dihydroergotamin, das im Vergleich zu Ergotamin weniger Übelkeit und Vasokonstriktion verursacht, ist in Deutschland nicht mehr auf dem Markt.
Triptane: Bei schweren Migräneattacken ist eine Behandlung mit einem Triptan zurzeit Standard (s. Tab. 1). Triptane sind selektive 5-HT1B/1D-Agonisten. Sie sind unspezifischen Analgetika und Ergotamin-Präparaten hinsichtlich der Wirksamkeit bei Migräne überlegen (4). Triptane können auch bei Cluster-Kopfschmerz eingesetzt werden. Bei Spannungskopfschmerzen sind sie dagegen in der Regel wirkungslos.
Aktuell sind sieben Triptane verfügbar, die sich hinsichtlich ihrer Wirklatenz, Wirkstärke und Wirkdauer unterscheiden. Die stärker wirksamen Triptane sind in der Regel auch mit stärkeren Nebenwirkungen behaftet. Häufige Nebenwirkungen der Triptane sind Übelkeit, Schwindel, Parästhesien und Müdigkeit. Im Vergleich zu Sumatriptan, dem ersten verfügbaren Triptan, ist bei oraler Applikation Eletriptan wirksamer und Naratriptan und Frovatriptan etwas weniger wirksam (4, 6, 7). Naratriptan und Frovatriptan haben das günstigste Nebenwirkungsprofil, aber auch die längste Latenz bis zum Eintritt der Wirkung. Frovatriptan hat die längste Halbwertszeit und kann dann indiziert sein, wenn Wiederkehr-Kopfschmerzen nach primärem Ansprechen häufig auftreten.
Zwei Stunden nach oraler Einnahme eines Triptans sind Migränekopfschmerzen in ca. 70% deutlich gemildert und in ca. 30% vollständig beseitigt. Bei etwa 30% der Patienten treten die Kopfschmerzen innerhalb von 24 Stunden nach initialer Rückbildung wieder auf. Falls ein Triptan nach mehrfacher Einnahme nicht wirkt, ist ein Wechsel auf ein anderes durchaus sinnvoll. Ist die Wirkung verschiedener Triptane bei oraler Applikation unzureichend, kann eine parenterale Anwendung die Wirksamkeit verbessern. Der schnellste Wirkeintritt und die höchste Wirksamkeit ist für die subkutane Applikation von Sumatriptan belegt; die Wirkung setzt nach etwa 10 Minuten ein (8). Nachteile dieser Applikationsform sind vermehrt Nebenwirkungen und deutlich höhere Kosten. Alternativ kann ein Triptan oral mit ASS oder einem NSAID kombiniert werden. Die Kombinationen sind wirksamer als die jeweilige Monotherapie (4). Bei Migräne mit frühem Auftreten von Übelkeit und Erbrechen empfiehlt sich eine Applikation der Triptane als Nasenspray, Suppositorium oder subkutan. Je früher ein Triptan appliziert wird, umso besser wirkt es. Um aber einem sekundären Kopfschmerz durch Analgetikagebrauch vorzubeugen, sollten Triptane erst dann eingenommen werden, wenn der Patient den Kopfschmerz auch sicher als Migräneattacke identifizieren kann.
Bei Migräne mit Aura wird die Behandlung mit einem Triptan erst nach der Auraphase empfohlen. Bei Triptanen gibt es einen fast linearen Zusammenhang zwischen der Einnahmehäufigkeit und dem Risiko der Entwicklung eines chronischen Kopfschmerzes (9). Daher ist bei einer hohen Frequenz von Migräneattacken eine prophylaktische Therapie sinnvoll.
Triptane können zu einer Konstriktion zerebraler und koronarer Gefäße führen. Die Kontraindikationen betreffen daher gemäß der Fachinformation überwiegend vaskuläre Erkrankungen wie die Koronare Herzkrankheit, Schlaganfälle in der Vorgeschichte und eine unkontrollierte arterielle Hypertonie. Beobachtungsstudien suggerieren, dass das kardiovaskuläre Risiko der Triptane aber eher gering ist (10).
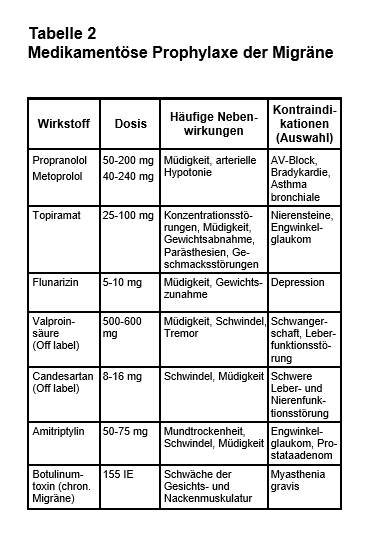
Medikamentöse Prophylaxe der Migräne (vgl. Tab. 2): Ziel einer medikamentösen Prophylaxe ist es, die Häufigkeit und Schwere der Attacken um mindestens 50% zu reduzieren. Eine vollständige Unterdrückung der Migräne ist meist nicht zu erreichen. Die Indikation für eine medikamentöse Prophylaxe ist individuell zu stellen; dabei sollten realistische Therapieziele und potenzielle Nebenwirkungen der Medikation gegeneinander abgewogen werden. Punkte, die für eine Prophylaxe sprechen, sind hoher Leidensdruck, mindestens drei Attacken pro Monat mit deutlicher Beeinträchtigung der Lebensqualität oder eine Einnahme von Analgetika an ≥ 10 Tagen pro Monat. Die Wirkung einer Prophylaxe sollte nach drei Monaten anhand eines Kopfschmerzkalenders beurteilt werden, der im Idealfall bereits vor Beginn der medikamentösen Prophylaxe begonnen wird. Wenn sich ein Migränemittel bei einem Patienten als unwirksam herausgestellt hat, ist ein Wechsel auf ein anderes Präparat sinnvoll. Für eine bessere Wirksamkeit der Kombinationen von Migräneprophylaktika gibt es keine Evidenz.
Generell ist davon auszugehen, dass in der Prophylaxe der Migräne, wie auch bei anderen Arten des Kopfschmerzes, Plazebowirkungen eine große Rolle spielen (27-29; vgl. 30).
Alle Migräneprophylaktika wurden initial für andere Indikationen entwickelt, und nicht alle wirksamen Arzneimittel sind für die Migräneprophylaxe zugelassen. Es empfiehlt sich, zunächst eines der für diese Indikation zugelassenen Arzneimittel zu verwenden: Metoprolol, Propranolol, Flunarizin oder Topiramat. Auch die Wirksamkeit von Amitriptylin und Valproinsäure wurde in mehreren kontrollierten Studien nachgewiesen (11). Valproinsäure ist off label verordnungsfähig, wenn eine Behandlung mit anderen zugelassenen Arzneimitteln nicht wirksam war oder kontraindiziert ist. Es sollte aber bei Frauen im gebärfähigen Alter wegen Teratogenität nicht eingesetzt werden. Amitriptylin ist besonders dann sinnvoll, wenn zusätzlich ein Spannungskopfschmerz oder eine Depression besteht. Kürzlich hat sich auch Candesartan in zwei kontrollierten Studien als wirksam erwiesen (12). Bei Betablockern ist zu beachten, dass Substanzen mit intrinsischer sympathomimetischer Aktivität (z.B. Pindolol und Acebutolol) in der Migräneprophylaxe nicht wirksam sind (13). Bei Arzneistoffen mit nachgewiesener Wirksamkeit wurde in einer Metaanalyse über eine NNT („number needed to treat“) von etwa 7 berichtet, um eine Reduktion von Kopfschmerzen um mindestens 50% zu erreichen (14). Kein Wirkstoff hat einen nachgewiesenen Vorteil hinsichtlich der Wirksamkeit. Die Wahl orientiert sich vielmehr an den potenziellen Nebenwirkungen. Sie sollte auf ein Medikament fallen, dessen typische Nebenwirkungen für den individuellen Patienten akzeptabel sind oder sogar therapeutisch genutzt werden können. Eine häufige Nebenwirkung aller zugelassenen Wirkstoffe, außer Topiramat, ist Gewichtszunahme. Migräneprophylaktika sind häufig schon in niedrigerer Dosierung wirksam, als in der ursprünglichen Indikation. Die medikamentöse Migräneprophylaxe kann bei Erfolg häufig nach 6-12 Monaten wieder ausgeschlichen werden, ohne dass die Kopfschmerzen erneut zunehmen.
Eine Sonderstellung nimmt die medikamentöse Prophylaxe der chronischen Migräne ein, denn für sie ist lediglich Topiramat und Botulinumtoxin (Onabotulinumtoxin A) zugelassen. Für andere bei episodischer Migräne nachweisbar wirksame Migräneprophylaktika ist die Studienlage hinsichtlich der Wirksamkeit bei chronischer Migräne unzureichend, oder es liegen sogar negative Studien vor (Propranolol; 14). Der Nachweis der Wirksamkeit von Botulinumtoxin bei chronischer Migräne beruht überwiegend auf zwei plazebokontrollierten Studien; sie sind jedoch wegen methodischer Mängel kritisiert worden (15). Der genaue Wirkmechanismus von Botulinumtoxin, das meist an mehr als 30 Stellen an Kopf und Nacken injiziert wird, ist unklar.
Nicht-medikamentöse Prophylaxe: Neben der Pharmakotherapie sind zur Behandlung und Prophylaxe der Migräne auch diverse nicht-medikamentöse Verfahren sinnvoll, beispielsweise Entspannungstechniken, Ausdauertraining, Verhaltenstherapie, Umstellung der Ernährung (wenn eindeutige Trigger identifiziert werden konnten) sowie regelmäßige und ausreichende Schlafphasen. Viele Patienten ziehen die auf Selbstwirksamkeit („self-efficacy beliefs“) beruhenden Verfahren einer Pharmakotherapie vor. Schon eine mindestens 30-minütige Beratung führt zu einer messbaren Reduktion der Kopfschmerztage und der Kopfschmerz-bezogenen Beeinträchtigung (16). Regelmäßiger Ausdauersport ist in der Migräneprophylaxe anhand der allerdings nur beschränkt verfügbaren Evidenz ähnlich wirksam wie eine medikamentöse Therapie (17). Mit Entspannungsverfahren lässt sich eine Reduktion der Migränefrequenz um 35-45% erzielen. Leicht zu erlernen und alltagstauglich ist vor allem die progressive Muskelrelaxation nach Jacobson. Eine ähnliche Wirkstärke hat die kognitive Verhaltenstherapie. Sie ist vor allem für Patienten mit starker Leistungsorientierung und Stress geeignet (16). Die Kombination einer medikamentösen Migräneprophylaxe mit einer verhaltenstherapeutischen Intervention ist wirksamer als jede der Maßnahmen für sich allein (18).
In den USA wurde ermittelt, dass jeder zweite Patient mit Migräne alternative und komplementäre Therapien einsetzt (19; vgl. auch 31). Zur Migräneprophylaxe werden Magnesium, Vitamin B2 und Coenzym Q10 als Nahrungsergänzungsmittel von europäischen, US-amerikanischen und kanadischen Leitlinien empfohlen, und zwar in Ergänzung zu einer pharmakologischen Prophylaxe oder ohne diese (20-22). Für jede dieser Substanzen liegt mindestens eine positive kontrollierte Studie vor, wobei die Ergebnisse jedoch widersprüchlich sind (23). Magnesium sollte bei Niereninsuffizienz nicht eingesetzt werden und führt häufig zu Diarrhö und anderen gastrointestinalen Beschwerden. Seltene Nebenwirkungen unter Vitamin B2 waren Übelkeit und Polyurie, unter Coenzym Q10 allergische Hautreaktion (23).
Die Evidenz für einen migräneprophylaktischen Effekt der elektrischen Stimulation des N. occipitalis, des N. vagus oder des ersten Trigeminusasts ist bislang unzureichend, ebenso für die transkranielle kortikale Magnetstimulation (24).
Therapeutischer Ausblick: Entsprechend der vermehrten Ausschüttung von Neurotransmittern (z.B. CGRP; s.o.) als möglicher Auslöser der Migräne wurden Antagonisten entwickelt; sie haben eine Wirksamkeit bei Migräne-Attacken gezeigt (35, 36). Auch monoklonale Antikörper gegen CGRP oder seine Rezeptoren (Eptinezumab, Erenumab, Fremanezumab, Galcanezumab) sind zur Prophylaxe und Therapie in klinischer Prüfung (37, 38).
Kopfschmerz durch zu häufigen Gebrauch von Medikamenten: Diese häufige Ursache chronischer Kopfschmerzen betrifft etwa 1% der erwachsenen Bevölkerung (25). Ein Kopfschmerz durch zu häufigen Gebrauch von Medikamenten muss immer dann vermutet werden, wenn über einen Zeitraum von mehreren Monaten durchschnittlich an mindestens jedem zweiten Tag Kopfschmerzen auftreten und an mindestens 10 Tagen (bei Triptanen, Opioiden und Kombinationsanalgetika) bzw. 15 Tagen pro Monat (bei einfachen Analgetika) Schmerzmittel eingenommen werden (1). Meist liegt eine Migräne als Kopfschmerzsyndrom zugrunde, seltener ein Spannungskopfschmerz. Typischerweise nimmt die Häufigkeit und Intensität der initial nur episodischen Kopfschmerzen unter dem zu häufigen Gebrauch zu, bis die Kopfschmerzen dann nahezu täglich auftreten. Opioide bergen das höchste Risiko der Entwicklung eines Kopfschmerzes durch zu häufigen Gebrauch, gefolgt von Triptanen und Kombinationsanalgetika (9, 26). Die Therapie der Wahl ist ein abruptes Absetzen der Analgetika, außer bei Opioiden. Typische Symptome eines Analgetikaentzugs sind zunehmende Kopfschmerzen, Übelkeit, Nervosität und Schlafstörungen. Die Entzugsphase dauert meist wenige Tage; sie ist bei Triptanen am kürzesten und mildesten. Es empfiehlt sich, gleichzeitig mit dem Analgetikaentzug eine medikamentöse Prophylaxe des zugrundeliegenden primären Kopfschmerzsyndroms zu beginnen. Bei Versagen ambulanter Therapieversuche oder erheblicher somatischer oder psychischer Komorbidität kann ein stationärer Analgetikaentzug indiziert sein. Nach Absetzen der Analgetika bessert sich der chronische Kopfschmerz meist innerhalb weniger Tage, wenn auch nicht regelhaft. Nach dem Entzug sollte der Patient seinen künftigen Analgetikakonsum in einem Kalender dokumentieren und darauf achten, dass die Zahl der Einnahmetage bei Analgetika 15 Tage und bei Triptanen 10 Tage pro Monat nicht überschreitet.
Literatur
- Headache Classification Committee of the International Headache Society: Cephalalgia 2013, 33, 629. Link zur Quelle
- Stovner, L.J., und Andree, C.: J. Headache Pain 2010, 11, 289. Link zur Quelle
- Kirthi, V., et a.: Cochrane Database Syst Rev. 2013 Apr 30;(4):CD008041. doi: 10.1002/14651858.CD008041. Link zur Quelle
- Cameron, C., et al.: Headache 2015, 55 (Suppl. 4), 221. Link zur Quelle
- Tfelt-Hansen P., et al.: Brain 2000, 123, 9. Link zur Quelle
- Ferrari, M.D., et al.: Lancet 2001, 358, 1668. Link zur Quelle
- Sandrini, G., et al.: Neurology 2002, 59, 1210. Link zur Quelle
- Tfelt-Hansen, P.: Cephalalgia 1993, 13, 238. Link zur Quelle
- Lipton R.B., et al. (AMPP = American Migraine Prevalence and Prevention study): Headache 2013, 53, 1548. Link zur Quelle
- Roberto, G., et al.: Cephalalgia 2015, 35, 118. Link zur Quelle
- Linde, M., et al.: Cochrane Database Syst. Rev. 2013 Jun 24;6:CD010611. Link zur Quelle
- Stovner, L.J., et al.: Cephalalgia 2013, 34, 523. Link zur Quelle
- Silberstein S.D.: Continuum (Mineap. Minn.) 2015, 21, 973. Link zur Quelle
- Jackson, J.L., et al.: PLOS One 2015, 10, e0130733. Link zur Quelle
- Gooriah, R., und Ahmed, F.: Ther. Clin. Risk Manag. 2015, 11, 1003. Link zur Quelle
- Kropp, P., et al.: Nervenheilkunde 2016, 35, 502. Link zur Quelle
- Koseoglu, E., et al.: J. Sports Med. Phys. Fitness 2015, 55, 1029. Link zur Quelle
- Holroyd, K.A., et al.: BMJ 2010, 341, c4871. Link zur Quelle
- Wells, R.E., et al.: Headache 2012, 51, 1087. Link zur Quelle
- Pringsheim, T., et al.: Can. J. Neurol. 2012, 39, S1. Link zur Quelle
- Holland, S., et al.: Neurology 2012, 78, 1346. Link zur Quelle
- Evers, S., et al.: Eur. J. Neurol. 2009, 16, 968. Link zur Quelle
- Rajapakse, T., und Pringsheim, T.: Headache 2016, 56, 808. Link zur Quelle
- Miller, S., und Matharu, M.: Curr. Pain Headache Rep. 2017, 21, 14. Link zur Quelle
- Diener, H.C., et al.: Nat. Rev. Neurol. 2016, 12, 575. Link zur Quelle
- Bigal, M.E., et al.: Headache 2008, 48, 1157. Link zur Quelle
- Meissner, K., et al.: JAMA Intern. Med. 2013, 173, 1941. Link zur Quelle
- Kam-Hansen, S., et al.: Sci. Transl. Med. 2014, 6, 218ra5. Link zur Quelle
- AMB 2016, 50, 84. Link zur Quelle
- AMB 2017, 51, 25. Link zur Quelle
- Charles, A.: N. Engl. J. Med. 2017, 377, 553. Link zur Quelle
- Ashina, M., et al.: Cephalgia 2013, 33, 540. Link zur Quelle
- Goadsby, P.J., et al.: Ann. Neurol. 1990, 28, 183. Link zur Quelle
- Zagami, A.S., et al.: Ann. Clin. Transl. Neurol. 2014, 1, 1036. Link zur Quelle
- Marcus, R., et al.: Cephalgia 2014, 34, 114. Link zur Quelle
- Voss, T., et al.: Cephalgia 2016, 36, 887. Link zur Quelle
- Hou, M., et al.: J. Headache Pain 2017, 18, 42. Link zur Quelle
- Tepper, S., et al.: Lancet Neurol. 2017, 16, 425. Link zur Quelle