Definition: Eine allgemein gültige Definition der Hyperurikämie gibt es nicht, doch werden Harnsäurewerte im Serum von ≥ 7 mg/l (416 µmol/l) bei Männern und > 6 mg/dl (> 360 µmol/l) bei Frauen – gemessen mit der Uricase-Methode – in den meisten Publikationen als Referenzwerte akzeptiert [1]. Diese Grenzen orientieren sich nicht primär an epidemiologisch gewonnenen Serumwerten (sie folgen keiner Normalverteilung in der Bevölkerung), sondern physikalisch an der Löslichkeitsgrenze von Mononatriumurat-Monohydrat in Wasser [2] [3]. In Körperflüssigkeiten kann der Sättigungspunkt allerdings niedriger sein, vor allem bei niedrigeren Temperaturen in Körperregionen, wie z.B. 35°C in der Großzehe [4] [5]. Andere Autoren schlagen vor, die Grenze generell schon bei > 6 mg/dl anzusetzen, weil damit das lebenslange Risiko für Gicht und außerdem das empfohlene Ziel im Falle einer Behandlung mit harnsäuresenkenden Medikamenten miterfasst würde [6].
Die Diagnose asymptomatische Hyperurikämie (aHU) soll beschreiben, dass klinisch (noch) keine typischen Zeichen oder Auswirkungen der Hyperurikämie bestehen, wie Gicht, Harnsäure-Nephropathie, Harnsäure-Nephrolithiasis bzw. Harnsäure-Verstopfungsniere. Die Bezeichnung „asymptomatisch“ wird jedoch von einigen Autoren relativiert, weil sich Harnsäure auch ohne Gicht-Symptome ablagern kann, beispielsweise subkutan, periartikulär und renal, wie sonographische und Dual-Energy-CT-Befunde zeigen (Übersicht bei [7]). Dadurch könnten auch die mit aHU assoziierten Erkrankungen schon früh ungünstig beeinflusst werden [8]. Anhand dieser Untersuchungsbefunde wird vorgeschlagen, die Gicht hinsichtlich ihrer Stadien neu zu klassifizieren (vgl. [7] [9]).
Prävalenz: Die Prävalenz der aHU nimmt bereits ab der Pubertät ständig zu. Sie ist bei Männern sehr viel häufiger als bei Frauen vor der Menopause und in den letzten Jahrzehnten deutlich angestiegen. In den USA betrug sie im Jahr 2011: 21,2% bei Männern (Gicht 5,9%) bzw. 21,6% bei Frauen (Gicht 2,0%; [10]) und in Taiwan im Jahr 2000: 25,8% (Gicht 11,5%) bzw. 15,0% (Gicht 3%; [11]). Es ist zu bedenken, dass Hyperurikämie und die Manifestation einer Gicht auch durch Arzneimittel ausgelöst werden kann (vgl. Tab. 1)
Assoziation mit anderen Krankheiten: Die aHU ist mit einer Reihe von Erkrankungen assoziiert (u.a. Gicht, Niereninsuffizienz, kardiovaskuläre Krankheiten/Hypertonie, Adipositas, metabolisches Syndrom, Schlafapnoe) von denen zwei, Gicht und chronische Nierenerkrankungen mit Niereninsuffizienz, im Folgenden besprochen werden sollen. Fast unüberschaubar ist die Zahl klinischer Studien, Reviews und Metaanalysen besonders der letzten 10 Jahre, in denen versucht wurde, aus solchen Assoziationen eine kausale Rolle der aHU bei der Entstehung oder Verschlechterung von Grunderkrankungen abzuleiten und mit einer (zusätzlichen) harnsäuresenkenden Behandlung ihren Verlauf günstig zu beeinflussen. Das Zeitintervall zwischen Beginn der aHU und der Manifestation assoziierter Erkrankungen erschwert allerdings den Nachweis, ob die aHU nur ein Marker oder ein kausaler Faktor ist. Die Ergebnisse von Interventionsstudien sind widersprüchlich und Empfehlungen deshalb schwierig.
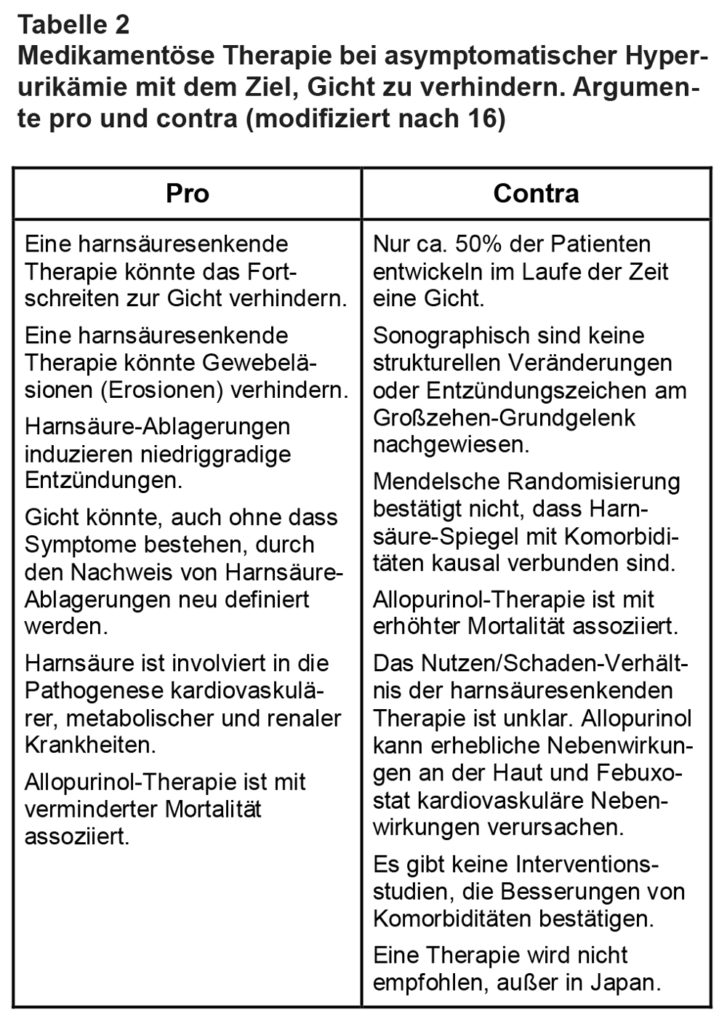
Gicht: Der kausale Zusammenhang zwischen aHU und Gicht – sei es ein Gichtanfall oder die tophöse Form – ist evident. Seit langem ist aber auch bekannt, dass ein großer Anteil der Personen mit aHU oft lebenslang asymptomatisch (s.o.) bleibt. Allerdings steigt die Wahrscheinlichkeit für Gicht mit steigenden Harnsäure-Werten. Bei Werten von 6,0-6,9 mg/dl (360-414 µmol/l) manifestierte sich bei 0,6% in 5 Jahren eine Gicht, bei Werten > 9 mg/dl (> 535 µmol/l) bei ca. 22% ([12], vgl. [3], [13]). Eine prophylaktische medikamentöse Behandlung mit harnsäuresenkenden Medikamenten wird heftig diskutiert (s. Tab. 2); ein genereller Nutzen oder das Verhältnis von klinischem Nutzen und medikamentösen Risiken ist aber nicht evidenzbasiert belegt [3] [5]). Aus einem systematischen Review und einer Fall-Kontroll-Studie, gibt es sogar statistische Hinweise, dass die prophylaktische Behandlung mit Allopurinol bei unselektierten Personen mit aHU die Häufigkeit erster Gichtanfälle nicht vermindern kann [14] [15]. Wer also von einer solchen medikamentösen Prophylaxe profitiert, ist unklar. Zu bedenken ist zudem, dass bei einer generellen prophylaktischen Behandlung, auch von Personen mit deutlich erhöhten Harnsäurewerten, viele unnötig den potenziellen, durchaus bedeutsamen Neben- und Wechselwirkungen von beispielsweise Allopurinol oder Febuxostat ausgesetzt würden [16] [17] [18]. Insgesamt wird in internationalen Leitlinien eine generelle harnsäuresenkende Behandlung bei aHU nicht empfohlen, außer in der japanischen (zit. nach [5]). Zudem wird argumentiert, dass es erprobte, gut wirksame und sichere Behandlungsmöglichkeiten gibt, falls ein erster Gichtanfall auftritt (vgl. [3]).
Chronische Nierenkrankheiten bzw. chronische Niereninsuffizienz: Die Assoziation von chronischer Niereninsuffizienz und Hyperurikämie ist lange bekannt und evident, auch vice versa. Durch die abnehmende Kapazität der Uratausscheidung bei abnehmender Nierenfunktion stellt sich ein neues Gleichgewicht durch erhöhte Harnsäure-Serumwerte ein. Es besteht erhebliche Uneinigkeit, ob die aHU bei chronischen Nierenkrankheiten am Fortschreiten der Niereninsuffizienz kausal beteiligt ist, z.B. durch Uratablagerungen im Niereninterstitium mit reaktiver Entzündung, und falls ja, ob das Ausmaß der Hyperurikämie dabei eine Rolle spielt, wie eine alte epidemiologische Studie suggeriert [19]. Einige Autoren sehen in der aHU einen wichtigen Marker [1], andere schätzen anhand ihrer Ergebnisse von Interventionsstudien die Hyperurikämie als unabhängigen und somit wahrscheinlich auch kausalen Faktor für eine Verschlechterung der Nierenfunktion ein. Sie befürworten deshalb eine Behandlung, u.a. auch wegen der J-förmigen Kurve in der Beziehung zwischen Serum-Harnstoffwerten und Mortalität [20]. Die zahlreichen Interventionsstudien, die zu dieser Frage vorliegen, sind jedoch sehr heterogen, u.a. hinsichtlich der Begleiterkrankungen und Stadien der Niereninsuffizienz. Deshalb verwundert es nicht, dass die Ergebnisse widersprüchlich sind, d.h. in einigen Studien konnte durch harnsäuresenkende Therapie die Progression der Niereninsuffizienz verlangsamt werden in anderen nicht. Da hier nicht alle Aspekte der Studien besprochen werden können und wir einige dieser Studien bereits besprochen haben, seien die Ergebnisse wichtiger Studien zumindest nach ihren positiven bzw. negativen Ergebnissen der jeweiligen harnsäuresenkenden Therapie im Literaturverzeichnis geordnet:
Allopurinol-Therapie positiv: (Lit. [21], [22], [23], [24]);
Allopurinol-Therapie negativ: (Lit. [25], [26]);
Febuxostat-Therapie positiv: (Lit. [27], im kombinierten primären Endpunkt, [28]);
Febuxostat-Therapie negativ: (Lit. [29], [30]).
Ein systematisches Review mit Metaanalyse [31] schloss 29 randomisierte, kontrollierte, prospektive, jedoch sehr heterogene Studien ein mit insgesamt 6.458 Teilnehmern, die eine harnsäuresenkende Therapie erhielten: Allopurinol/Oxypurinol = 16 Studien, Febuxostat = 9 Studien, Topioxostat = eine Studie, Lesinurat oder Pegloticase (zwei Nicht-Xanthinoxydase-Hemmer) = 3 Studien. Davon waren 19 plazebokontrolliert und 10 hatten keine Medikation in der Vergleichsgruppe. Die mediane Beobachtungszeit betrug 48 Wochen (6-84 Monate), die mediane Senkung der Harnsäure 38%, absolut 2,53 mg/dl. Hinsichtlich „renaler Ereignisse“ ergaben die Analysen keine Vorteile der harnsäuresenkenden Interventionen insgesamt (Relatives Risiko: 0,97; 95%-Konfidenzintervall = CI: 0,61-1,54; Heterogenität I2 = 52%). Die Interventionen verringerten jedoch etwas die Abnahme der Nierenfunktion: mittlere Differenz der GFR: 1,18 ml/min/1,73 m2 pro Jahr; CI: 0,44-1,91; I2 = 69%. Es fanden sich keine Unterschiede in der Häufigkeit von Nebenwirkungen. Auch hinsichtlich bedeutsamer kardialer Ereignisse („major adverse cardiovascular events“) und der Mortalität wurden keine Unterschiede zwischen Verum und Kontrolle errechnet. Es ist jedoch diskussionswürdig, ob aus einer Metaanalyse so heterogener Studien die endgültig klingende Schlussfolgerung der Autoren gezogen werden kann: „Thus, there is insufficient evidence to support urate lowering in patients to improve kidney and cardiovascular outcomes“. Vorsichtiger formuliert wird in einem sorgfältigen Review zum Wert der harnsäuresenkenden Therapie hinsichtlich günstiger Einflüsse auf die Nierenfunktion und auf kardiovaskuläre Endpunkte: „The last word hasn’t been said yet“ [32].