Zusammenfassung: Die enterale Ernährung ist im Vergleich zur parenteralen die physiologischere und komplikationsärmere Form der Nahrungszufuhr. Wenn immer möglich, sollte daher von der parenteralen rasch auf die enterale Ernährung übergegangen werden.
Neben den Indikationen müssen je nach Grunderkrankung und geplanter Dauer auch die adäquaten Zugangswege und Applikationsformen der enteralen Ernährung bedacht werden. Soll die enterale Ernährung länger als 2-4 Wochen durchgeführt werden, ist die Anlage einer nasoduodenalen Sonde oder einer perkutanen endoskopischen Gastrostomie (PEG), besonders bei älteren Patienten und/oder bei Passagebehinderung im oberen Gastrointestinaltrakt, indiziert. In der Regel ist eine standardisierte hochmolekulare Formuladiät mit Ballaststoffen ausreichend. Verschiedene Zustände (Operationen, Traumata, Diabetes meIlitus, Nieren- oder Leberinsuffizienz) führen zu spezifischen Stoffwechselveränderungen. Für diese Situationen wird von verschiedenen Herstellern eine Vielzahl modifizierter Nährlösungen angeboten. Ob die Gabe dieser modifizierten Nährlösungen – im Vergleich zur standardisierten hochmolekularen Diät – klinisch vorteilhaft ist, wird sehr kontrovers beurteilt. Überzeugende klinische Studien liegen nicht vor. Im Einzelfall kann bei Unverträglichkeit der hochmolekularen Formuladiät ein Versuch mit diesen modifizierten Diäten unternommen werden.
Die künstliche Ernährung hat als wesentliches Ziel die Prävention bzw. Behandlung von Schäden durch Fehl- oder Mangelernährung. Sie soll das Wohlbefinden des Patienten steigern und durch Erhalten der funktionellen Körpersubstanz Komplikationen vermeiden. Die enterale Ernährung kann darüber hinaus dazu beitragen, den Aufenthalt im Krankenhaus zu verkürzen und damit die krankheitsbedingten Kosten zu senken. Prinzipiell sollte bei jeder Ernährungstherapie folgende Priorität eingehalten werden: Die normale Ernährung des Patienten bleibt immer das wichtigste Ziel, dem die Gabe von Trinknahrung, die enterale Ernährung über Ernährungssonden, die kombinierte enterale und parenterale Ernährung sowie die totale parenterale Ernährung unterzuordnen ist. Eine parenterale Ernährung sollte somit möglichst rasch durch eine Form der enteralen Ernährung ersetzt werden.
Zur Einschätzung einer Mangelernährung können verschiedene anthropometrische, biochemische und immunologische Parameter herangezogen werden. Für die klinische Praxis hat sich die Bestimmung des Body-Mass-lndex (BMI; Körpergewicht/Körperlänge2 [kg/m2]) oder die dokumentierte, ungewollte Substanzabnahme innerhalb einer bestimmten Zeit als brauchbar erwiesen. Ein BMI < 18,5 oder eine Gewichtsabnahme von 5-10% in den vorausgegangenen drei Monaten wird als diagnostisches Kriterium für eine Mangelernährung gewertet. Es ist differentialdiagnostisch zu bedenken, daß bei verschiedenen Erkrankungen ein erhöhter Energie- bzw. Substratbedarf besteht. Auf die Physiologie des Stoffwechsels, speziell auf die pathophysiologischen Besonderheiten des Hunger- bzw. des Postaggressions-Stoffwechsels kann an dieser Stelle nicht eingegangen werden; es wird auf die Übersicht zur parenteralen und enteralen Ernährung entsprechend der Empfehlungen der Deutschen Gesellschaft für Anästhesie und lntensivmedizin verwiesen (1). Unter klinischen Gesichtspunkten spielt der Hypermetabolismus im Vergleich zur Malnutrition und zur Nahrungskarenz nur eine untergeordnete Rolle. Jede längerdauernde Nahrungskarenz (z.B. auch durch häufige diagnostische Maßnahmen verursacht!) oder unzureichende Nährstoffzufuhr führt zu einem Abbau körpereigener Reserven. Als Nahrungskarenz wird dabei nicht nur die vollständige Nahrungskarenz, sondern bereits eine Kalorienzufuhr < 500 kcal/d verstanden. Die Dauer der bereits bestehenden und/oder zu erwartenden Nahrungskarenz spielt bei der Indikation zur Ernährungstherapie eine wichtige Rolle.
Generelle Indikationen: Bei medizinischer Indikation ist eine Sondennahrung verordnungsfähig aufgrund der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen (AMR) über die Verordnung von Arzneimitteln in der vertragsärztlichen Versorgung. Medizinische lndikationen für eine künstliche Ernährung (Aminosäuremischungen und Eiweißhydrolysate) sind gegeben bei angeborenen Enzymmangel-Erkrankungen sowie enterale Diäten bei M. Crohn, Kurzdarm-Syndrom, stark Untergewichtigen mit Mukoviszidose, bei Patienten mit chronischer Niereninsuffizienz unter eiweißarmer Ernährung und bei Patienten mit konsumierenden Erkrankungen. Konsumierende Erkrankungen sind z.B. Tumorerkrankungen, AIDS, Tuberkulose und anhaltend hochfieberhafte oder chronisch entzündliche Krankheiten mit Abbauvorgängen. Die medizinische Ernährung im Sinne der Nr. 17.1 der AMR fällt somit auch in das Arzneimittelbudget des Vertragsarztes. Für die Verabreichung medizinisch indizierter Sondennahrung werden in der Regel Ernährungssonden, spezielle Überleitungssysteme und teilweise auch Ernährungspumpen benötigt. Diese Produkte sind Hilfsmittel und gehören laut Produkteübersicht der Spitzenverbände der gesetzlichen Krankenkassen zum Bereich ”Applikationshilfen“; sie fallen nicht unter das Arzneimittelbudget.
Kontraindikationen und Komplikationen: Es gibt prinzipielle Kontraindikationen für eine künstliche Ernährung und spezielle personenbezogene bzw. krankheitsspezifische Kontraindikationen. Die künstliche Ernährung von Patienten im Terminalstadium konsumierender Erkrankungen wird diskutiert, aber als Befriedigung eines menschlichen Grundbedürfnisses, das häufig aufgrund der Krankheit nicht selbst vollzogen werden kann, ethisch weitgehend bejaht (17). Die Ernährung von Patienten gegen ihren erklärten Willen ist unter dem Gesichtspunkt der Selbstbestimmung abzulehnen, d.h. es muß eine Einwilligungserklärung unterschrieben werden, speziell wenn die Ernährung über perkutane endoskopische Zugänge geplant ist. (s.u). Klinisch ist die enterale Ernährungstherapie bei schwersten Störungen der Vitalparameter mit katecholaminpflichtiger Kreislaufinsuffizienz, metabolischer Azidose (pH < 7,25), Hyperlaktatämie, schweren Gerinnungsstörungen oder während einer Reanimation kontraindiziert. Auch in den Akutphasen schwerer Stoffwechselentgleisungen (Coma diabeticum, hepaticum oder urämicum) wird eine Kontraindikation für eine enterale Ernährung gesehen. Spezielle Kontraindikationen für die enterale Ernährung sind unstillbares Erbrechen, akute intestinale Obstruktionen, Blutungen, Perforationen oder Peritonitis. Komplikationen treten bei Sondenernährung generell selten auf und sind von geringerer Relevanz (2). Eine besondere Gefahr der Ernährung über Sonden ist die Aspirationspneumonie. In einer kürzlich publizierten Studie wurde bei 80 beatmeten Patienten gefunden, daß Pneumonien bei Duodenalsonden seltener sind als bei Magensonden (27% vs. 42%; s.a. weiter unten: Applikationstechnik). Auch waren die mediane Beatmungsdauer (5 vs. 7 Tage) und der Aufenthalt auf der lntensivstation (5 vs. 9 Tage) bei Patienten mit Duodenalsonden kürzer; die Unterschiede waren aber wegen der kleinen Fallzahl nicht signifikant (3).
Ein häufiges Problem bei enteraler Ernährung ist Diarrhö, die u.a. durch zu rasche Steigerung der Kostmenge, bakterielle Kontamination der Nahrung, zu hohen Laktosegehalt, Fettintoleranz, zu schnelle Applikation, zu große Volumina oder zu kalte Sondenkost, aber auch durch pathologisch veränderte Darmflora verursacht werden kann. Bei einigen Patienten steigen unter hochkalorischer Ernährung die Transaminasen und die alkalische Phosphatase; meist kehren sie jedoch spontan in den Normalbereich zurück. Bei enteraler Ernährung sollten der Allgemeinzustand sowie das Gewicht des Patienten häufig kontrolliert und auf eventuellen Reflux, Darmgeräusche, Stuhlverhalten und Flatulenz geachtet werden.
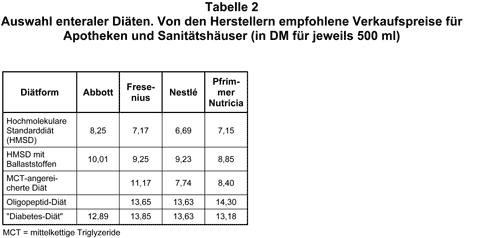
Ernährungssubstrate: Die Auswahl der enteralen Nährlösung ist schwierig, da der behandelnde Arzt mit einer unüberschaubaren Zahl verschiedener Nährlösungen und Trinknahrungen konfrontiert ist. Der Nutzen dieser Substrate ist häufig unzureichend belegt. Folgende Gesichtspunkte können eine Hilfe bei der Auswahl sein: Enterale Nährlösungen sollten grundsätzlich die gleiche Zusammensetzung wie eine ausgewogene Normalkost haben. Dabei werden 15-22% des Energiebedarfs durch Proteine, 15-35% durch lang- oder mittelkettige Triglyzeride und etwa 45-55% durch Kohlenhydrate gedeckt. Darüber hinaus müssen ausreichend Elektrolyte, Spurenelemente und Vitamine zugeführt werden. Industriell hergestellte Sondennahrung ist standardisiert und ihr Nährstoff-, Mineral- und Vitamingehalt genau definiert Die Präparate sind in der Regel portionsweise abgepackt. Man unterscheidet grundsätzlich die hochmolekulare (Formuladiät) und die niedermolekulare Diät. Die hochmolekulare Formuladiät (s. Tab. 1) ist nährstoffdefiniert. Sie enthält intakte Proteine, Kohlenhydrate und zwischen 9,4 g und 50 g Fett/1000 kcal. Sie ist als ballaststoffhaltige bzw. ballaststofffreie Diät erhältlich. Hochmolekulare Diäten müssen bei alleiniger Gabe bedarfsdeckend sein. Voraussetzung ist eine ungestörte Resorptionskapazität des Darmes. Der Energiegehalt sollte bei 1,0-1,5 kcal/ml Nährlösung liegen, um den Energiebedarf mit einer akzeptablen Flüssigkeitszufuhr zu decken. Der Gehalt an Spurenelementen und Energie muß mindestens dem Bedarf gesunder Normalpersonen entsprechen. Die Eiweißzufuhr sollte 0,8 bis maximal 2 g/kg Körpergewicht betragen. Als Kohlenhydratkomponente empfiehlt sich ein ausgewogenes Gemisch aus Poly-, Oligo- und Disacchariden. Laktose ist wegen der häufigen primären oder sekundären Laktoseintoleranz ungeeignet. Fette sollten zu je einem Drittel als mehrfach ungesättigte Fettsäuren, einfach ungesättigte Fettsäuren und gesättigte Fettsäuren vorhanden sein. Der Elektrolytanteil der verschiedenen Diäten ist sehr unterschiedlich. Der Natriumgehalt beeinflußt nicht nur die Resorption der Nährsubstrate, sondern auch den gesamten Flüssigkeitshaushalt des Patienten. Der Gehalt an Magnesium, Kalzium und Phosphat ist bei den verschiedenen Sondennahrungen ausreichend. Die klinische Erfahrung zeigt, daß bei Langzeitgabe, insbesondere bei Patienten mit Divertikulose, Obstipation oder Diabetes mellitus, die ballaststoffreichen Nahrungen vorteilhaft sind. Klinisch relevante Unterschiede zwischen den verschiedenen industriell hergestellten hochmolekularen Standarddiäten sind nicht belegt. Für die Auswahl des Präparats ist somit der Geschmack (bei oraler Gabe) und der Preis entscheidend. Bei der Applikation über eine Ernährungssonde sollte eine im Geschmack neutrale Diät verwendet werden, da bei eventuellem Reflux ein intensiver Geschmack häufig als unangenehm empfunden wird. Bei den Kosten ist zu beachten, daß es empfohlene Verkaufspreise gibt (s. Tab. 2). Häufig werden aber von den Herstellern Rabatte oder Spezialpreise – insbesondere bei Großapotheken – eingeräumt, so daß auch für den ambulanten Bereich ein Gespräch zwischen Apotheker und Arzt lohnt.
Die zweite Gruppe der enteralen Nährlösungen umfaßt die chemisch definierten Diäten, bei denen es sich um niedermolekulare Diäten handelt. Dazu gehören die eigentlichen Elementardiäten der 1. Generation, die aus einem Gemisch von Glukose, L-Aminosäuren und Ethyllinoleat bestehen. Diese monomeren Substanzen werden im oberen Jejunum vollständig resorbiert. Der Nachweis, daß Oligopeptide im oberen Dünndarm besser resorbiert werden als Aminosäurengemische, führte zur Entwicklung der 2. Generation niedermolekularer Diäten, den sogenannten Oligopeptid-Diäten. Sie haben eine niedrigere Osmolarität (dadurch weniger Diarrhö, Oberbauchschmerzen, Völlegefühl) und werden geschmacklich besser akzeptiert. Dennoch werden die Oligopeptid-Diäten und auch die Elementardiäten der 1. Generation bei langfristiger oraler Einnahme von den meisten Patienten wegen des unangenehmen Geschmacks nicht toleriert.
Applikationstechnik: Die enteralen Ernährungslösungen können getrunken werden oder über verschiedene Sondentypen zugeführt werden. Grundsätzlich kann zwischen gastralen, duodenalen und jejunalen Sonden sowie transnasal, perkutan-endoskopisch bzw. perkutan-chirurgisch angelegten Zugängen (z.B. PEG, perkutane Jejunostomie, Feinnadelkatheterjejunostomie) unterschieden werden. Die naso- oder orogastralen Sonden werden vor allem bei bewußtseinsklaren bzw. bei intubierten Patienten bei enteraler Ernährung über einen begrenzten (kurzen) Zeitraum bevorzugt. Die Lage der Sonde sollte vor Beginn der Ernährung röntgenologisch überprüft werden. Bei gastraler Sondenlage sollte die Ernährungslösung jeweils als Bolus gegeben werden, denn bei kontinuierlicher Applikation oder kurzen Zeitintervallen besteht die Gefahr der Magenatonie. Duodenal-/Jejunalsonden werden z.B. bei Patienten mit Erkrankungen oder nach Operationen im Bereich des oberen lntestinaltrakts oder bei starkem gastroösophagealem Reflux unter gastraler Ernährung eingesetzt. Die Positionierung erfolgt unter röntgenologischer bzw. endoskopischer Kontrolle. Die Zufuhr der Nahrung über eine Duodenalsonde sollte kontinuierlich sein, um ein Dumping-Syndrom zu vermeiden. Die PEG ist bei Langzeiternährung der transnasalen Sonde wegen der Gefahr der Druckulzera oder bei stenosierenden Prozessen des Ösophagus (z.B. bei Tumoren) vorzuziehen. Bei der Anlage ist – zumindest bei Risikopatienten – zum Vermeiden von Infektionen die prophylaktische Gabe eines Antibiotikums (z.B. einmalig 1 g Ceftriaxon i.v.) wirksam (4). 12-24 h nach der Anlage kann mit der Ernährung begonnen werden. Die Zufuhr der Sondennahrung sollte langsam und stufenweise gesteigert werden, wobei sich die Dauer der Adaptationsphase nach der Grundkrankheit, der Lokalisation der Sonde und der Art der Diät richtet. Nach Operationen ist mit der enteralen Ernährung erst nach Einsetzen der Darmmotorik (ca. 2.-4. postoperativer Tag) zu beginnen. Das Volumen der Sondennahrung sollte in täglichen Schritten von 250-500 ml in Abhängigkeit von Grunderkrankung, Lage der Sondenspitze und subjektiver Verträglichkeit gesteigert werden. Treten während des Nahrungsaufbaus Diarrhö, Überblähung oder Erbrechen auf, wird entweder die enterale Ernährung reduziert oder 1-2 Tage lang ausschließlich Tee gegeben. Danach kann die Ernährung vorsichtig wieder aufgebaut werden. Bevor die optimale Energie- und Flüssigkeitsmenge erreicht ist, werden noch fehlende Flüssigkeit, Elektrolyte und Nährstoffe zusätzlich parenteral zugeführt Bei der enteralen Ernährung ist es nach allgemeiner Meinung günstig, wenn entsprechend der normalen zirkadianen Ernährungsrhythmik nächtliche Pausen von 6-8 Stunden eingehalten werden. Bei enteraler Ernährung muß auf eine ausreichende Kalorienzufuhr geachtet werden. In einer Untersuchung an intensivmedizinisch betreuten, enteral mit Sondenkost ernährten Patienten wurde festgestellt, daß die behandelnden Ärzte nur ca. 66% des täglichen Bedarfs verordneten und daß von dieser Menge wiederum nur 78% tatsächlich gegeben wurde (5).
Nach Operationen oder Traumen kann noch vor Einsetzen der Darmmotorik mit einer minimalen enteralen Ernährung (sog. ”Zottenernährung“) begonnen werden, wobei die Menge von 25-30 ml/h nicht überschritten werden sollte. Hierbei steht nicht der Aspekt der systemischen Ernährung im Vordergrund. Die Zufuhr von Nährstoffen in das Darmlumen trägt nämlich außerdem dazu bei, die Integrität des Epithels zu erhalten und vor der Translokation von Bakterien und systemischen Infektionen zu schützen. Experimentelle Untersuchungen zeigen, daß die Zahl lebender Mikroorganismen in mesenterialen Lymphknoten durch eine enterale Substratzufuhr reduziert werden kann (6). In einer klinischen Studie an traumatologischen Patienten traten bei isokalorischer parenteraler Ernährung (TPN) im Vergleich mit enteraler Ernährung mehr Pneumonien (31% vs. 11,8%); Abszesse (17,8% vs. 3,9%) und Katheterkomplikationen (13,3% vs. 1,9%) auf (7). In einer anderen Untersuchung konnte jedoch bei routinemäßiger, additiver enteraler Ernährung in der postoperativen Situation (zuzüglich zum normalen Kostaufbau) kein klinischer Nutzen (einschließlich Verweildauer im Krankenhaus, Zahl der Haupt- und Nebenkomplikationen) nachgewiesen werden (8).
Sondennahrung bei speziellen Indikationen: Neben den standardisierten hochmolekularen Diäten wird von der Industrie eine Vielzahl modifizierter Sondennahrungen angeboten. Diese Modifikationen in der Zusammensetzung der Nährstoffanteile oder der Zusatzstoffe berücksichtigen pathophysiologische Besonderheiten einzelner Krankheiten, aus denen sich – zumindest nach Ansicht der Hersteller – spezielle Indikationen ergeben sollen. Es fehlen aber in der Regel gut kontrollierte, prospektive Studien, die den klinischen Nutzen von Spezialdiäten gegenüber einer standardisierten hochmolekularen Diät bei isokalorischer Ernährung belegen. Allerdings sind solche Studien wegen der notwendigen großen Patientenzahlen auch sehr schwierig durchzuführen. So können z.B. im Einzelfall durchaus Diäten, die mit mittelkettigen Triglyzeriden (MCT) angereichert sind, bei chronischer Pankreatitis oder beim Kurzdarm-Syndrom indiziert sein. Fettreiche Diäten können möglicherweise bei beatmeten Patienten die Entwöhnung vom Respirator erleichtern, denn die Erhöhung des Fettanteils auf Kosten des Kohlenhydratanteils führt zu einer geringeren CO2-Produktion. Die Begründung für diese Spezialdiät leitet sich aus Untersuchungen an gesunden Probanden ab, die zwei verschiedene Formuladiäten erhielten. Nach Gabe einer fettreichen Diät (50% Fettanteil) über 5 Tage zeigte sich beim Vergleich mit einer Diät mit nur 30% Fettanteil eine hochsignifikante Abnahme der CO2-Abgabe bzw. des CO2-Drucks (9, 10). Bei einem kleinen Kollektiv von 19 Patienten konnte tatsächlich nach Gabe der fettreichen Diät die Beatmungszeit verkürzt werden (10). Bei kontrollierter Beatmung oder wiederhergestellter selbständiger Atmung bietet diese Diät jedoch keine wesentlichen Vorteile. Für Diabetiker wurden Diäten entwickelt, bei denen Glukoseersatzstoffe verwendet werden. Durch diese Ersatzstoffe können jedoch gastrointestinale Unverträglichkeitsreaktionen entstehen. Häufig ist eine ballaststoffreiche Standard-Sondennahrung unter Anpassen der antidiabetischen Therapie genauso gut geeignet und besser verträglich. Es sei ausdrücklich darauf hingewiesen, daß eine spezielle Sondenernährung für intensivmedizinisch betreute Diabetiker unnötig ist, da der Glukosestoffwechsel durch entsprechende Insulingaben sicher gesteuert werden kann. Auch für leber- und niereninsuffiziente Patienten wurden spezielle Sondennahrungen entwickelt. In der Praxis werden diese Diäten aber selten benötigt, da diese Patienten in der Regel normal Nahrung zu sich nehmen können. Situationen, in denen einerseits eine ausreichende normale Ernährung nicht möglich, andererseits aber keine parenterale Ernährung erforderlich ist, ergeben sich selten. Des weiteren werden Sondendiäten angeboten, die reich an Omega-3-Fettsäuren, Glutamin, Arginin und antioxidativen Vitaminen sind. Eine Indikation wird bei rheumatischen Erkrankungen, Tumorerkrankungen, chronisch entzündlichen Darmerkrankungen oder im Postaggressions-Stoffwechsel propagiert. Allerdings fehlen auch hier geeignete Studien, die den tatsächlichen Nutzen belegen; diese Indikationen sind somit nicht gesichert.
Enterale Ernährung in der präoperativen Situation: In zwei großen Studien wurde die Bedeutung des Ernährungszustands für die postoperative Letalität und Morbidität untersucht. In der ersten Untersuchung an 395 Patienten profitierten nur Patienten mit einer ausgeprägten Mangelernährung von einer präoperativ begonnenen (parenteralen!) Ernährungstherapie im Hinblick auf Komplikationen, einschließlich postoperativer Infektionen (11). In einer zweiten Studie mit 87078 Patienten korrelierte der präoperative Serumalbuminspiegel (als Indikator des Ernährungszustands) am besten mit der Letalität im Krankenhaus (12). Beide Studien zeigen somit, daß bei schlechtem Ernährungszustand das Risiko postoperativer Komplikationen höher ist. Der direkte Nachweis aber, ob eine präoperative enterale Ernährungstherapie postoperative Komplikationen verhindert, wird jedoch durch die notwendigen großen Patientenzahlen im Rahmen kontrollierter Studien und durch die per se niedrige Komplikationsrate bei Elektiveingriffen fast unmöglich. Deshalb bleibt es eine Einzelfall-Entscheidung, einem mangelernährten Patienten eine hochmolekulare Diät zur präoperativen Besserung des Ernährungszustandes enteral über eine Sonde zu verabreichen. Voraussetzung ist jedoch, daß das Intervall zwischen dem Beginn der Ernährungstherapie und dem Elektiveingriff lang (genug) ist.
Enterale Ernährung bei chronisch entzündlichen Darmerkrankungen: Die enterale Ernährung wird bei Patienten mit chronisch entzündlichen Darmerkrankungen als alleinige Therapiemaßnahme, aber auch in Verbindung mit einer medikamentösen Standardtherapie eingesetzt. Folgende Wirkmechanismen werden angenommen: ”Ruhigstellung“ erkrankter Darmabschnitte durch Resorption der gegebenen Nahrung im oberen Intestinaltrakt und Reduktion immunogener Substanzen. Insbesondere beim M. Crohn sind zahlreiche Studien zur Wirksamkeit der enteralen Ernährung durchgeführt worden (Übersicht bei 13). Die Ergebnisse sind jedoch wegen kleiner Fallzahlen einiger Studien, unterschiedlichen Remissions-definierenden Kriterien und unterschiedlichen Applikationsformen (oral bzw. über Duodenalsonden) schlecht vergleichbar. Zusammenfassend gilt, daß im akuten Schub des M. Crohn die medikamentöse Behandlung (Kombinationsbehandlung Steroide/Sulfasalazin bzw. 5-ASA) effektiver ist, die Remission schneller eintritt und in ihrer Wirksamkeit nicht von der initialen Krankheitsaktivität und dem Befallsmuster abhängig ist. Bei Patienten mit Dünndarmbefall und/oder niedriger Krankheitsaktivität ist die Effektivität einer enteralen Ernährungstherapie etwa gleich der von Steroiden; die Compliance ist bei Gabe über Duodenalsonden akzeptabel (14). Rezidive scheinen aber nach Beendigung der enteralen Ernährung und Umstellung auf orale Kost relativ häufig (15). Gesichert ist die Indikation für eine enterale Ernährung bei Kindern mit M. Crohn und Wachstumsrückstand.
Welche Diät sollte nun Patienten mit M. Crohn gegeben werden? Nur in einer der bisher zu diesem Thema vorliegenden Studien war die Elementardiät der hochmolekularen Diät überlegen; in allen anderen Studien bestand zwischen den Elementar-, Oligopeptid- oder hochmolekularen Diäten kein Unterschied. Gegenwärtig ist also für keine der drei Diätformen ein therapeutischer Vorteil nachgewiesen. Beim akuten Schub einer Colitis ulcerosa ist die Behandlung mit enteralen Diäten nicht gesichert.
Enterale Ernährung bei Tumorpatienten: Auf die ethischen Gesichtspunkte bei der künstlichen Ernährung von Tumorpatienten kann an dieser Stelle nicht eingegangen werden, jedoch gilt auch hier, daß Flüssigkeits- und Nahrungszufuhr als ein menschliches Grundbedürfnis anzusehen sind. Es gibt aus ethischen Gründen keine kontrollierten Studien, die den Nutzen einer über Sonden gegebenen enteralen Ernährung bei Tumorpatienten mit Schluckstörungen (Tumoren im HNO-Bereich, des Ösophagus bzw. des Magens) geprüft haben. Allgemein wird aber akzeptiert, daß Malnutrition ein wichtiger Risikofaktor für Komplikationen und für eine ungünstige Prognose ist. Deshalb sollte auch bei therapeutischen Interventionen (Radiatio, Chemotherapie, chirurgische Eingriffe) darauf geachtet werden, daß der Patient ausreichend kalorisch ernährt wird. Aus klinischer Erfahrung muß die prophylaktische Anlage einer PEG bei geplanter Radiochemotherapie von Tumoren im HNO-Bereich oder des Ösophagus wegen der drohenden Mukositis mit Dysphagie empfohlen werden. Weiterhin konnte eine Studie nachweisen, daß eine additive postoperative enterale Ernährung über eine Jejunostomie bei Patienten mit Ösophagus-, Magen- oder Pankreastumoren die Komplikationen und die postoperative Verweildauer im Krankenhaus signifikant senkt (16).
Eine CD-ROM (ProDiät) mit einem kompletten Verzeichnis der diätetischen Produkte, einschließlich der Produkte zur enteralen Ernährung, kann 8 Wochen lang unverbindlich getestet werden. Sie ist zu beziehen über: PRESTO PRO, Verlag für Wissenschaft und Wirtschaft GmbH, Heinrich-Hertz-Straße 21 in 30966 Hemmingen (Preis 78 DM).
Literatur
- Hackl, J.M.: Anästhesiol. Intensiv. Notfallmed. Schmerzther. 1999, 33, 731.
- Sax, H.C., et al.: Med. Clin. North Am. 1993, 77, 863.
- Kortbeek, J.B., et al.: J. Trauma. 1999, 46, 992.
- Gossner, L., et al.: Endoscopy 1999, 31, 119.
- McClaves, S.A., et al.: Crit. Care Med. 1999, 27, 1252.
- Sax, H.C., et al.: Am. J. Surg. 1996, 171, 587.
- Kudsk, K.A., et al.: Ann. Surg. 1992, 215, 503.
- Heslin, M.J., et al.: Ann. Surg. 1992, 226, 567.
- Höltermann, W., et al.: Akt. Ernähr.-Med. 1993, 18, 346.
- AI-Saady, N.M., et al.: Intensive Care Med. 1989, 15, 290.
- The Veterans Affairs Total Parenteral Nutrition Cooperative Study Group: N. Engl. J. Med. 1991, 325, 525.
- Khuri, S.F., et al.: J. Am. Coll. Surg. 1997, 185, 315.
- Schwab, D., et al.: Z. Gastroenterologie 1998, 36, 983.
- Lochs, H., et al.: Gastroenterology 1991, 101, 881.
- O Morain, C., et al.: Brit. Med. J. 1984, 288, 1859.
- Daly, J.M., et al.: Ann. Surg. 1995, 221, 327.
- Schaefer, K., und Eibach, U.: Nieren- und Hochdruckkrankheiten 1999, 28, 373.