Zusammenfassung: Die Sterblichkeit beim Septischen Schock und bei vielen anderen auf der Intensivstation behandelten Krankheiten ist hoch. In seltenen Fällen sind eine unerkannte präexistente Nebennierenrinden-Insuffizienz (NNRI) oder eine im Rahmen der akuten schweren Erkrankung neu entstandene NNRI (z.B. durch Nebennierenblutung) für die Letalität verantwortlich. Diese Patienten können nur bei hochdosierter Kortikosteroid-Therapie die schwere akute Krankheit überleben. Bei schweren Infektionen und beim Septischen Schock kann aber auch durch Hemmung der Kortisolsekretion oder durch Down-Regulation der Glukokortikoid-Rezeptoren eine relative oder funktionelle, reversible NNRI auftreten. Da die Serum/Plasma-Kortisol-Konzentration bei Schwerkranken in der Regel stark erhöht ist, ist eine (eventuell relative) NNRI bei diesen Patienten schwer zu erkennen; sie unterliegt völlig anderen diagnostischen Kriterien als bei Patienten ohne zusätzlichen Krankheitsstreß. Neuere Studienergebnisse bei Patienten mit Septischem Schock lassen Serum-Kortisolwerte (unabhängig von der Tageszeit) von < 15 µg/dl und einen Anstieg des Serum-Kortisols um < 9 µg/dl nach Injektion von 250 µg Tetracosactid (Synacthen = synthetisches ACTH) bei basalen Kortisolwerten zwischen 15 und 34 µg/dl als vorläufige Hinweise auf eine NNRI unter intensivmedizinischen Bedingungen annehmen. Werden solche Patienten mit Septischem Schock mit 200 mg Hydrokortison/d 7 Tage lang behandelt, dann ist die NNT für das Überleben eines Patienten in den ersten 4 Krankheitswochen = 7. Mit Vorsicht können - mangels besserer Daten - diese Ergebnisse auch auf andere Schwerkranke übertragen werden. Patienten mit schwerem Respiratorischem Distress-Syndrom und solche mit schwerer bakterieller Meningitis können unabhängig vom Serum-Kortisolwert von einer Kortikosteroid-Therapie profitieren.
Eine schwere NNRI mit Kortisolmangel führt ohne Hormonersatz-Therapie meist schnell zum Tod, besonders, wenn während einer interkurrenten schweren Erkrankung, die eine Streßreaktion der NNR erforderlich macht, die Zunahme der Kortisol-Sekretion ausbleibt.
Ist bei einem schwer erkrankten Patienten die NNRI anamnestisch bekannt und wurde er bereits mit NNR-Hormonen substituiert, dann kann durch deutliche Erhöhung der Kortisol-Zufuhr dieser Mangel behoben werden. Die Überlebens-Chance eines solchen Patienten hängt dann im Prinzip, wie bei NNR-Gesunden, von der Prognose bzw. vom Verlauf der interkurrenten schweren Erkrankung ab.
Ist eine chronische NNRI zuvor nicht diagnostiziert worden und wird dieser Patient akut schwer krank, dann hängt sein Überleben ganz stark davon ab, ob der behandelnde Arzt jetzt aufgrund verdächtiger klinischer Symptome an die Möglichkeit einer präexistenten NNRI denkt und auf Verdacht mit einer Kortikosteroid-Therapie beginnt. Noch schwieriger wird es, wenn im Rahmen einer schweren akuten Erkrankung, z.B. nach Bauchtraumen oder, verbunden mit Koagulopathien, eine bilaterale Nebennierenblutung oder -infarzierung auftritt, wodurch die Kortisolsekretion dramatisch abfallen kann. Im fortgeschrittenen Stadium der HIV-Infektion wird die Nebenniere nicht selten von opportunistischen Erregern zerstört, so daß bei diesen Patienten immer an die Möglichkeit einer NNRI gedacht werden muß. Bei Schädel-Hirn-Traumen kann die Hypothalamus-Hypophysen-NNR-Achse im Sinne einer sekundären oder zentralen Störung insuffizient werden. Des weiteren können Medikamente, z.B. Etomidat (Etomidat-Lipuro, Hypnomidate) oder Ketoconazol (Nizoral, Terzolin) die Kortisolsekretion durch direkten Effekt auf die NNR hemmen und eine transiente NNRI verursachen. In solchen Situationen hängt das Schicksal des Patienten oft davon ab, ob der behandelnde Arzt die genannten Störungen in Erwägung zieht und eine entsprechende Diagnostik und Therapie durchführt (1-3).
Ein weiteres schwieriges Thema ist die seit einigen Jahren zunehmend diskutierte Möglichkeit, daß bei Intensivpatienten eine sog. relative oder funktionelle NNRI entsteht, besonders bei solchen mit Septischem Schock (2, 3). Beim Septischen Schock und anderen schweren Infektionen werden inflammatorische Zytokine freigesetzt, die die adrenale Kortisolsekretion hemmen können (4). Darüber hinaus kann Interleukin 10 die Sensitivität der peripheren Zielorgane für Kortisol erhöhen, während der Tumor-Nekrose-Faktor alpha das Gegenteil bewirkt, durch Downregulation der Rezeptorzahl (5).
Die Kortisol-Sekretionsrate (normal: 10-20 mg/d) steigt bei Intensivpatienten, abhängig vom Schweregrad und von der Art der Erkrankung, um das Fünf- bis Zehnfache an, und der zirkadiane adrenale Sekretionsrhythmus ist oft ganz oder teilweise aufgehoben. Auch die Serum/Plasma-Kortisol-Konzentration (bei Gesunden in den Morgenstunden normal ca. 7-23 µg/dl oder ca. 290-635 nmol/l) steigt bei den meisten Intensivpatienten stark an, oft auf Werte von 35-60 µg/dl. Normalerweise sind ca. 90-95% des Gesamt-Kortisols im Serum an Proteine gebunden, überwiegend an das Trägereiweiß Kortikosteroid-bindendes Globulin (CBG), aber locker auch an Albumin. Bei Sepsis fällt die CBG-Konzentration stark ab, so daß ein viel größerer Prozentsatz des Kortisols als freies Hormon vorliegt. Nur das freie Hormon kann die Rezeptoren in den verschiedenen Zielorganen erreichen. Die Messung des freien Kortisols ist jedoch kein für die klinische Routine zur Verfügung stehender Test, so daß man sich mit dem Gesamt-Kortisol im Serum oder Plasma zufrieden geben muß. Hat der Patient jedoch eine Hypoproteinämie, dann kann man annehmen, daß der Prozentsatz des freien Kortisols höher ist als bei normalem Gesamt-Eiweiß.
Mißt man das Serum-Kortisol bei einer Gruppe von Intensivpatienten mit ähnlichen Krankheiten und vergleicht die Werte retrospektiv bei denen, die überleben bzw. sterben, dann haben die gestorbenen Patienten in der Regel die höheren Werte gehabt. Das ist vermutlich Ausdruck der im Mittel schwereren Erkrankung bei den Versterbenden, die ihre Kortisolreserven in stärkerem Maße mobilisieren als die Überlebenden. Es spricht nichts dafür, daß das hohe Serum-Kortisol per se die Prognose der schweren Erkrankung verschlechtert. Ein für einen Intensiv-Patienten relativ niedriges Serum-Kortisol kann also bedeuten, daß er eine relativ günstige Prognose hat. Da wir den individuellen Kortisolbedarf eines Intensiv-Patienten zur Bewältigung seines Krankheitsstresses jedoch nicht kennen, kann ein relativ niedriger Kortisolwert aber auch bedeuten, daß er eine partielle NNRI hat. Dies ist das Dilemma der Kortisoldiagnostik bei Intensiv-Patienten, besonders bei solchen mit Septischem Schock.
Klinische Indikatoren einer NNRI bei Intensiv-Patienten: Eine präexistente primäre NNRI erkennt man in typischen Fällen an der anamnestischen Angabe einer Leistungsminderung mit vermehrtem Schlafbedürfnis, einer dunklen Pigmentierung der Haut, niedrigem Blutdruck, eventuell assoziierten Autoimmunkrankheiten wie Vitiligo oder aktueller bzw. früher behandelter Basedow-Hyperthyreose oder Hypothyreose. Es fallen Hyponatriämie, Hyperkaliämie, eine leichte Niereninsuffizienz (Volumenmangel) und eine Hypoglykämie-Neigung auf. Bei Intensivpatienten sind solche Befunde aber vieldeutig (1, 3).
Eine präexistente sekundäre (zentrale) NNRI verursacht ebenfalls Leistungsabfall, Müdigkeit und niedrigen Blutdruck. Die Haut ist aber eher zu wenig pigmentiert und die Körperbehaarung ist vermindert, da häufig parallel zur NNRI auch eine Gonadeninsuffizienz besteht, die bei jungen Frauen zur Amenorrhö und bei Männern zu verminderter Libido und Potenz führt (Anamnese). Es finden sich ebenfalls häufig eine Hyponatriämie und eine Hypoglykämie-Neigung, jedoch keine Hyperkaliämie, da die Aldosteronsekretion der NNR weitgehend erhalten ist (1). Bei der sekundären NNRI ist die Hyponatriämie nicht durch Natrium- und Volumenmangel, sondern durch eine Enthemmung der Vasopressinsekretion bei Kortisolmangel bedingt (6).
Ergibt sich bei einem Patienten mit Bauchtrauma oder Koagulopathie (auch bei Patienten, die Antikoagulanzien einnehmen) der Verdacht auf eine Nebennieren-Blutung oder Nebennierenvenen-Thrombose, dann kann die Diagnose durch ein CT der Nebennieren erhärtet werden (Vergrößerung und Inhomogenität der Drüsen). Eine gründliche Medikamentenanamnese (Etomidat, Ketoconazol, langzeitige Vorbehandlung mit supraphysiologischen Glukokortikoid-Dosen, Rifampicin oder Phenytoin, die den Kortisolabbau beschleunigen) kann Hinweise geben (3).
Ein allgemeines, wenn auch nicht sehr spezifisches Charakteristikum von Patienten mit NNRI auf der Intensivstation ist die arterielle Hypotension, die auch nach ausreichender Volumengabe (0,9% NaCl mit Glukose) schwer beherrschbar ist und die auf einer peripheren Vasodilatation bei hohem Herzindex (> 4 l/min/m2) beruht (7). Die pathophysiologische Grundlage hierfür ist die verminderte Reaktion der Widerstandsgefäße auf Katecholamine, da bei Kortisolmangel die alpha- und beta-adrenergen Rezeptoren vermindert sind. Ein deutlich reduzierter Katecholamin-Verbrauch nach Beginn einer Kortisol-Substitution kann deshalb als indirektes Zeichen einer bestehenden NNRI-Insuffizienz betrachtet werden (2, 3, 7).
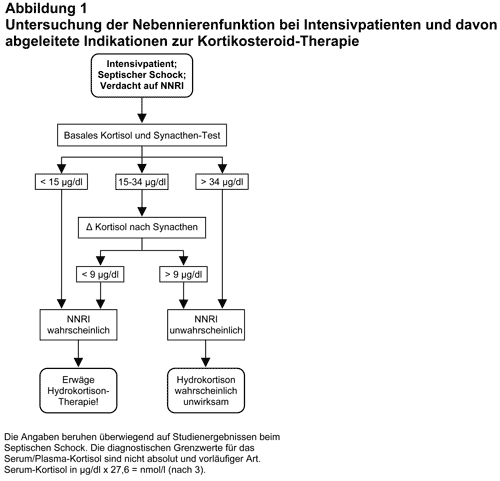
NNR-Tests bei Intensivpatienten und empirische Kortisoltherapie: Bei Verdacht auf eine primäre oder sekundäre NNRI außerhalb der Akut-Medizin gelten relativ allgemein anerkannte diagnostische Empfehlungen (1), die aber bei Intensivpatienten nicht anwendbar sind. In einer Unzahl von Veröffentlichungen sind Vorschläge zur Kortisoldiagnostik bei Intensiv-Patienten gemacht worden, aber erst in letzter Zeit gibt es Befunde und Vorschläge, die vorerst als konsensfähig betrachtet werden können. Basierend auf umfangreichen klinischen Studien an Patienten mit Septischem Schock, in denen plazebokontrolliert das Überleben mit und ohne Kortisoltherapie bei unterschiedlichen Serum-Kortisol-Konzentrationen untersucht wurde (3, 7-9) schlagen Cooper und Stewart (3) ein diagnostisches und therapeutisches Prozedere vor, das in Abb. 1 sinngemäß wiedergegeben ist. Die wichtigste diesem Schema zugrunde liegende Information ist eine Multicenter-Studie von Annane et al. (9) an 300 Patienten mit Septischem Schock, bei denen das basale Serum-Kortisol und der Kortisol-Anstieg 30 und 60 Minuten nach Injektion von Tetracosactid gemessen wurde und die anschließend doppeltblind randomisiert für 7 Tage entweder mit Hydrokortison (Schema siehe unten) oder Plazebo behandelt wurden. Bei den Patienten, deren Serum-Kortisol nach Tetracosactid (30 oder 60 Minuten) um 9 oder weniger µg/dl angestiegen war („Nonresponder“), war die Letalität 28 Tage nach Einschluß in die Studie bei Behandlung mit Hydrokortison 53%, in der Plazebo-Gruppe hingegen 63% (p = 0,02). Die Number needed to treat (NNT) zur Verhinderung des Todes innerhalb 28 Tagen bei einem Patienten war 7. Die in der Hydrokortison-Gruppe sterbenden Patienten überlebten im Durchschnitt 24 Tage, die in der Plazebo-Gruppe 12 Tage.
In der klinischen Praxis muß bei Sepsis an die Möglichkeit einer präexistenten oder neu aufgetretenen NNRI gedacht werden. Die körperliche Untersuchung und eine spezielle Anamnese können hier Hinweise geben (s.o.). Eine nach Volumen-Substitution absolut oder relativ Katecholamin-refraktäre Hypotension erhärtet den Verdacht auf eine NNRI, ist aber nicht spezifisch. Unabhängig von der Tageszeit sollte auch bei vagem Verdacht auf eine NNRI Blut für die Bestimmung von Serum-oder Plasma-Kortisol entnommen, anschließend 1 Ampulle Tetracosactid (Synacthen = 250 µg synthetisches ACTH) i.v. oder i.m. injiziert und 30 und 60 Minuten später erneut Blut für Kortisol-Messungen abgenommen werden. Nach dieser Diagnostik sollte eine Therapie mit Kortisol (= Hydrokortison) erwogen werden. In der Studie von Annane et al. (9) wurde alle sechs Stunden, also viermal in 24 Stunden, 50 mg Hydrokortison (z.B. Hydrokortison-Ampullen à 100 mg von Hoechst) 7 Tage lang i.v. injiziert. Zusätzlich wurden 50 µg 9-alpha-Fluor-Kortisol (9-alpha-FF, z.B. Astonin H) als Aldosteron-Ersatz oral gegeben. Die Gabe von 9-alpha-FF ist aber wahrscheinlich überflüssig, da große Kortisoldosen auch das Aldosteron ersetzen (1). Mit einer ähnlichen, allerdings kontinuierlich i.v. infundierten Kortisoldosis erreichten Briegel et al. (7) beim Septischen Schock auch unabhängig vom prätherapeutischen Kortisolwert eine hochsignifikante Verkürzung des Zeitraums, in dem der Blutdruck nur mit hochdosierten Katecholaminen im niedrigen Normbereich zu halten war.
Nach Eintreffen der Kortisol-Werte sollte die Fortsetzung oder der Abbruch der Hydrokortison-Therapie erwogen werden. War das Serum-Kortisol > 34 µg/dl, dann ist eine NNRI höchst unwahrscheinlich. War es (unter Intensiv-Bedingungen) < 15 µg/dl, dann ist eine NNRI wahrscheinlich. Das gleiche trifft zu, wenn das basale Serum-Kortisol zwischen 15 und 34 µg/dl lag, der Anstieg in beiden Blutproben nach Injektion von Tetracosactid aber < 9 µg/dl war. Der untere Grenzwert von 15 µg/dl ist unsicherer als die anderen Daten. Er wird aber durch neue Befunde von Diederich et al. (10) gestützt, die bei 28 Patienten mit schwerer Hyponatriämie bei Hypopituitarismus und gesicherter sekundärer NNRI basale Serum-Kortisolwerte zwischen 1 und 16 µg/dl (Mittelwert: 5,7) fanden, während andere Patienten mit schwerer Hyponatriämie (überwiegend Syndrom der inappropriaten ADH-Sekretion = SIADH) Kortisolwerte von 10-63 µg/dl (Mittelwert: 26,5) hatten.
Die Dauer einer solchen Hydrokortisontherapie ist Ermessenssache. Sie sollte vom klinischen Ansprechen und von der Wahrscheinlichkeit einer NNRI (Untersuchungsbefund, Anamnese, Kortisolwerte) abhängig gemacht werden. Bei Patienten mit Septischem Schock kann man sich an die Therapiedauer in der Studie von Annane et al. (9) halten.
Unabhängig vom Verdacht auf eine NNRI und von gemessenen Kortisolwerten sollten Patienten mit schwerem und sich unter der üblichen Therapie nicht besserndem Respiratorischem Distress-Syndrom (RDS) versuchsweise und zeitlich begrenzt mit Kortikosteroiden behandelt werden. In einer Studie von Meduri et al. (11) verbesserte die Gabe von initial 2 mg Methylprednisolon/kg Körpergewicht/d für mehr als 10 Tage bei solchen Patienten die Überlebensrate verglichen mit Plazebo. In ähnlicher Weise kann bei Erwachsenen mit bakterieller Meningitis eine früh begonnene Behandlung mit viermal 10 mg Dexamethason/d für vier Tage das Therapieergebnis verbessern (12, 13).
Einschränkungen und weitere Kortisolsubstitution bei Überlebenden: Die hier wiedergegebenen Empfehlungen basieren überwiegend auf Studien an Patienten mit Septischem Schock. Sie sind nicht ohne weiteres auf andere Intensivpatienten übertragbar, obwohl sie auch hier mangels verläßlicher Daten für solche Patienten eine Entscheidungshilfe sein können. Der Synacthen-Test liefert bei Patienten mit erst kürzlich entstandener sekundärer NNRI (z.B. nach Hypophyseninfarkt oder -blutung, nach Hypophysen-Operationen) trügerisch positive Daten, da die nicht mehr durch eigenes ACTH stimulierte NNR erst nach 2-4 Wochen atrophiert und in der Zwischenzeit noch normal auf exogenes ACTH (hier: Tetracosactid) ansprechen kann (1, 3).
Da supraphysiologische Kortisol- oder Kortikoid-Dosen die Immunabwehr supprimieren, muß bei Patienten mit Infektionen eine solche Therapie immer parallel mit einer angemessenen antibakteriellen Behandlung erfolgen. Hat ein mit Kortikosteroiden behandelter Sepsis-(Intensiv-)Patient die schwere Krankheitsphase überlebt, dann muß nach völliger Rekonvaleszenz geprüft werden, ob er an einer permanenten NNRI leidet und somit weiterhin einer (wesentlich niedriger dosierten) dauerhaften Substitutions-Therapie mit Hydrokortison (und evtl. 9-alpha-FF) bedarf. Für die Diagnose der primären NNRI sind der oben erwähnte Synacthen-Test und die zusätzliche basale Bestimmung von Plasma-ACTH und -Aldosteron die adäquate Methode, jedoch sind die diagnostischen Kriterien völlig verschieden von den weiter oben bei Intensivpatienten gemachten Angaben. Bei Verdacht auf sekundäre (zentrale) NNRI sind der Insulin-Hypoglykämie-Test oder der Metopiron-Test die Methoden der Wahl. Bei diesen Patienten müssen aber auch noch andere von der Hypophyse abhängige Hormonachsen (Schilddrüse, Gonaden, Wachstumshormon etc.) abgeklärt werden, da bei Hypophysen-Insuffizienz oft mehrere Hormone fehlen und substituiert werden müssen (1).
Die basale Substitutionsdosis von Hydrokortison bei erheblicher primärer und sekundärer NNRI außerhalb von Streß-Situationen beträgt 15-25 mg/d, aufgeteilt in 2-3 Dosen (morgens die größte Teildosis). Patienten mit primärer NNRI benötigen zusätzlich 50-200 µg 9-alpha-FF als Aldosteronersatz. In Streß-Situationen und bei Infekten muß die Hydrokortison-Dosis (nicht die von 9-alpha-FF) um das Zwei- bis Fünffache erhöht werden. Bei Erbrechen und Übelkeit muß Hydrokortison parenteral oder Prednisolon oder Hydrokortison in Form von Suppositorien verabreicht werden (nicht bei zusätzlicher Diarrhö!). Patienten mit chronischer NNRI sollten immer einen leicht auffindbaren Notfallausweis mit sich führen und/oder ein Hals- oder Armband tragen, das auf die NNRI hinweist (1, 3).
Literatur
- Oelkers, W.: N. Engl. J. Med. 1996, 335, 1206.
- Lamberts, S.W.J., et al.: N. Engl. J. Med. 1997, 337, 1285.
- Cooper, M.S., und Stewart, P.M.: N. Engl. J. Med. 2003, 348, 727.
- Catalano, R.D., et al.: Arch. Surg. 1984, 119, 145.
- Franchimont, D., et al.: J. Clin. Endocrinol. Metab. 1999, 84, 2834.
- Oelkers, W.: N. Engl. J. Med. 1989, 321, 492.
- Briegel, J., et al.: Crit. Care Med. 1999, 27, 723.
- Annane, D., et al.: JAMA 2000, 283, 1038.
- Annane, D., et al.: JAMA 2002, 288, 862.
- Diederich, S., et al.: Eur. J. Endocrinol. 2003, 148, 609.
- Meduri, G.U., et al.: JAMA 1998, 280, 159.
- Lebel, M.H., et al.: N. Engl. J. Med. 1988, 319, 964.
- de Gans, J., et al.: N. Engl. J. Med. 2002, 347, 1549.