Zusammenfassung: Die Therapieergebnisse beim Restless-legs-Syndrom sind nach wie vor unbefriedigend. Vor einer medikamentösen Behandlung sollten zugrunde liegende Erkrankungen oder Mangelzustände erkannt und behandelt werden. Levodopa und Dopaminergika sind Mittel der ersten Wahl zur Besserung der Symptome. Bei höheren Dosen und bei Langzeitgebrauch ist unter Levodopa bei 30-60% und unter Dopaminergika bei 10% der Patienten mit einer Verschlechterung der Symptome zu rechnen („iatrogene Augmentation“). Verschiedene, meist teure und für diese Indikation nicht zugelassene Alternativen, wie Antikonvulsiva oder Opioide, können bei Patienten, die nicht oder schlecht auf Levodopa oder Dopaminergika angesprochen haben, nach entsprechender Aufklärung und Beachtung der Nebenwirkungen versucht werden.
Nach Angaben der deutschen Gesellschaft für Neurologie soll das Restless-legs-Syndrom (RLS; auch Willis-Ekbom-Syndrom) mit einer altersabhängigen Prävalenz von 3-10% zu den häufigsten neurologischen Störungen zählen (1). Nach Definition der „International RLS Study Group“ (IRLS), die die Diskussion um diese Störung stark dominiert, gibt es vier „essentielle Diagnosekriterien“ für ein RLS:
- Bewegungsdrang der Beine (evtl. auch der Arme), meist in Zusammenhang mit unangenehmen Missempfindungen in der betroffenen Extremität,
- Auftreten bzw. Verstärkung der Beschwerden in Ruhe,
- Besserung der Beschwerden bei Bewegung,
- Zunahme der Beschwerden abends oder nachts.
Hinzu kommen sog. „diagnoseunterstützende Kriterien“ wie das Ansprechen auf 100 mg Levodopa (sog. L-Dopa-Test), eine positive Familienanamnese für RLS oder der Nachweis periodischer Beinbewegungen mittels Polysomnografie (1).
Der Schweregrad eines RLS wird in den meisten Studien mittels eines Symptomscores der IRLS gemessen. Dabei werden zehn Symptome abgefragt und mit insgesamt maximal 40 Punkten bewertet (1). Man unterscheidet ein mildes RLS (1-10 Punkte), ein mittelschweres (11-20 Punkte), ein schweres (21-30 Punkte) und ein sehr schweres RLS (31-40 Punkte). Auch Therapieeffekte werden mit Hilfe der Punkteverschiebungen auf der IRLS-Skala bewertet.
Über die Genese des RLS ist noch wenig bekannt. Da dopaminerge und opioidartig wirkende Arzneimittel Linderung bringen, geht man von einer Störung auf der Ebene dieser Neurotransmitter aus. Neben einer idiopathischen Form mit Familienanamnese wird eine sekundäre Form unterschieden, die mit verschiedenen Komorbiditäten einhergeht: Eisen- oder Vitaminmangel, Störungen der Schilddrüsenfunktion, fortgeschrittene Nierenerkrankungen, Polyneuropathien, Radikulo- und Myelopathien, Friedreich-Ataxie, Zöliakie, Diabetes mellitus sowie rheumatische und onkologische Erkrankungen. Auch Arzneimittel können ein RLS auslösen bzw. verschlechtern. Genannt werden Antidepressiva (z.B. Citalopram, Mirtazapin, Sertralin, Paroxetin, Mianserin, Lithium), Antipsychotika (z.B. Clozapin, Fluoxetin, Haloperidol, Olanzapin, Quetiapin, Risperidon), Interferon alfa, L-Thyroxin, Östrogene, Phenytoin, Saccharin, Simvastatin u.a. Bei Behandlung mit Antipsychotika wird eine ihrer typischen Nebenwirkungen, die Akathisie, leicht mit RLS verwechselt. Dabei handelt es sich um eine sehr qualvolle Bewegungsstörung. Die Patienten können nicht still sitzen und müssen ständig hin und her laufen. Auch eine Verwechslung mit dem ADHS von Kindern und Jugendlichen ist möglich, wobei auch hier der Zeitbezug fehlt. Eine Komorbidität von RLS und ADHS wird allerdings in der Literatur erwähnt (2).
Da die Diagnose und Quantifizierung eines RLS von vielen als „nebulös“ angesehen und in Behandlungsstudien stets ein deutlicher Plazeboeffekt gefunden wird, ist immer wieder der Verdacht geäußert worden, dass es sich beim RLS um eine „erfundene Erkrankung“ handelt, deren medikamentöse Behandlung primär den pharmazeutischen Unternehmern nutzt (3). Mit dieser Sichtweise wird man der Störung, die auch schon Kinder und Jugendliche betreffen kann, jedoch nicht gerecht. Diese Kritik mahnt jedoch, eher zurückhaltend und sehr umsichtig mit den vorgeschlagenen Arzneimitteln umzugehen und immer wieder Nutzen und Risiken – auch im Verlauf – abzuwägen. Viele Patienten mit RLS benötigen oder wollen nämlich gar keine medikamentöse Behandlung, und Langzeitdaten zur Effektivität und Sicherheit der medikamentösen Therapie fehlen.
Medikamentöse Therapie: Die Therapie des RLS ist selten kausal, d.h. überwiegend an den Symptomen orientiert. Zunächst wird empfohlen, dass nach möglichen Auslösern gesucht wird, etwa einem Eisenmangel (Ziel: Ferritin > 50 µg/l), Schlafstörungen oder spätem Kaffeegenuss. Der Effekt dieser Empfehlungen ist jedoch nicht klar. So wird beispielsweise der Nutzen einer Eisensubstitution bei RLS, auch bei Mangelzuständen, in einem Cochrane Review aus dem Jahre 2012 in Zweifel gezogen (4). Potenziell ungünstige Medikamente (s.o.) sollten zumindest vorübergehend pausiert werden. Kontrollierte Studien zu nicht-medikamentösen Therapiemaßnahmen, wie Hydrotherapie, Massagen oder Dehnungsübungen, liegen unseres Wissens nicht vor. Da diese Maßnahmen jedoch selten Schaden anrichten und die Patienten aktiv in die Therapie einbinden, sollte man sie zumindest begleitend empfehlen. Ziel der medikamentösen Behandlung ist eine höhere Schlaf- und Lebensqualität.
Levodopa in Kombination mit dem Decarboxylasehemmer Benserazid (Restex®, Restex retard®, 100/25 mg oder 200/50 mg) wird derzeit am häufigsten bei RLS angewendet. Die Patienten können sich mit der kurzwirksamen Form eine rasche Linderung verschaffen und mit der retardierten Form einen längeren oder vorbeugenden Effekt erzielen. Nach einem Cochrane Review aus dem Jahre 2011 reduziert Levodopa im Vergleich zu Plazebo die Symptome eines RLS im Vergleich zu Plazebo um ca. 10% und erhöht die Lebens- und Schlafqualität, nicht jedoch die Schlafdauer (5). Der positive Therapieeffekt wird mit Nebenwirkungen erkauft: Etwa 40% der Patienten brechen eine Therapie mit Levodopa innerhalb eines halben Jahres wegen Unwirksamkeit oder Nebenwirkungen ab (v.a. Übelkeit). Klinisch bedeutsam ist die „iatrogene Augmentation“: Bei längerer Anwendung und höheren Dosen (> 200-300 mg/d) können die Beschwerden bei bis zu 60% der Patienten zunehmen. Insbesondere treten dabei die Symptome um Stunden früher am Tag auf, und sie können sich auf andere Körperregionen ausdehnen (1).
Nicht-ergoline Dopaminergika wie Pramipexol (Sifrol®), Ropinirol (Adartrel®) und Rotigotin als Pflaster (Neupro®) sind teure Alternativen zu Levodopa und bei mittelschweren und schweren Symptomen (IRLS ≥ 15) zugelassen (1). Dopaminagonisten wurden in viel mehr Studien untersucht als Levodopa. Die Wirksamkeit wird in einem Cochrane Review als moderat bezeichnet (Reduktion auf der 40-Punkte-IRLS-Skala gegenüber Plazebo um durchschnittlich 5,7 Punkte; 6). Die Dauer der Nachbeobachtung betrug in den 35 Studien sehr unterschiedlicher Qualität maximal ein Jahr. Über längere Anwendung ist wenig bekannt. Ein Vorteil der Dopaminergika gegenüber Levodopa ist, dass die Augmentation nicht so häufig eintritt (5-10%). Etwa jeder fünfte Patient bricht die Therapie mit Dopaminagonisten jedoch innerhalb eines Jahres wegen Wirkungslosigkeit, -verlust und Nebenwirkungen ab. Häufig sind Schlafstörungen und Übelkeit. Orthostatische Hypotension, Benommenheit und psychische Veränderungen (z.B. Kauf-, Spiel- oder Esssucht, Libidosteigerung) kommen selten vor, sind jedoch zu beachten. Vergleichende Studien zu den verschiedenen Dopaminagonisten gibt es nicht.
Ergoline Dopamin-Rezeptoragonisten wie Pergolid und Cabergolin sind ebenfalls untersucht und als wirksam befunden worden. Sie haben jedoch wegen der möglichen kardialen Nebenwirkungen (Herzklappenfibrose und -sklerose) ein ungünstiges Nutzen-Risiko-Verhältnis und sollten daher nicht verwendet werden (7).
Wegen der vielen Nebenwirkungen von Levodopa und Dopaminagonisten werden immer wieder Alternativen gesucht. Eine mögliche könnten Antikonvulsiva sein. Unter diesen sind Pregabalin und Gabapentin bisher am besten in kontrollierten Studien untersucht worden (1). Gabapentin ist in den USA seit 2011 für die Indikation RLS zugelassen. In Europa gibt es für beide Medikamente noch keine Zulassung in dieser Indikation, d.h. die Anwendung bei RLS erfolgt als „Off-Label-Use“.
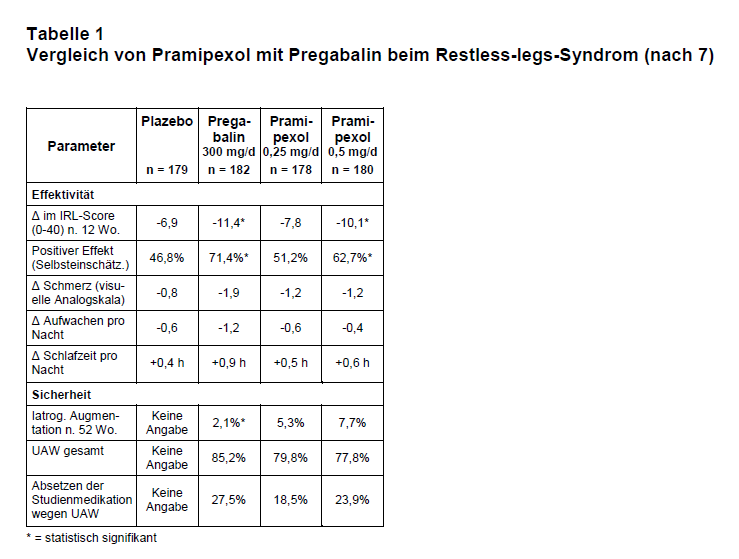
Pfizer, der Hersteller von Pregabalin (Lyrica®), versucht, das nun zu ändern und hat eine multinationale randomisierte kontrollierte Studie durchführen lassen (8). Darin wurde untersucht, ob Pregabalin beim RLS gleich stark wirksam ist wie der Dopaminagonist Pramipexol („non-inferiority“) und wie häufig es unter beiden Wirkstoffen zu einer iatrogenen Augmentation kommt. Insgesamt wurden 719 Patienten an 102 Zentren in Nordamerika und Europa eingeschlossen. Die im N. Engl. J. Med. publizierte Studie ist mit Skepsis zu betrachten. Der Erstautor hat nämlich nur den ersten Entwurf der Publikation verfasst; alle weiteren Fassungen wurden dann „mit der Unterstützung eines medizinischen Autors, der von Pfizer bezahlt wurde“, geschrieben, also von einem professionellen Ghostwriter (vgl. 9).
Die Patienten wurden zunächst in vier Gruppen randomisiert und erhielten doppelblind 12 Wochen lang entweder 300 mg/d Pregabalin, 0,25 mg/d Pramipexol, 0,5 mg/d Pramipexol oder Plazebo. Nach den 12 Wochen wurde die Plazebo-Gruppe geschlossen und die Patienten zu gleichen Teilen in die drei Verum-Arme verteilt, um die Häufigkeit von Nebenwirkungen über weitere 40 Wochen zu erfassen. Eingeschlossen wurden Patienten, die bereits mindestens sechs Monate lang an RLS litten und in mindestens 15 Nächten pro Monat Symptome hatten (mittlerer IRLS-Score 22,3 Punkte). Es nahmen überwiegend Frauen teil, das mittlere Alter betrug 54 Jahre, und das RLS bestand seit durchschnittlich fünf Jahren. Primärer Endpunkt war die Wirksamkeit von Pregabalin gegenüber Plazebo nach drei Monaten.
Pregabalin besserte die RLS-Symptome signifikant stärker als Plazebo (Unterschied etwa 25% oder 4,5 Punkte auf der IRLS-Skala; vgl. Tab. 1), und die Lebens- und Schlafqualität wurden positiv beeinflusst. Auch Pramipexol schnitt besser ab als Plazebo, statistisch signifikant jedoch nur mit der höheren Dosierung. Quantitativ waren die Effekte von 0,5 mg/d Pramipexol und 300 mg/d Pregabalin bei den meisten abgefragten Symptomen etwa gleich (Tab. 1).
Eine Augmentation wurde in allen drei Behandlungsarmen in den ersten Monaten sehr selten beobachtet (< 2%). Nach einem halben Jahr trat dieses Phänomen jedoch in den Pramipexol-Gruppen häufiger auf: nach einem Jahr gaben 7,7% bzw. 5,3% eine Verschlechterung der Symptome an, aber nur 2,1% in der Pregabalin-Gruppe. Hier scheint also Pregabalin einen Vorteil zu haben. Andere Nebenwirkungen waren insgesamt sehr häufig (80%; s. Tab. 1) und mit Pregabalin häufiger als mit Pramipexol. Die Abbruchrate betrug bei Pregabalin 27,5%; sie lag signifikant höher als bei Pramipexol (18,5% mit 0,25 mg/d bzw. 23,9% mit 0,5 mg/d). Am häufigsten waren bei Pregabalin Schwindel (21,4%), Somnolenz (17,6%), Müdigkeit (12,6%) und Kopfschmerzen (12,1%). Bei 0,5 mg/d Pramipexol traten am häufigsten Kopfschmerzen (19,4%), Übelkeit (14,4%) und Müdigkeit (12,2%) auf. Sechs Patienten in der Pregabalin-Gruppe äußerten Suizidgedanken, drei in der Gruppe mit 0,25 mg/d Pramipexol und zwei mit 0,5 mg/d Pramipexol. Pregabalin scheint also mehr psychische Nebenwirkungen auszulösen und hat bekanntermaßen ein Abhängigkeitspotenzial (10). Daher sollte es nach unserer Einschätzung nur ausgewählten Patienten ohne Therapiealternativen oder solchen mit ausgeprägter Augmentation durch ein Dopaminergikum vorbehalten sein.
Eine Alternative 2. Wahl zu Levodopa oder Dopaminergika sind Opioide, wie beispielsweise Oxycodon, Tramadol, Methadon oder Tilidin. Opioide werden besonders nach iatrogener Augmentation und bei schmerzhaften Polyneuropathien mit RLS angewendet. Zu Tramadol und Methadon liegen nur wenige und kleine Studien bzw. Fallserien vor, so dass hierzu keine Empfehlung abgegeben werden kann. Zu Oxycodon ist die Datenlage etwas besser.
In der jüngst publizierten doppelblinden RELOXYN-Studie wurde an 306 Patienten mit RLS und mangelnder Symptomkontrolle unter Standardtherapie mit Levodopa oder Dopaminergika die Wirksamkeit von retardiertem Oxycodon-Naloxon (Targin®) gegenüber Plazebo getestet (11). Die Studie wurde von Mundipharma bezahlt, dem Hersteller des teuren Targin®. Die Kombination des Opioids mit Naloxon soll eine Obstipation verhindern (s.a. 12). Die Symptome der Patienten verbesserten sich mit dem individuell titrierten Opioid (mittlere tägliche Oxycodon-Dosis 21 mg/d) auf der IRLS-Skala innerhalb von drei Monaten um 16,5 ± 11,3 Punkte (mit Plazebo um 9,4 ± 10,9 Punkte). Nebenwirkungen, die auf die Studienmedikation zurückgeführt wurden, traten in den ersten drei Monaten bei 73% der Patienten mit Oxycodon-Naloxon auf und bei 43% mit Plazebo. Eine iatrogene Augmentation wurde während der einjährigen Nachbeobachtungszeit nicht gefunden.
Diese neueren Ergebnisse zeigen insgesamt, dass es eine generell gut wirksame und dabei gut verträgliche Dauertherapie des RLS noch nicht gibt. Ein für den individuellen Patienten geeignetes Medikament kann eigentlich nur durch „trial and error“ gefunden werden. Nach unserer Auffassung handelt es sich weder beim Pregabalin noch beim Oxycodon/Naloxon generell um einen wesentlichen therapeutischen Fortschritt, könnte aber bei einzelnen Patienten vorteilhaft sein. Auch viele weitere Substanzen, die beim RLS überprüft wurden, darunter Tetrabenazin, Clonazepam und Levetiracetam, können mangels Studienevidenz nicht empfohlen werden. Am Ende bleibt die medikamentöse RLS-Behandlung meist unbefriedigend und es sollte – wie stets – dem Patienten möglichst kein Schaden entstehen.
Literatur
- Restless-Legs-Syndrom (RLS) und Periodic Limb Movement Disorder(PLMD): S1 Leitlinie der Deutschen Gesellschaft für Neurologie. Link zur Quelle
- Feldman, H.M., und Reiff, M.I.: N. Engl. J. Med. 2014, 370,838. Link zur Quelle
- Spence, D.: BMJ 2013, 347, f7615. Link zur Quelle
- http://summaries.cochrane.org/ CD007834/ iron-for-restless-legs-syndromeLink zur Quelle
- http://summaries.cochrane.org/ CD005504/ levodopa-for-restless-legs-syndrome#sthash.NUFEUu3F.dpuf Link zur Quelle
- http://summaries.cochrane.org/ CD006009 /dopamine-agonists-for-restless-legs-syndrome Link zur Quelle
- AMB 2007, 41, 30. Link zur Quelle
- Allen, R.P., et al.: N. Engl. J. Med. 2014, 370, 621. Link zur Quelle
- AMB 2002, 36, 22c Link zur Quelle . AMB2012, 46, 59. Link zur Quelle
- AMB 2011, 45, 29. Link zur Quelle
- Trenkwalder,C., et al. (RELOXYN): Lancet Neurol. 2013, 12, 1141. Link zur Quelle Erratum:Lancet Neurol. 2013, 12, 1133.
- AMB 2009, 43, 65 Link zur Quelle . AMB 2011, 45, 65. Link zur Quelle