Die in den letzten Jahren rasch steigenden Preise für neue onkologische Wirkstoffe sind in Europa und vor allem in den USA sehr kritisch kommentiert worden (1, 2). Wir sind 2013 auf das Profitstreben der pharmazeutischen Unternehmer (pU) eingegangen und haben – am Beispiel der damals zugelassenen, teilweise miteinander konkurrierenden Tyrosinkinase-Inhibitoren (TKI) zur Behandlung der chronischen myeloischen Leukämie (CML) – die sehr unterschiedlichen Jahrestherapiekosten von drei TKI in verschiedenen Ländern und Kontinenten dargestellt (3, 4).
Eine aktuelle Untersuchung von Wissenschaftlern aus dem National Cancer Institute in den USA liefert jetzt weitere Belege für das unseriöse Vorgehen der pU bei der Preissetzung für neue Arzneimittel zur Behandlung solider Tumore und hämatologischer Neoplasien (5). Die Autoren haben alle onkologischen Arzneimittel, die vom 1. Januar 2009 bis zum 31. Dezember 2013 von der Food and Drug Administration (FDA) zugelassen wurden, identifiziert und dann analysiert, ob der durch diese Arzneimittel erzielte therapeutische Fortschritt mit dem Preis korreliert. Insgesamt wurden in dem genannten Zeitraum von der FDA 51 Arzneimittel für 63 onkologische Indikationen zugelassen. In einer Tabelle sind die zuletzt zugelassenen 20 Arzneimittel mit ihren Indikationen aufgelistet. Die Tabelle informiert auch über Jahrestherapiekosten, Wirkungsmechanismus und klinischen Nutzen der Arzneimittel sowie den ersten in der jeweiligen Arzneimittelklasse zugelassenen Wirkstoff. Der Nutzen bzw. therapeutische Fortschritt wird anhand der Endpunkte in den für die Zulassung relevanten klinischen Studien („pivotal trials“) dargestellt: Ansprechrate (response rate = RR), Dauer des Ansprechens (duration of response = DOR), progressionsfreies Überleben (progression-free survival = PFS) und Gesamtüberleben (overall survival = OS). Die Lektüre der Tabelle ist sehr zu empfehlen, da sie den häufig marginalen Nutzen neuer onkologischer Arzneimittel mit Verlängerung von PFS oder OS um nur wenige Wochen oder Monate gegenüber dem jeweiligen Komparator verdeutlicht.
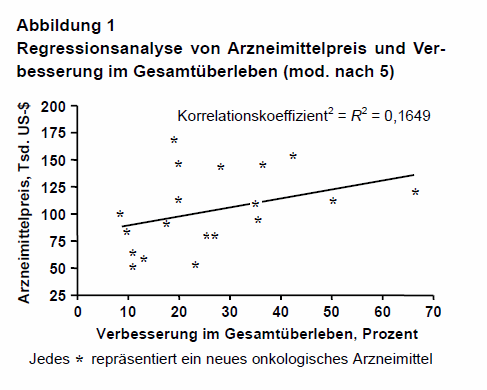
Von den 51 Arzneimitteln hatten 21 (41%) einen neuen Wirkmechanismus, wohingegen 30 (59%) als Nachfolgepräparate („next-in-class“ Arzneimittel) zu bezeichnen sind. Die Zulassung für die insgesamt 63 Indikationen basierte bei jeweils 22 Arzneimitteln (35%) auf der RR bzw. dem PFS und bei 19 (30%) auf dem OS. Für Arzneimittel mit primärem Endpunkt RR wurden die höchsten Preise verlangt – mittlere Jahrestherapiekosten 137.952 US-$. Demgegenüber waren die Preise für Arzneimittel, die basierend auf Ergebnissen zum OS oder PFS zugelassen wurden, signifikant niedriger (112.370 US-$ bzw. 102.677 US-$). Bemerkenswerterweise fand sich kein Unterschied in den mittleren Jahrestherapiekosten zwischen Arzneimitteln, die über einen neuartigen Wirkmechanismus (116.000 US-$) verfügen und Arzneimitteln, die als Nachfolgepräparate (119.765 US-$) zu bezeichnen waren. Auch zwischen dem Ausmaß des durch diese Arzneimittel erzielten therapeutischen Fortschritts – ermittelt anhand der signifikanten Verbesserung des PFS oder OS – und dem für die Arzneimittel vom pU verlangten Preis bestand keine Korrelation (5).
Diese aktuelle Analyse aus den USA bestätigt die fehlende Korrelation zwischen Innovationsgrad, d.h. neuartiges Wirkprinzip oder Nachfolgepräparat („next-in-class“) mit häufig nur marginalen Unterschieden zu den bereits eingeführten onkologischen Wirkstoffen, dem bei Zulassung belegten klinischen Nutzen und der Höhe der von pU verlangten Preise (1, 2, 5; vgl. Abb. 1). Die Ergebnisse widerlegen auch die von pU häufig genannten Gründe für die sehr hohen Kosten neuer onkologischer Arzneimittel – Ausgaben für Forschung und Entwicklung – und verdeutlichen eindrucksvoll, dass die aktuelle Preisgestaltung nicht rational erfolgt, sondern in erster Linie widerspiegelt, was der Markt bereit ist zu zahlen (1, 5).
Auf unbeabsichtigte, aber sehr negative Auswirkungen der heute meist exorbitanten Preise onkologischer Wirkstoffe wurde kürzlich hingewiesen: Die Entwicklung einer Vielzahl lukrativer, ähnlicher Wirkstoffe mit marginalem Nutzen – auch als „Me-too“-Mentalität bezeichnet – behindert die Entwicklung echter, patientenrelevanter Innovationen und die Kreativität in der klinischen Forschung (6).
Es ist jetzt Aufgabe von Ärzten, Krankenkassen und Gesundheitspolitikern, aber auch der Gesellschaft insgesamt, darüber nachzudenken, wie dieser Profitmaximierung der pU zu Lasten individueller Patienten und unseres solidarisch finanzierten Gesundheitssystems wirksam begegnet werden kann.
Fazit: Eine aktuelle Analyse der in den USA von der FDA zwischen 2009 und 2013 zugelassenen onkologischen Arzneimittel ergibt keine Korrelation zwischen Innovationsgrad bzw. klinischem Nutzen und von pharmazeutischen Unternehmern bei Markteintritt verlangtem Preis. Die bereits 2013 von onkologischen Experten in den USA geäußerte Vermutung – vor allem ein abgekartetes Verhalten der pharmazeutischen Unternehmer mit dem Ziel, ein kollektives Monopol aufrechtzuerhalten, sei für die derzeit exorbitanten Preise onkologischer Arzneimittel verantwortlich (1) – wird somit bestätigt.
Literatur
- Kantarjian, H.M., etal.: J. Clin. Oncol. 2013, 31, 3600. Link zur Quelle
- Aggarwal, A., et al.:J. Cancer Policy 2014, 2, 1. Link zur Quelle
- Experts in chronicmyeloid leukemia: Blood 2013, 121, 4439. Link zur Quelle
- AMB 2013, 47,33. Link zur Quelle
- Mailankody, S., undPrasad, V.: JAMA Oncol. 2015; Online April 2. Link zur Quelle
- Fojo, T., et al.: JAMAOtolaryngol. Head Neck Surg. 2014, 140, 1225. Link zur Quelle