Mit großem Mediengetöse und in einträchtiger Zusammenarbeit der US-amerikanischen Zulassungsbehörde FDA mit dem pharmazeutischen US-Unternehmer (pU) Gilead wurden schnell noch zum Welt-AIDS-Kongress 2012 die Wirkstoffe Tenofovir disoproxilfumarat (TDF) und Tenofovir/Emtricitabin (TDF/FTC) zur Prophylaxe der HIV-Infektion zugelassen (1). Vom pU, den US-amerikanischen Centers for Disease Control and Prevention, von einigen deutschen Fachgesellschaften und den Massenmedien wurde dies als ein großer Fortschritt eingestuft. Wir hatten bereits früher auf Schwachpunkte in den Zulassungsstudien hingewiesen sowie auf die mit einer HIV-Chemoprophylaxe verbundenen Probleme, vor allem auf die mögliche Resistenzentwicklung des HIV (2). Nun wurden die Ergebnisse von drei Prophylaxe-Strategien aus drei afrikanischen Ländern mit hoher HIV-Inzidenz veröffentlicht (3).
Von September 2009 bis Juni 2011 wurden 12.320 Frauen aus 15 Bezirken in Südafrika, Uganda und Simbabwe im Alter von 18-45 Jahren für die Studie gescreent. Teilnehmen konnten nur nicht-schwangere Frauen sowie Frauen, die nicht stillten und solche, die angaben, in letzter Zeit vaginalen Geschlechtsverkehr gehabt zu haben sowie effektiv zu verhüten. Darüber hinaus mussten das Blutbild, die Nieren- und die Leberfunktion normal sein. Zum Zeitpunkt des Eintritts in die Studie durfte keine HIV-Infektion vorliegen. 5.029 Frauen wurden eingeschlossen. Die Studie war prospektiv, randomisiert (1:1:1:1:1) und plazebokontrolliert. Die Teilnehmerinnen der fünf Gruppen bekamen folgende Prophylaxe bzw. Plazebo:
Gruppe 1: TDF (300 mg) oral jeden Tag, zusätzlich Plazebo,
Gruppe 2: TDF/FTC (300/200 mg) oral jeden Tag, zusätzlich Plazebo,
Gruppe 3: TDF/FTC-Plazebo oral jeden Tag,
Gruppe 4: 1%iges TDF-Gel vaginal,
Gruppe 5: Plazebo-Gel vaginal.
Alle Frauen wurden über Einzelheiten der Studie und über die Verwendung von Kondomen aufgeklärt. Eine Hepatitis-B-Impfung wurde angeboten. Außerdem wurde auf andere sexuell übertragbare Erkrankungen getestet. Die Studientherapie wurde abgebrochen, wenn eine Frau schwanger wurde. HIV-Tests wurden monatlich durchgeführt. Endpunkt der Studie war eine neu erworbene HIV-Infektion. Die Studie war für eine individuelle Dauer von längstens 36 Wochen vorgesehen, wurde aber mit Ausnahme der Behandlung im TDF/FTC-Arm vorzeitig wegen Wirkungslosigkeit abgebrochen (im September 2011 Abbruch der TDF oral-Gruppe, im November 2011 Abbruch der TDF-Gel-Gruppe).
Die Merkmale waren in den Gruppen etwa gleich. Das mediane Alter betrug in den Gruppen 24-25 Jahre. Die durchschnittliche Häufigkeit des vaginalen Geschlechtsverkehrs wurde mit 2,5-2,6/Woche angegeben und 83%-87% hatten beim letzten Geschlechtsverkehr Kondome verwendet. Zum Beginn der Studie waren 21% der Frauen verheiratet. Im Median hatten die Teilnehmerinnen 1,5-1,6 lebende Kinder zur Welt gebracht.
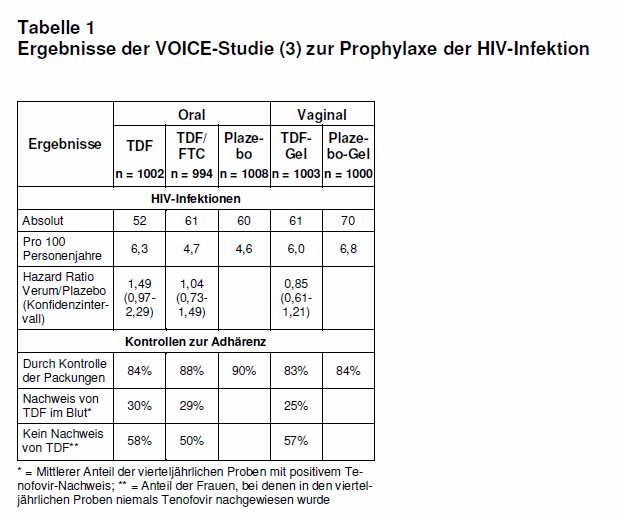
Die wichtigsten Ergebnisse zur Wirksamkeit der Prophylaxe und zur Adhärenz sind in Tab. 1 nach Gruppen getrennt aufgeführt. Die Inzidenz der HIV-Infektion betrug insgesamt 5,7/100 Personenjahre und war zwischen den verschiedenen Gruppen nicht signifikant unterschiedlich. Allen Frauen, die sich während der Studie infiziert hatten, wurde eine adäquate antiretrovirale Therapie angeboten.
Erhöhte Kreatininwerte wurden häufiger bei den Frauen gefunden, die messbare TDF-Spiegel hatten. Frauen im Alter > 25 Jahre, verheiratet oder Multipara infizierten sich seltener mit dem HIV als ganz junge, ledige Frauen ohne Kinder.
Die Adhärenz zur HIV-Prophylaxe bzw. Plazebo wurde mit verschiedenen Methoden abgeschätzt: Persönliche Befragungen, Kontrolle der verbrauchten und nicht verbrauchten Tablettenpackungen bzw. der nicht verbrauchten Gel-Applikatoren sowie vierteljährlich abgenommene Blutproben zum Nachweis von TDF (vgl. Tab. 1).
Die Ergebnisse der VOICE-Studie zur HIV-Prophylaxe sind ernüchternd und die Gründe hierfür vielfältig. Es wird diskutiert, dass die Adhärenz zur Studienmedikation offenbar schlecht gewesen ist, wie die stichprobenartigen Überprüfungen von TDF im Blut zeigen (vgl. Tab. 1). Nachbefragungen haben ergeben, dass persönliche und gesellschaftliche Verhaltensweisen, eine generelle Angst vor AIDS und vor Nebenwirkungen der Arzneimittel sowie mangelnde Aufklärung eine Rolle gespielt haben könnten (4, vgl. Editorial bei 5). Die Argumente hierfür sind aber nicht in allem überzeugend, denn die Ergebnisse der TDF-Spiegel-Messungen könnten unter den nicht optimalen Bedingungen in tropischen Ländern auch falsch niedrig sein. Außerdem war die Zahl der verbrauchten Pillen mit ca. 90% sehr hoch. Das negative Ergebnis dieser Studie ist nicht nur auf die Unzuverlässigkeit der afrikanischen Frauen hinsichtlich der Anwendung der HIV-Prophylaxe zurückzuführen, sondern vermutlich vor allem auf die unzureichende prophylaktische Wirksamkeit von TDF und TDF/FTC.
Fazit: In der alltäglichen Situation in afrikanischen Ländern mit hoher HIV-Inzidenz war die bisher zugelassene HIV-Chemoprophylaxe mit Tenofovir bzw. Tenofovir/Emtricitabin bei Frauen in der VOICE-Studie nicht wirksam. Einer der Gründe hierfür war die angeblich mangelnde Akzeptanz der täglich anzuwendenden Prophylaxe und somit eine geringe Adhärenz. Daneben muss aber auch eine mangelnde Wirksamkeit der Tenofovir-basierten HIV-Prophylaxe diskutiert werden.
Literatur
- http://www.fda.gov/ NewsEvents/Newsroom/PressAnnouncements/ucm312210.htm Link zur Quelle
- AMB 2012, 46,61. Link zur Quelle
- Marrazzo, J.M., et al.(VOICE =Vaginal and Oral Interventions to Controlthe Epidemic): N. Engl. J. Med. 2015, 372, 509. Link zur Quelle
- van der Straaten, A., et al.: J.Int. AIDS Soc. 2014, 17Suppl. 2, 19146 Link zur Quelle
- Saag, M.S.: N. Engl.J. Med. 2015, 372, 564. Link zur Quelle