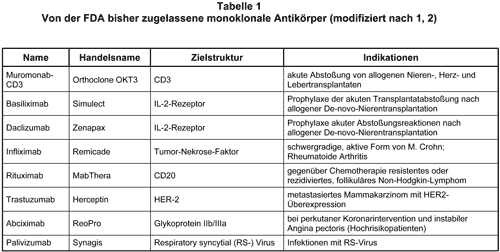
Das therapeutische Potential monoklonaler Antikörper (moAK) ist seit vielen Jahren bekannt, konnte jedoch erst in den letzten Jahren auf Grund von Fortschritten in ihrer gentechnologischen Herstellung besser genutzt werden (Übersicht in 1). Im Unterschied zu moAK der Maus haben chimäre (antigenbindender Fab-Anteil der Maus verbunden mit humanem Fc-Anteil) oder vollständig humanisierte moAK wichtige Vorteile. Hierzu gehören insbesondere die stärkere Bindung an humane Fc-Rezeptoren (Voraussetzung für verschiedene Effektorfunktionen des moAK), die längere Halbwertzeit im Serum und eine geringere Immunogenität.
Bis heute sind von der Food and Drug Administration (FDA) in den USA 8 moAK (s. Tab. 1) zur Behandlung verschiedener Erkrankungen zugelassen worden, und etwa 75 befinden sich in klinischer Erprobung (2). Einsatzgebiete der z.T. auch in Europa bereits zugelassenen moAK betreffen die Hemmung der alloimmunen (z.B. nach Nierentransplantation) oder autoimmunen Reaktivität (z.B. rheumatoide Arthritis, M. Crohn; vgl. AMB 1998, 32, 6a und 1999, 33, 61b), die Hemmung der Thrombozytenfunktion (vgl. AMB 1999, 33, 33), die antivirale und die antitumoröse Therapie.
An die bisher zur Behandlung des Mammakarzinoms bzw. follikulärer Non-Hodgkin-Lymphome (NHL) zugelassenen moAK werden besonders hohe Erwartungen in der Onkologie geknüpft. Auf erste klinische Ergebnisse mit Trastuzumab sind wir kürzlich eingegangen (vgl. AMB 1999, 33, 14). Der gegen das CD20-Antigen auf B-Lymphozyten gerichtete, unkonjugierte chimäre moAK Rituximab (Mabthera) wurde von der FDA im November 1997 und von der europäischen Arzneimittelagentur (EMEA) im Juni 1998 zur Behandlung von Patienten mit follikulärem NHL im Stadium III oder IV zugelassen, die gegen eine Chemotherapie resistent sind oder einen zweiten oder neuerlichen Rückfall erlitten haben. Das CD20-Antigen spielt eine wichtige Rolle bei der Aktivierung und Proliferation von B-Lymphozyten. Es wird mit Ausnahme der unreifen B-Vorläuferzellen und Plasmazellen von allen Reifungsstufen der B-Zell-Entwicklung und deshalb, in allerdings unterschiedlicher Dichte, auch von nahezu allen B-Zell-NHL exprimiert. Nach Bindung des moAK an CD20 kommt es nicht zur Internalisierung oder zum „Shedding“ (Abgabe des Antigens ins Serum), eine wichtige Voraussetzung für die gute Wirksamkeit dieses moAK. Der genaue Wirkungsmechanismus des moAK ist noch unklar. Diskutiert werden vor allem zytotoxische Mechanismen vermittelt durch Komplement- oder Antikörper-abhängige Zytotoxizität und Auslösung von Apoptose. In der für die Zulassung durch die FDA entscheidenden multizentrischen Phase-II-Studie wurden insgesamt 166 Patienten mit refraktären oder rezidivierten niedrigmalignen, vorwiegend follikulären NHL, behandelt, von denen 48% ansprachen (komplette Remission 6%, partielle Remission 42%; 3). In dieser Studie lag nach insgesamt 4 wöchentlichen Gaben von Rituximab die mediane Dauer bis zum Progreß der Erkrankung bei 13 Monaten. Inzwischen sind weitere Phase-II-Studien durchgeführt worden, in denen etwa 500 Patienten mit unterschiedlichen Subtypen der NHL (niedrig- und hochmaligne) und unterschiedlichen Dosen (meistens 4 wöchentliche Gaben von 375 mg/m2 Rituximab) behandelt wurden (Übersicht in 4). Die Ansprechraten auf Rituximab variierten, abhängig vom histologischen Subtyp, der Phase der Erkrankung (primäre Therapie oder Behandlung refraktärer bzw. rezidivierter Patienten) und der begleitenden Therapie (z.B. Polychemotherapie) zwischen 21 und 90%. Leider wird in diesen unkontrollierten Studien häufig nur über vorläufige Ergebnisse mit unzureichender Beobachtungsdauer berichtet, so daß viele Fragen zum Stellenwert dieses moAK im Behandlungskonzept der NHL (z.B. Wirksamkeit bei verschiedenen Subtypen der NHL im Vergleich zur Standardtherapie, optimale Dosierung und zeitliche Abfolge der Rituximab-Gabe, verbesserte Wirksamkeit durch Kombination mit Chemotherapie) noch unbeantwortet sind.
Obwohl die Verträglichkeit von Rituximab in den meisten Phase-II-Studien sehr gut war, sind inzwischen auch schwerwiegende, z.T. sogar lebensbedrohliche unerwünschte Arzneimittelwirkungen (UAW) mitgeteilt worden. Diese UAW waren in erster Linie auf eine verstärkte Freisetzung inflammatorischer Zytokine („Cytokine release syndrome“) zurückzuführen und führten, insbesondere während der ersten Infusion von Rituximab, zu Fieber, Schüttelfrost, Rigor, Urtikaria, Angioödem und schwerer Dyspnoe, begleitet von Bronchospasmus und/oder Hypoxie (5). Auch über Tumorlyse-Syndrome wurde berichtet (5). Diese schwerwiegenden UAW veranlaßten Roche, Hersteller von Mabthera in Deutschland, in die Produktinformation zusätzliche Vorsichtsmaßnahmen (u.a. stationäre Behandlung, Prämedikation mit Paracetamol und Diphenhydramin, besondere Vorsicht beim Einsatz von Rituximab bei Patienten mit hoher Tumorlast) aufzunehmen. Kürzlich wurde in einer weiteren Phase-II-Studie auch über Arrhythmien und Nebenwirkungen am Auge (z.B. Konjunktivitis) bei knapp 10% der mit Rituximab behandelten Patienten berichtet (6).
Fazit: Rituximab ist eine interessante, allerdings sehr teure neue Therapieoption für Patienten mit CD20-positiven Non-Hodgkin-Lymphomen (Kosten etwa 650 DM pro 100 mg Rituximab, d.h. etwa 15600 DM pro Therapiezyklus). Die bisher durchgeführten Phase-II-Studien zeigen eine gute Wirksamkeit dieses moAK bei verschiedenen Subtypen der NHL, erlauben jedoch keine endgültigen Aussagen zum Stellenwert von Rituximab im Therapiekonzept maligner B-Zell-Lymphome und zur langfristigen Sicherheit des moAK. Ergebnisse der in Europa und den USA begonnenen Phase-III-Studien liegen bisher nicht vor. Auf Grund der z.T. schwerwiegenden UAW, insbesondere während der ersten Infusion, und der sehr hohen Therapiekosten sollte die Anwendung des moAK nur für die zugelassene Indikation oder aber im Rahmen kontrollierter klinischer Studien erfolgen.
Literatur
1. Breedveld, F.C.: Lancet 2000, 355, 735.
2. Levy, R.: J. Clin. Oncol. 1999, 17 Suppl.,, 7.
3. McLaughlin, P., et al.: J. Clin. Oncol. 1998, 16, 2825.
4. Press, O.W.: Education Program Book, ASH, 1999.
5. Byrd, J.C., et al.: J. Clin. Oncol. 1999, 17, 791.
6. Foran, J.M., et al.: J. Clin. Oncol. 2000, 18, 317.