Von nichtsteroidalen Antiphlogistika (NSAID) ist gut bekannt, dass sie über mehrere Mechanismen den systemischen Blutdruck erhöhen bzw. die Wirkung von Antihypertensiva abschwächen können [1], [2]. Paracetamol gilt in dieser Hinsicht als kardiovaskulär vergleichsweise risikoärmeres Schmerzmittel, ist aber unzureichend untersucht: Es gibt zahlreiche Beobachtungsstudien (s.u.) sowie statistisch nicht ausreichend „gepowerte“ Interventionsstudien mit widersprüchlichen Ergebnissen [3]. Ob diese Einschätzung wirklich zutrifft, sollte unbedingt geklärt werden angesichts des vielerorts freien Verkaufs von Paracetamol, der weltweit überaus häufigen Anwendung als Erstbehandlung bei chronischen Schmerzen und möglicher hepatischer Nebenwirkungen selbst in therapeutischer Dosierung (vgl. [4]). Klärungsbedarf besteht zudem, weil Paracetamol in seiner analgetischen Potenz nach Ergebnissen neuerer Studien bislang deutlich überschätzt worden ist, speziell bei Rücken- und Arthrose-Schmerzen [5], [6], [7], [8], [9]), sodass das Verhältnis von Nutzen und Risiken bei längerer Anwendung wohl neu beurteilt werden muss.
Eine schottische Arbeitsgruppe führte von September 2014 bis Juni 2019 eine randomisierte, plazebokontrollierte, doppelblinde Crossover-Studie durch, in der die Wirkungen von Paracetamol auf die Blutdruckwerte bei Personen mit Hypertonie gemessen wurden (PATH-BP; [10]). Die „British Heart Foundation“ finanzierte die Studie, hatte jedoch keinen Einfluss auf das Design sowie Erhebung, Analyse und Interpretation der Daten.
Studiendesign: Die Teilnehmer mussten ≥ 18 Jahre alt sein, mehr als 55 kg wiegen und eine arterielle Hypertonie haben. Am Tag des Einschlusses musste der durchschnittliche ambulante Tages-Blutdruck unbehandelt oder unter stabiler Dosierung eines oder mehrerer Antihypertensiva ≥ 135/85 mm Hg betragen, jedoch < 150/95 mm Hg. Während der Studienphasen durfte die antihypertensive Medikation nicht geändert werden. Ausgeschlossen wurden Patienten mit einer Vorgeschichte von koronarer Herzkrankheit, Herzinsuffizienz, zerebrovaskulärer Erkrankung, Leberfunktionsstörung (Alanin-Aminotransferase = GPT > 50 IE/l), chronischer Nierenerkrankung im Stadium 3-5 sowie solche, die regelmäßig Paracetamol, NSAID, Glukokortikosteroide oder orale Antikoagulanzien einnahmen. Sie erhielten randomisiert 2 Wochen lang täglich viermal 1 g Paracetamol in Hartgelatine-Kapseln (zu vernachlässigender Natriumgehalt von je 0,04 mg) oder ein im Aussehen entsprechendes Plazebo (Maisstärke), gefolgt von einer zweiwöchigen Auswaschphase, bevor sie zu der jeweils anderen 14-tägigen Behandlung wechselten.
Zu Beginn und am Ende jeder Behandlungsperiode wurden ambulant die 24-Stunden-Blutdruckwerte (tagsüber alle 30 Min., nachts stündlich) und auch in der Klinik bei 2 von insgesamt 4 Visiten die Blutdruckwerte (am Arm der nichtdominanten Hand) gemessen. Bei den Visiten zu Beginn und an Tag 14 wurden außerdem Harnstoff, Elektrolyte, Bilirubin, alkalische Phosphatase und Alaninaminotransferase (ALT) und zur Kontrolle der Compliance die Paracetamol-Konzentration im Blut gemessen.
Der primäre Endpunkt war der Vergleich der Veränderung des mittleren systolischen ambulanten Tages-Blutdrucks nach zweiwöchiger Behandlung mit Paracetamol im Vergleich zu Plazebo. Die vorab festgelegten sekundären Endpunkte waren die Veränderung des mittleren diastolischen ambulanten Tages-Blutdrucks, des mittleren systolischen 24-Stunden-Blutdrucks, des mittleren diastolischen 24-Stunden-Blutdrucks sowie der Vergleich der Veränderungen bei den in der Klinik gemessenen Werten.
Die Autoren schätzten, dass insgesamt 110 Patienten rekrutiert werden mussten, um einen Unterschied von 1,6 mm Hg in der Änderung des systolischen Blutdrucks zwischen der Paracetamol- und Plazebo-Gruppe bei Verwendung eines zweiseitigen, gepaarten Student-t-Tests mit einem Signifikanzniveau von 5% nachzuweisen und einer „Power“ von 90% unter der Annahme einer Standardabweichung der Differenz von 4,9 mm Hg und einer „Dropout-Rate“ von 10%. Darüber hinaus wurde eine Per-Protocol-Analyse durchgeführt, basierend auf der Compliance mit der Studienmedikation, d.h. mit Messungen der Paracetamol-Spiegel im Serum. Compliance wurde definiert als ein nicht messbarer Paracetamol-Spiegel (< 3 mg/l) während der gesamten Plazebo-Phase und zu Beginn der Paracetamol-Phase sowie ein nachweisbarer Paracetamol-Spiegel bei der letzten Messung (als der Blutdruck bewertet wurde) und bei mindestens einem der beiden anderen Zeitpunkte während der Behandlungsdauer.
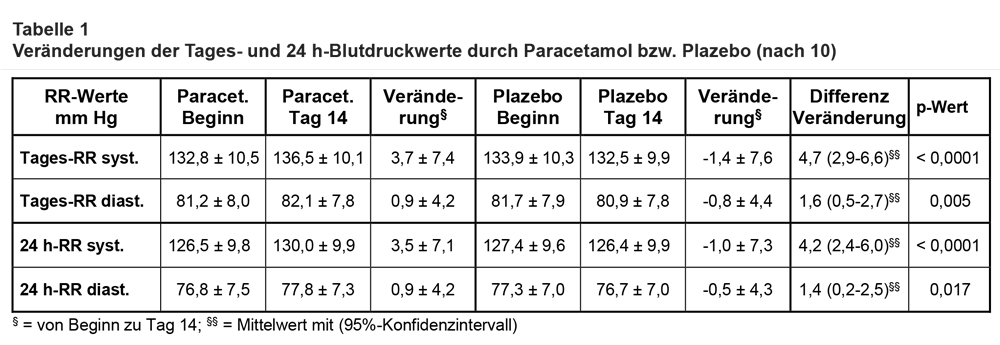
Ergebnisse: Es wurden insgesamt 204 Teilnehmer rekrutiert, von denen 110 (je 55) in die Studiengruppen eingingen. Sieben Teilnehmer schlossen die beiden Studienphasen nicht komplett ab (< 10%). Die beiden Studiengruppen waren in ihren Charakteristika ausgewogen (40 vs. 44 weiße Männer; mittleres Alter 60,9 ± 7,8 vs. 62,5 ± Jahre; gleicher Raucherstatus; unter antihypertensiver Therapie n = 39 vs. 35; unter Statin-Therapie n = 15 vs. 13). Die wesentlichen Ergebnisse sind in Tab. 1 wiedergegeben. Sie zeigen, dass Paracetamol in der verwendeten (hohen) Dosierung über 14 Tage und unter Verwendung unterschiedlicher Messmodalitäten den systolischen Blutdruck mit hoher statistischer Signifikanz beträchtlich (zwischen 4 und 5 mm Hg) und den diastolischen Blutdruck gering steigert. Fast ein Drittel der Teilnehmer hatten Blutdruckanstiege von ≥ 10 mm Hg und einige sogar ≥ 25 mm Hg. Die Blutdruckanstiege fanden sich in ähnlicher Weise auch bei den in der Klinik ermittelten Werten. Sie zeigten sich ab Tag 4 nach Beginn der Studienmedikation und hielten bis zum Tag 14 an. Eine Post-hoc-Analyse ergab, dass die Blutdruckanstiege bei den Teilnehmern mit unbehandelter und behandelter Hypertonie gleich waren. Die Adhärenz mit der Studienmedikation war offenbar befriedigend, denn bei 87% der Teilnehmer waren am Ende der Verumphase Paracetamol-Spiegel messbar. Bei den biochemischen Parametern ergaben sich keine wesentlichen Unterschiede außer einem statistisch signifikanten leichten Anstieg der ALT unter Paracetamol, der sich aber 2 Wochen nach Ende der Medikation normalisierte.
Diskussion: Die Path-BP-Studie ist unseres Wissens die erste, in der die Effekte von Paracetamol auf den Blutdruck bei Teilnehmern untersucht wurden, die keine Indikation für ein Schmerzmittel hatten. Die Medikation diente nur dem Zweck, Antworten auf die in der Studie gestellten Fragen zu bekommen. Das verstärkt die Validität der Ergebnisse, denn schmerz- und Paracetamol-bedingte Blutdrucksteigerungen sind bei der Interpretation kaum zu differenzieren. Das Design der Studie wurde auch in einem begleitenden Editorial als aussagekräftig gelobt [11].
Die Dosierung von Paracetamol in dieser Studie ist an der Grenze zur toxischen Tageshöchstdosis. Es erhebt sich im Hinblick auf mögliche kardiovaskuläre Konsequenzen des Blutdruckanstiegs die Frage, wie viele Patienten in der Bevölkerung Paracetamol in dieser Dosis chronisch einnehmen und ob dies angesichts beschränkter Wirksamkeit überhaupt indiziert ist. Darüber kann wahrscheinlich nur spekuliert werden. Für die USA wird geschätzt, dass 3-5% der Erwachsenen regelmäßig Paracetamol einnehmen [12] und sogar etwa 8%, bei denen eine Hypertonie neu diagnostiziert wird [13]. Mehrere Beobachtungsstudien fanden eine Assoziation von langfristiger Einnahme von Paracetamol mit einem erhöhten Risiko für die Entwicklung einer Hypertonie (3). In der prospektiven „Nurses’ Health Study II“ mit 80.030 Teilnehmerinnen errechnete sich bei dieser Konstellation ein relatives Risiko, Hypertonie zu entwickeln, von 2,0 (95%-Konfidenzintervall = CI: 1,5-2,6) mit Hinweis auf eine Dosis-Wirkungs-Beziehung [14]. Das Risiko ist fast gleich mit dem bei Einnahme von NSAID: 1,9 (CI: 1,5-2,3; [15]), wobei die Pathomechanismen unklar sind. Im Gegensatz zu diesen Ergebnissen fand eine aktuellere retrospektive Beobachtungsstudie mit „Propensity Matching“ keinen Zusammenhang zwischen regelmäßiger Einnahme von Paracetamol und Hypertonie [16].
Die Autoren spekulieren auf der Basis der von ihnen gefundenen Steigerung des systolischen Blutdrucks um 4,7 mm Hg durch Paracetamol und den Daten aus zwei früheren Studien zur Assoziation von hypertensiven Blutdruckwerten und der Häufigkeit kardiovaskulärer Ereignisse, dass dies eine Steigerung kardiovaskulärer Ereignisse um etwa 20% bedeuten könnte [17], [18]. Ob diese Schlussfolgerung jedoch zutrifft, müssten entsprechende Studien belegen.