Frage von Dr. W. G. aus Hamburg: >> Wie hoch sind die Äquivalenzdosen der in Deutschland erhältlichen Protonenpumpen-Hemmer? << Antwort: >> Zur Zeit sind in Deutschland fünf Protonenpumpen-Inhibitoren (PPI) zugelassen: Omeprazol (Antra MUPS und viele Generika), Lansoprazol (Agopton, Lanzor), Pantoprazol (Pantozol, Rifun), Rabeprazol (Pariet) und Esomeprazol (Nexium mups). Sie alle sind Benzimidazol-Derivate und unterscheiden sich nicht wesentlich in der Pharmakokinetik und -dynamik. Ihre Wirkung beruht auf der Blockade der Parietalzellen-H+/K+-ATPase; sie führt zu einer Hemmung der gastralen Säuresekretion. Vom Omeprazol, dem ältesten und am besten untersuchten PPI werden die häufigsten, vor allem Zytochrom-P450-vermittelten Wechselwirkungen mit anderen Medikamenten beschrieben. Omeprazol und Pantoprazol sind zur Zeit als einzige PPI für die parenterale Applikation erhältlich. Ende letzten Jahres wurde Esomeprazol zugelassen, ein linksdrehendes Isomer des Razemats Omeprazol.
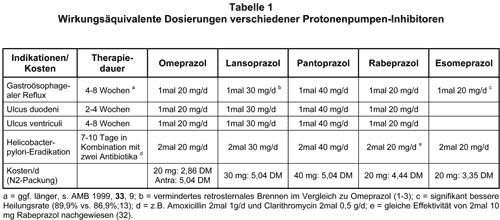
Die Überlegenheit der PPI gegenüber Plazebo und H2-Antagonisten bei den Indikationen Ulcus duodeni, Ulcus ventriculi, Refluxösophagitis und Helicobacter-pylori-Eradikation wurde in zahlreichen Veröffentlichungen belegt. In den letzten Jahren erschienen neben Dosisfindungs-Studien für die einzelnen PPI auch 34 Publikationen, in denen die PPI in unterschiedlichen Dosierungen gegeneinander getestet wurden. Dabei war Omeprazol überwiegend die Vergleichssubstanz. Die mittels Medline-Recherche über Wirkstoff und Indikation erfaßten Studien wurden überwiegend in kleinen, weitgehend unbekannten Zeitschriften publiziert, denn die wissenschaftlichen Erkenntnisse durch die Studienergebnisse sind gering. Im Gegensatz dazu haben die Herstellerfirmen jedoch ein großes Interesse an der Veröffentlichung vergleichender Studien, um ihr Präparat auf dem Markt zu lancieren. Die in Tab. 1 dargestellten Äquivalenzdosierungen der fünf PPI stützen sich auf die vergleichbare Wirkung in Bezug auf klinische Parameter, wie Beschwerdefreiheit, Ulkusabheilung und die mikrobiologisch oder mittels 13C-Atemtest überprüfte Eradikationrate.
Refluxösophagitis: 5 Studien mit 1766 Patienten verglichen Omeprazol 20 mg/d mit Lansoprazol 30 mg/d über eine Therapiedauer von 4-8 Wochen bei Refluxösophagitis (1-5). Die Abheilungsrate der Ösophagitis war gleich hoch, jedoch besserten sich die Beschwerden in 3 dieser Studien bei Patienten, die mit Lansoprazol behandelt wurden, etwas rascher (1-3). Omeprazol 20 mg/d war Lansoprazol 15 mg/d im Hinblick auf Abheilung und Linderung der Beschwerden signifikant überlegen (3). In 2 weiteren Studien wurde Omeprazol in einer Dosis von 40 mg/d verabreicht. Im Vergleich mit Lansoprazol 30 mg/d fand sich kein signifikanter Unterschied (6), im Vergleich zu Lansoprazol 60 mg/d waren die mit Omeprazol behandelten Patienten tendenziell schneller beschwerdefrei (7). Nach Gabe von Omeprazol 20 mg/d oder Pantoprazol 40 mg/d ergab sich kein signifikanter Unterschied bei 814 Patienten bezüglich Abheilung und Beschwerden (8-10). Zum gleichen Ergebnis führte die Medikation mit Omeprazol 20 mg/d oder Rabeprazol 20 mg/d bei 514 randomisierten Patienten (11, 12). Im Rahmen einer Multizenterstudie mit 1960 Patienten wurde Esomeprazol 40 mg/d, Esomeprazol 20 mg/d oder Omeprazol 20 mg/d verordnet. Die Unterschiede in den Heilungsraten waren gering: 94,1%, 89,9% bzw. 86,9% (13).
Zur Rezidivprophylaxe von Ösophagitiden erwies sich Omeprazol 40 mg/d gegenüber Lansoprazol 60 mg/d und Pantoprazol 80 mg/d nach 4 Wochen als signifikant überlegen (14); nach 48 Wochen zeigten sich Omeprazol 20 mg/d und Lansoprazol 30 mg/d als ebenbürtig (15), und innerhalb von 52 Wochen fanden sich keine Unterschiede zwischen Omeprazol 20 mg/d und Rabeprazol 10 mg/d bzw. Rabeprazol 20 mg/d (16).
Eradikation von Helicobacter pylori, Therapie des Ulcus duodeni und Ulcus ventriculi: Omeprazol 20 mg/d oder Lansoprazol 30 mg/d war bezüglich Eradikations- und Heilungsrate bei 683 randomisierten Patienten gleichwertig (17-20). Omeprazol 40 mg/d und Lansoprazol 30 mg/d führte mit der gleichen Häufigkeit zur Abheilung eines Ulcus duodeni bei 251 Patienten (21). Ebenso sind Omeprazol 40 mg/d, Lansoprazol 60 mg/d hinsichtlich Eradikations- und Heilungsrate etwa gleich wirksam (20, 22-24). Nur in einer Studie zeigte sich unter Lansoprazol 60 mg/d gegenüber Omeprazol 40 mg/d ein geringer Vorteil in der Häufigkeit der Eradikation (22). Omeprazol 80 mg/d und Lansoprazol 60 mg/d waren gleich wirksam (25).
In zwei Studien wurden 537 Patienten mit aktivem Duodenalulkus randomisiert und zwei bis vier Wochen lang entweder mit Omeprazol 20 mg/d oder Pantoprazol 40 mg/d behandelt. Dabei zeigten sich keine Unterschiede hinsichtlich Heilungsrate und Beschwerdefreiheit (26, 27). Zum gleichen Ergebnis kam eine Studie mit 219 Patienten bei Ulcus ventriculi (28). Zur Eradikation von Helicobacter pylori erwiesen sich Omeprazol 40 mg/d und Pantoprazol 80 mg/d als gleichwertig und signifikant wirksamer als Pantoprazol 40 mg/d (29).
Dekkers et al. publizierten zwei Multizenterstudien mit 432 Patienten, in denen die Abheilungsrate bei Ulcus duodeni bzw. ventriculi durch die Gabe von Omeprazol 20 mg/d und Rabeprazol 20 mg/d gleich war. Patienten, die Rabeprazol erhalten hatten, waren jedoch signifikant schneller beschwerdefrei (30, 31). Eine japanische Studie wies eine gleiche Eradikationsrate unter Omeprazol 40 mg/d bzw. Rabeprazol 40 mg/d nach (24). In dieser Studie wurde auch Lansoprazol 60 mg/d mit Rabeprazol 40 mg/d verglichen; es zeigten sich keine signifikanten Unterschiede in der Eradikationsrate. Derselbe Autor veröffentlichte im darauffolgenden Jahr eine Studie mit 308 Probanden, die zeigt, daß im Rahmen einer Tripeltherapie mit Lansoprazol 60 mg/d bzw. Rabeprazol 40 mg/d gleich häufig eine Eradikation (ca. 85%) erreicht wird wie mit Rabeprazol 20 mg/d (32). Beim Vergleich von Lansoprazol 30 mg/d mit Pantoprazol 40 mg/d fanden sich ebenfalls keine Unterschiede in der Eradikationsrate (33). Das gleiche gilt für die Therapie mit Omeprazol 40 mg/d bzw. Esomeprazol 40 mg/d (34).
Eine Anmerkung zu Esomeprazol: Obwohl der Chiralitätswechsel (theoretisch) eine günstigere stereoselektive Pharmakokinetik bewirkt, zeigt sich Esomeprazol in klinischen Studien dem Omeprazol in gleicher Dosierung allenfalls marginal überlegen. Nur in doppelter Dosierung war Esomeprazol deutlich wirksamer als Omeprazol. Omeprazol (Antra), dessen Patent 1999 abgelaufen ist und dessen Marktanteile durch die Generika unter Druck geraten sind, kommt wie Esomeprazol (Nexium) übrigens vom gleichen Hersteller. Nexium kostet in Apotheken zwei Drittel des Preises von Antra. Überdies wird aus einigen Berliner Krankenhausapotheken berichtet, daß Nexium zur Einführung für 40 Pfennig/Tablette zu beziehen sei, während Antra jetzt teuer bezahlt werden muß (ca. DM 3,00/Tbl.). Wenn das keine gute Marketingstrategie ist! << Literatur
1. Mee, A.S., et al.: Aliment. Pharmacol. Ther. 1996, 10, 757.
2. Hatlebakk, J.G., et al.: Scand. J. Gastroenterol. 1993, 28, 224.
3. Castell, D.O., et al.: Am. J. Gastroenterol. 1996, 91, 1749.
4. Vcev, A., et al.: Acta Med. Croatica 1997, 51, 171.
5. Cordova-Villalobos, J.A., et al.: Rev. Gastroenterol. Mex. 1996, 61, 306.
6. Mulder, C.J., et al.: Eur. J. Gastroenterol. Hepatol. 1996, 8, 1101.
7. Fass, R., et al.: Aliment. Pharmacol. Ther. 2000, 14, 1595.
8. Mossner, J., et al.: Aliment. Pharmacol. Ther. 1995, 9, 321.
9. Corinaldesi, R., et al.: Aliment. Pharmacol. Ther. 1995, 9, 667.
10. Vcev, A., et al.: Acta Med. Croatica 1999, 53, 79.
11. Dekkers, C.P., et al.: Aliment. Pharmacol. Ther. 1999, 13, 49.
12. Delchier, J.C., et al.: Scand. J. Gastroenterol. 2000, 35, 1245.
13. Kahrilas, P.J., et al.: Aliment. Pharmacol. Ther. 2000, 14, 1249.
14. Jaspersen, D., et al.: Aliment. Pharmacol. Ther. 1998, 12, 49.
15. Carling, L., et al.: Aliment. Pharmacol. Ther. 1998, 12, 985.
16. Thjodleifsson, B., et al.: Dig. Dis. Sci. 2000, 45, 845.
17. Chang, F.Y., et al.: J. Gastroenterol. Hepatol. 1995, 10, 595.
18. Petite, J.P., et al., Gastroenterol. Clin. Biol. 1993, 17, 334.
19. Ekstrom P et al.: Scand. J. Gastroenterol. 1995, 30, 210.
20. Miwa, H., et al.: J. Gastroenterol. Hepatol. 1999, 14, 317.
21. Dobrilla, G., et al.: Clin. Ther. 1999, 21, 1321.
22. Spinzi, G.C., et al.: Aliment. Pharmacol. Ther. 1998, 12, 433.
23. Misiewicz, J.J., et al.: Gut 1997, 41, 735.
24. Miwa, H., et al.: Aliment. Pharmacol. Ther. 1999, 13, 741.
25. Kayser, S., et al.: Schweiz. Med. Wochenschr. 1997, 127, 722.
26. Beker, J.A., et al.: Eur. J. Gastroenterol. Hepatol. 1995, 7, 407.
27. Rehner, M., et al.: Aliment. Pharmacol. Ther. 1995, 9, 411.
28. Witzel, L., et al.: Aliment. Pharmacol. Ther. 1995, 9, 19.
29. Catalano, F., et al.: Helicobacter 1999, 4, 178.
30. Dekkers, C.P., et al.: Aliment. Pharmacol. Ther. 1998, 12, 789.
31. Dekkers, C.P., et al.: Aliment. Pharmacol. Ther. 1999, 13, 179.
32. Miwa, H., et al.: Dig. Dis. Sci. 2000, 45, 77.
33. Cammarota, G., et al.: Eur. J. Gastroenterol. Hepatol. 1999, 11, 247.
34. Veldhuyzen Van Zanten, S., et al.: Aliment. Pharmacol. Ther. 2000, 14, 1605.