Zusammenfassung: Gegen die Infektion mit dem Hepatitis-B-Virus kann man sich durch gut verträgliche Impfungen sehr wirksam schützen. In Deutschland leben geschätzt 70.000 Menschen mit einer chronischen Hepatitis-B-Infektion. Wenn auch die Inzidenz der Hepatitis B in Deutschland zurückgegangen ist, unterstützten wir die Empfehlung der Ständigen Impfkommission (STIKO), alle Säuglinge und Kleinkinder gegen Hepatitis B zu impfen, um die Inzidenz weiter zu senken und weil die Erkrankung in dieser Altersgruppe häufiger schwer verläuft (1, 2). Bei den meisten Infizierten (> 90%) verläuft die Infektion klinisch unauffällig und wird immunologisch kontrolliert durch Antikörper (Anti-HBs), so dass – ein intaktes Immunsystem vorausgesetzt – keine weitere Gefahr besteht. Bei einem kleinen Teil (< 10%) der Patienten verläuft die Infektion jedoch chronisch mit Virusreplikation (Nachweis von HBV-DNA und/oder HBsAg) und häufig mit chronischen Entzündungsreaktionen in der Leber. Diese Patienten können eine Leberzirrhose und/oder ein Leberzellkarzinom entwickeln. Deshalb werden Patienten mit chronisch replikativer Hepatitis B heute in der Regel behandelt. Zur Verfügung stehen Interferon alfa sowie mehrere direkt antivirale Wirkstoffe aus der Gruppe der Nukleosid- und Nukleotid-Analoga. Gemäß den Leitlinien sind unterschiedliche Indikationen und Vorgehensweisen zu beachten. Patienten mit nicht-replikativer, immunologisch kontrollierter Infektion (Anti-HBs positiv), die wegen einer malignen oder autoimmunen Erkrankung eine komplexe immunsuppressive Therapie erhalten sollen, sollten präemptiv antiviral therapiert werden, weil die Hepatitis B reaktiviert werden kann.
Einleitung: Die Hepatitis B ist eine durch Blut und Geschlechtsverkehr übertragbare Viruserkrankung (vgl. 1, 2). Der Erreger, 1970 entdeckt, ist ein umhülltes DNA-Virus (HBV). Die Hülle enthält das lipidhaltige HBV-Oberflächenantigen (HBsAg), dessen Nachweis im Serum für die Diagnose wichtig ist und das auch zur Herstellung des Impfstoffs verwendet wird. Das Genom des Virus wird im Verlauf der Infektion in das Wirtsgenom integriert und verbleibt dort dauerhaft, auch wenn die Erkrankung klinisch ausheilt.
Die akute HBV-Infektion verläuft bei ca. 0,5-1% der ungeimpften Erwachsenen fulminant bis tödlich, wobei einige durch eine rechtzeitig durchgeführte Lebertransplantation überleben können. 80-90% der Infizierten bilden Antikörper gegen das HBsAg (Anti-HBs), wodurch die Infektion – immunologisch kontrolliert – ohne gravierende klinische Folgen verläuft, es sei denn, das Immunsystem wird durch andere Einflüsse erheblich beeinträchtigt. Viele dieser Patienten bemerken von der Infektion wenig oder gar nichts.
Ein kleiner Teil der Patienten (10%) entwickelt nach der akuten Infektion eine chronisch replikative Hepatitis B (HBsAg positiv und/oder HBV-DNA-Nachweis im Blut). Man spricht von chronischer Hepatitis B, wenn die Replikation des HBV sechs Monate nach der akuten Infektion noch besteht. Bei Patienten mit chronisch replikativer Hepatitis B steigt mit zunehmender Dauer auch das Risiko, eine Leberzirrhose und/oder ein hepatozelluläres Karzinom (HCC) zu entwickeln. Beide Folgeerkrankungen sind schwer zu behandeln und mit hoher Letalität verbunden. Im Rahmen einer chronischen HBV-Infektion können auch lebensbedrohliche Autoimmunerkrankungen durch zirkulierendes HBsAg auftreten, häufig auch ohne erhöhte Leberenzyme. Eine der möglichen Autoimmunerkrankungen bei chronischer Hepatitis B ist die Polyarteriitis nodosa.
Die WHO schätzt die Zahl der infizierten Menschen auf weltweit 240 Mio. (2). In Europa geht man von ca. 13 Mio., in Deutschland von ca. 70.000 chronisch Infizierten aus (ca. 1% der Bevölkerung). In Deutschland werden jährlich zwischen 1.000 und 6.000 Neuerkrankungen gemeldet (1997-2014), in den letzten Jahren allerdings nur noch zwischen 1.000 und 2.000/Jahr. Es besteht eine namentliche Meldepflicht für den Krankheitsverdacht, die Erkrankung sowie den Tod (1).
In den letzten Jahren hat sich gezeigt, dass selbst bei Personen mit immunologisch kontrollierter HBV-Infektion, also mit Antikörpern gegen das HBsAg (Anti-HBs), eine Reaktivierung erfolgen kann, wenn das Immunsystem supprimiert wird. Diese Patienten unterscheiden sich von Geimpften dadurch, dass sie neben Anti-HBs auch Antikörper gegen das Kern-Antigen des HBV (Anti-HBc) gebildet haben, was auf eine durchgemachte Infektion hinweist. Die immunologisch kontrollierte, aber latente HBV-Infektion kann reaktiviert werden, wenn diese Personen (aus unterschiedlicher Indikation) eine immunsuppressive Therapie erhalten. Dies betrifft besonders Therapieformen, die gegen die B-Zellen gerichtet sind (z.B. Rituximab). Die Reaktivierung verläuft häufig fulminant und häufig sogar letal. Deshalb wurden in die S3-Leitlinie zur Prophylaxe, Diagnostik und Therapie der Hepatitis-B-Virusinfektion (3) Empfehlungen für eine präemptive Therapie aufgenommen für Patienten mit latenter chronischer HBV-Infektion und geplanter immunsuppressiver Therapie (s.u.).
Prävention: Impfung und Impfschutz: Die Infektion mit dem HBV kann durch eine komplette Impfung sehr wirksam verhindert werden. Die Impfung ist gut verträglich.
Empfehlung für Erwachsene: Die Ständige Impfkommission (STIKO; 1) empfiehlt die Impfung gegen Hepatitis B für besonders gefährdete Personengruppen, also auch für Personen mit erhöhtem beruflichem Expositionsrisiko, beispielsweise Ärzte, Krankenschwestern und Pfleger und Ersthelfer. Auch bestimmte Patientengruppen wie HIV-Infizierte, Dialysepatienten, Kontaktpersonen zu an Hepatitis B Erkrankten sowie Personen mit infektionsriskantem Sexualverhalten sollen geimpft werden.
Empfehlung für Kinder/Kleinkinder/Säuglinge: Das Erkrankungsrisiko für Säuglinge aus Familien ohne HBV-Risiken ist relativ niedrig; trotzdem empfiehlt die STIKO seit 1995 die Hepatitis-B-Impfung für alle Säuglinge und Kleinkinder. Dies hat mehrere nachvollziehbare Gründe. Zum einen besteht bei Säuglingen und Kleinkindern ein besonders hohes Risiko für einen chronischen Verlauf (bis zu 90%) mit der Gefahr, dass sich eine Leberzirrhose und/oder ein Leberzellkarzinom entwickeln. Zum anderen hat diese Empfehlung das Ziel, die Inzidenz der Hepatitis B in Deutschland zu senken, was in der einheimischen Bevölkerung wohl auch erreicht wurde. In Deutschland stehen für Säuglinge monovalente und gut akzeptierte Kombinationsimpfstoffe zur Verfügung, so dass eine große Zahl von Kindern erreicht wird. Die Impfung gegen Hepatitis-B wird von der STIKO als Standardimpfung für alle Kinder empfohlen. Bei Verwendung von 6-fach-Kombinationsimpfstoffen mit Pertussiskomponente werden zur Grundimmunisierung vier Impfstoffdosen im Alter von 2, 3, 4 und 11 bis 14 Monaten empfohlen. Bei Verwendung eines Hepatitis-B-Einzelimpfstoffs kann die Impfung im Alter von 3 Monaten entfallen, d.h. es reichen drei Impfstoffdosen aus. Ist keine Grundimmunisierung im Säuglingsalter erfolgt, sollte die Impfung vor dem 18. Geburtstag nachgeholt werden. Für Erwachsene (Indikationsimpfung) wird die Impfung mit drei Dosen nach dem Schema 0-1-6 Monate durchgeführt (1).
Schwangere: Schwangere sollten auf jeden Fall auf HIV und HBV getestet werden. Bei beiden Infektionen kann durch eine entsprechende antivirale Therapie die Übertragung auf das Neugeborene sehr häufig verhindert werden. In einer aktuellen Studie (4) wurden 200 Mütter, die in der 30. bis 32. Schwangerschaftswoche eine HBV-DNA-Last > 200.000 IU/ml hatten, in zwei Gruppen randomisiert. Eine Gruppe erhielt Plazebo, die andere 300 mg/d Tenofovirdisoproxil (als Fumarat). Bei 5 von 97 behandelten Müttern kam es zur Übertragung des HBV auf das Neugeborene, in der Plazebo-Gruppe bei 18 von 100 (p = 0,007). Nebenwirkungen waren in den beiden Gruppen nicht unterschiedlich. Eine weitere Möglichkeit besteht darin, Neugeborene HBs-Ag-positiver Mütter innerhalb von 12 Stunden nach der Geburt gegen das HBV zu immunisieren. Dabei wird die erste Dosis HBV-Impfstoff simultan mit HBV-Immunglobulin injiziert. Die begonnene Grundimmunisierung wird einen Monat später durch eine 2. Impfung und frühestens fünf Monate nach der 2. Impfung durch eine 3. Impfung vervollständigt. Nach Abschluss der Grundimmunisierung ist eine serologische Kontrolle erforderlich.
Impfschutz: Aufgrund vorliegender Daten kann man davon ausgehen, dass nach erfolgreicher Hepatitis-B-Grundimmunisierung im Erwachsenenalter keine weiteren Auffrischimpfungen oder Anti-HBs-Testungen erforderlich sind. Zum Nachweis des Impferfolgs wird in der Regel ein Anti-HBs-Test durchgeführt. Man geht derzeit davon aus, dass ein Anti-HBs-Titer von ≥ 100 IE/l als schützend gilt. Bei akuter Exposition durch HBV wird daher bei Geimpften der Anti-HBs-Titer kontrolliert und bei Werten < 100 IE/l eine Auffrischimpfung empfohlen. Bei Personen mit Immundefizienz (z.B. Dialysepatienten), werden jährliche Anti-HBs-Kontrollen empfohlen. Bei einem Anti-HBs-Wert < 100 IE/l sollte eine Auffrischimpfung durchgeführt werden.
Therapie (in Anlehnung an Leitlinien, z.B. 3): Akute HBV-Infektion (< 6 Monate): Die akute Hepatitis B heilt bei den meisten erwachsenen Patienten spontan aus (> 90%). Eine Verbesserung der Ausheilungsquote durch eine antivirale Therapie ist nicht belegt. Eine randomisierte plazebokontrollierte Studie aus Indien fand keinen Vorteil einer Therapie mit Lamivudin gegenüber Plazebo (5). Daten aus Europa oder den USA zur antiviralen Therapie der akuten Hepatitis B mit kompensierter Leberfunktion liegen nicht vor. Eine prospektive nationale Studie aus Deutschland konnte aufgrund mangelnder Rekrutierung von Patienten nicht wie vorgesehen beendet werden (6). Mehrere Fallberichte haben jedoch gezeigt, dass Patienten mit fulminanter Hepatitis B (0,1-0,5% bei Erwachsenen), die frühzeitig mit Lamivudin behandelt wurden, nur in 20% eine Lebertransplantation benötigten, im Vergleich zu 50-80% bei unbehandelten Patienten aus historischen Kontrollen (7, 8). Somit erscheint bei Anzeichen einer eingeschränkten Syntheseleistung der Leber (Verlängerung der Prothrombinzeit, Quick-Wert < 50%) eine Therapie mit einem direkt antiviralen Wirkstoff gerechtfertigt, um möglicherweise einem fulminanten Leberversagen vorzubeugen und die Notwendigkeit einer Lebertransplantation zu vermeiden. In einer solchen klinischen Situation sollte umgehend das weitere Vorgehen mit einem Lebertransplantationszentrum abgestimmt werden. Für den Beginn einer antiviralen Therapie bei ausreichender Leberfunktion (Quick-Wert > 50%) gibt es keine Evidenz. Daher bedürfen die meisten Patienten mit akuter Hepatitis B (> 98%) keiner antiviralen Therapie!
Chronisch replikative HBV-Infektion (> 6 Monate): Gibt es bei chronisch replikativer Hepatitis B (HbsAg positiv oder HBV-DNA im Blut nachweisbar, häufig auch ohne erhöhte Leberwerte) extrahepatische Manifestationen, z.B. eine Vaskulitis (Polyarteriitis nodosa) oder Arthritis, sollte eine Therapie mit einem direkt antiviralen Wirkstoffe eingeleitet werden (z.B. Tenofovir). Hierunter bessern sich die Symptome meistens rasch.
Chronisch replikative Hepatitis B “noch” ohne Leberzirrhose: Wiederholt bzw. dauerhaft erhöhte Leberwerte (z.B. ALT = SGPT > 2fach über dem Normwert) oder entzündliche Aktivität im Leberbiopsat oder/und im Fibroscan und HBV-DNA-Last > 2000 IU/ml werden als Indikation zur Behandlung angesehen. Neuerdings wird eine Behandlung auch dann empfohlen, wenn keine entzündliche Aktivität in der Leber nachweisbar ist (ALT oder/und Histologie oder/und Fibroscan normal), jedoch die HBV-DNA-Last im Blut > 2000 IU/ml ist.
Wirkstoffe: Interferon alfa-2a oder -2b: Bei Indikation und fehlenden Kontraindikationen sollte zunächst eine Behandlung mit pegyliertem Interferon alfa-2a versucht werden (12 Monate), denn dadurch kann eine Serokonversion von HBs zu Anti-HBs erreicht werden, und die Patienten bleiben nicht vom Wirkstoff abhängig, wie es in der Regel bei Therapie mit einem direkt antiviral wirksamen Arzneimittel der Fall ist. Patienten, bei denen die Injektion von pegyliertem Interferon alfa erfolglos bleibt oder bei denen eine Kontraindikation dafür besteht, sollten mit einem direkt antiviralen Wirkstoff behandelt werden (z.B. Tenofovir).
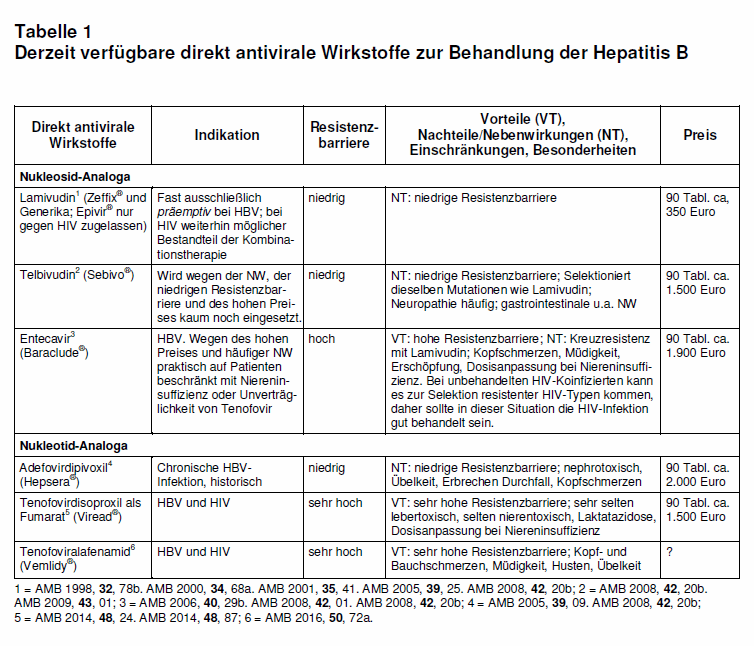
Direkt antivirale Wirkstoffe (Nukleosid- bzw. Nukleotid-Analoga; vgl. Tab. 1): Für die Wahl des Wirkstoffs sollten gemäß den Leitlinien das Stadium der Lebererkrankung, die Höhe der HB-Virämie sowie vorausgegangene Therapien berücksichtigt werden (3). Besteht eine Leberzirrhose oder eine HBV-DNA-Last von > 106 IU/ml, sollte primär ein Wirkstoff mit hoher genetischer Barriere gegen Resistenzentwicklung eingesetzt werden (z.B. Tenofovir; vgl. Tab. 1). Entecavir wird in Leitlinien zwar auch empfohlen, hat aber einen hohen Preis und viele Nebenwirkungen (Tab. 1). Gegen Lamivudin entwickelte Resistenzen bestehen häufig dann auch gegen Entecavir (Kreuzresistenz). Im Tierversuch war eine onkogene Potenz von Entecavir nicht auszuschließen. Daher wird in der Regel (bei Patienten ohne eingeschränkte Nierenfunktion) mit Tenefovir therapiert.
Die Behandlung mit einer Kombination antiviraler Wirkstoffe zu beginnen, hat bisher keine Vorteile gezeigt und wird in den Leitlinien nicht mehr empfohlen. Die deutsche Leitlinie (3) weist in ihren Erläuterungen darauf hin, dass das Risiko für eine Resistenzbildung im weiteren Verlauf gering ist bei schnellem Ansprechen unter Telbivudin oder Lamivudin (HBV-DNA < 200 IU/ml nach 6 Monaten) und einer initial niedrigen HBV-DNA (< 106 IU/ml). Deshalb können diese Wirkstoffe bei Patienten mit niedriger Viruslast und ohne Hinweise auf eine bereits fortgeschrittene Leberfibrose eingesetzt werden. Dies ist allerdings eine sehr theoretische und nicht wirklich patientenorientierte Strategie, so dass man Lamivudin oder Telbivudin bei chronisch replikativer Hepatitis B heute nicht mehr einsetzt (s. Tab. 1). Lamivudin hat allerdings einen festen Stellenwert in der präemptiven Behandlung, d.h. wenn unter einer geplanten immunsuppressiven Therapie eine Reaktivierung der HBV-Replikation verhindert werden soll.
Chronisch replikative Hepatitis B mit Leberzirrhose: Patienten mit Leberzirrhose und Nachweis einer HBV-DNA-Viruslast sollten therapiert werden. Ist die Zirrhose noch kompensiert, kann versuchsweise zunächst mit pegyliertem Interferon alfa-2a behandelt werden. Besteht eine Kontraindikation für Interferon alfa oder ist diese Behandlung erfolglos oder ist die Leberzirrhose bereits dekompensiert, sollte mit einem direkt antivalen Wirkstoff mit hoher Resistenzbarriere begonnen werden (z.B. Tenofovir). Bei Patienten mit Leberzirrhose und kontrollierter HBV-Infektion ist die Möglichkeit einer Lebertransplantation zu prüfen.
Kontrolle des Therapieerfolgs: Mit pegyliertem Interferon alfa-2a kann bei ca. 2-11% der Patienten in einem Zeitraum von 3-6 Jahren eine HBsAg-Serokonversion (Anti-HBs) erreicht werden. Die Rate steigt auch in der Zeit danach noch an. Es empfiehlt sich also eine Kontrolle alle 6 Monate, und es ist individuell zu entscheiden, wann bei ausbleibender Serokonversion auf die Therapie mit einem direkt antiviralen Wirkstoff übergegangen wird.
Unter laufender Therapie sollte die Replikation des HBV regelmäßig alle 6 Monate gemessen werden. Während der Behandlung mit direkt antiviralen Wirkstoffen können Resistenzen auftreten, die ihre Wirksamkeit aufheben, wie z.B. bei Lamivudin, etwas seltener bei Telebuvir und noch etwas seltener bei Entecavir. Von Telebuvir und Entecavir sind Kreuzresistenzen mit Lamivudin bekannt (s. Tab. 1). Bei Behandlung der chronisch replikativen Hepatitis B mit Lamivudin ist dies nach fünf Jahren bei ca. 50% der Patienten der Fall. Daher wird Lamivudin heute fast nur noch als präemptive Behandlung eingesetzt (siehe dort). Sind die Patienten unter einem direkt antiviralen Wirkstoff (s. Tab. 1) therapieadhärent, sollte die HBV-DNA spätestens nach 6 Monaten nicht mehr im Blut nachzuweisen sein. Eine Therapie Drogen- und/oder Alkohol-abhängiger Patienten sollte nur dann erwogen werden, wenn Adhärenz wahrscheinlich ist.
Die Therapie mit einem direkt antiviralen Wirkstoff muss in der Regel lebenslang (!) fortgesetzt werden. Nur selten (bei < 0,1%) kommt es zu einer HBs-Serokonversion (Anti-HBs). In dieser seltenen Situation kann ein Absetzen diskutiert werden.
Schwere Nebenwirkungen sind bei den direkt antiviralen Wirkstoffen relativ selten. Tenofovir ist potenziell nephrotoxisch, deshalb sind Kontrollen der Nierenfunktion notwendig. Eine neue Formulierung, Tenofoviralafenamid (Vemlidy®), soll weniger nephrotoxisch sein und ist seit Januar 2017 von der FDA zur Behandlung der chronischen Hepatitis B mit kompensierter Lebererkrankung zugelassen. Für die Dosierung der verschiedenen direkt antiviralen Wirkstoffe sei auf die Leitlinien der Fachgesellschaften verwiesen, besonders bei Niereninsuffizienz (vgl. 3).
Hepatitis-B-Reaktivierung unter Immunsuppression und präepmtive Therapie: Patienten, die wegen Autoimmun- oder malignen Erkrankungen immunsuppressiv behandelt werden müssen, sollten zuvor auf Antikörper gegen HBc-Ag (Anti-HBc) untersucht werden, da ihr Nachweis eine durchgemachte HBV-Infektion anzeigt. Ist Anti-HBc nachweisbar, sollte zusätzlich nach HBV-DNA im Blut gesucht werden. Sind beide Tests positiv, sollte vor der immunsuppressiven Therapie eine Behandlung mit einem direkt antiviralen Wirkstoff mit hoher Resistenzbarriere eingeleitet werden (z.B. Tenofovir). Ist nur Anti-HBc nachweisbar und HBV-DNA im Blut negativ, ist zunächst eine engmaschige Kontrolle der HBV-DNA während der Immunsuppression ausreichend. Ist aber vorgesehen, mit einem Antikörper (z.B. Rituximab) oder anderen, die Funktion von B-Zellen/Plasmazellen beeinträchtigenden Wirkstoffen zu behandeln, ist auch bei Patienten, die Anti-HBc positiv sind und bei denen HBV-DNA im Blut nicht nachweisbar ist, unbedingt eine präemptive Therapie mit einem direkt antiviralen Wirkstoff erforderlich (z.B. Lamivudin; nur diese Behandlung wird als präemptiv bezeichnet!). Dieses Vorgehen gilt auch für Patienten mit geplanter Stammzelltransplantation (9). Wir würden aber auf Grund der schwerwiegenden, nicht selten fatalen Verläufe bei einer solchen Reaktivierung die präemptive Therapie auf alle Patienten ausweiten, die eine intensive bzw. kombinierte Immunsuppression erhalten sollen (eigene Erfahrung sowie 9-12). Es gibt Fallberichte über eine Reaktivierung der HBV-Infektion unter Behandlung mit BCR-ABL-Tyrosinkinase-Inhibitoren (Imatinib, Dasatinib, Nilotinib, Bosutinib, Ponatinib; 13, 14). Auch bei Patienten, die mit Hepatitis B und Hepatitis C koinfiziert sind, kann unter Behandlung der chronischen Hepatitis C mit direkten antiviralen Wirkstoffen (Daclatasvir, Dasabuvir, Sofosbuvir/Ledipasvir, Simeprivir, Sofosbuvir, Ombitasvir/Paritaprevir/Ritonavir) das HBV reaktiviert werden (15-17). Das gleiche gilt für die Behandlung mit Thalidomid (18) und Pomalidomid (19). Deshalb ist es wahrscheinlich sinnvoll und in Studien zu prüfen, ob auch solche Patienten bei Beginn der Behandlung einer Hepatitis C eine präemptive Therapie gegen Hepatitis B erhalten sollten.
Literatur
- https://www.rki.de/… Ratgeber_HepatitisB Link zur Quelle
- WHO: Link zur Quelle
- Cornberg, M., et al.: Link zur Quelle
- Pan, C.Q., et al.: N. Engl. J. Med. 2016, 374,2324. Link zur Quelle
- Kumar, M., et al.: Hepatology 2007, 45, 97. Link zur Quelle
- Wiegand, J., et al. (GAHB = German Hep-Net Akute HepatitisB): J. Viral Hepat. 2014, 21, 744. Link zur Quelle
- Schmilovitz-Weiss,H., et al.: Liver Int. 2004, 24, 547. Link zur Quelle
- Tillmann,H.L., et al.: J. Viral Hepat. 2006, 13, 256. Link zur Quelle
- Seto, W.K., et al.: Hepatology 2016, doi: 10.1002/hep.29022. [Epub ahead of print]. Link zur Quelle
- Fang,J., et al.: Int. Urol. Nephrol. 2016 Dec 28. doi:10.1007/s11255-016-1487-5. [Epub ahead of print]. Link zur Quelle
- Chen, M.H., et al.: J. Infect. Dis. 2016 Dec 23. pii: jiw606. doi:10.1093/infdis/jiw606. [Epub ahead of print]. Link zur Quelle
- Pillai, A.A., et al.: Am. J. Gastroenterol. 2016, 111, 1854. Link zur Quelle
- Orlandi, E.M., et al.: Leuk. Lymphoma 2016Nov 28:1-3. [Epub ahead of print]. Link zur Quelle
- http://www.akdae.de/Arzneimittelsicherheit/… Link zur Quelle
- Takayama, H., et al.: Hepatol. Res. 2016, 46,489. Link zur Quelle
- Ende,A.R., et al.: J. Med. Case Rep. 2015, 9, 164. Link zur Quelle
- http://www.akdae.de/Arzneimittelsicherheit/DSM/Archiv/2016-33.html Link zur Quelle
- http://www.akdae.de/Arzneimittelsicherheit/DSM/Archiv/2016-21.html Link zur Quelle
- http://www.akdae.de/Arzneimittelsicherheit/DSM/Archiv/2016-17.html Link zur Quelle