Zusammenfassung: Die Rechtsherzinsuffizienz ist eine späte Komplikation der COPD und prognostisch sehr ungünstig. Die erhöhte Nachlast des rechten Ventrikels und eine neurohumorale Entgleisung sind die Ursachen. Die einzige Therapie, die nachweislich die Prognose verbessert, besteht in einer kontinuierlichen Verbesserung der Oxygenierung durch eine Sauerstoff-Langzeittherapie. Außerdem ist die vorsichtige Gabe von Diuretika, ACE-Hemmern und eine Natriumrestriktion sinnvoll. Vasodilatanzien können im Einzelfall hilfreich sein. Ihr Nutzen sollte aber durch eine invasive Testung belegt werden.
Etwa ein Drittel der Patienten mit COPD entwickelt in späten Stadien oder bei akuten Exazerbationen eine Rechtsherzinsuffizienz mit peripheren Ödemen. Meist handelt es sich um die Patienten vom „bronchitischen Typ”, die sog. „Blue Bloater”. Das Auftreten von Ödemen ist ein Alarmsignal für eine schlechte Prognose. Die Fünf-Jahres-Überlebensrate beträgt weniger als 50% (1).
Es wird geschätzt, daß etwa 10% der Krankenhausaufnahmen wegen dekompensierter Herzinsuffizienz auf eine Rechtsherzinsuffizienz entfallen (2). Dabei sind beim Auftreten von Beinödemen bei COPD-Patienten einige wichtige Differenzialdiagnosen zu beachten, insbesondere Nierenerkrankungen, Leberfunktionsstörungen und unerwünschte Arzneimittelwirkungen (UAW).
Pathophysiologie: Letztlich kann nur mit der Echokardiographie oder invasiv die Diagnose Rechtsherzinsuffizienz zuverlässig gestellt werden. Zukünftig wird möglicherweise auch die Bestimmung des spezifischen Ventrikelmarkers BNP (Brain natriuretic peptide) und des Vorhofmarkers ANP (Atrial natriuretic peptide) an Bedeutung gewinnen. Das BNP zeigt eine Herzinsuffizienz sehr früh an und scheint zumindest bei der primären pulmonalen Hypertonie (PPH) eine sehr gute diagnostische Aussagekraft für eine sekundäre Rechtsherzinsuffizienz zu haben. Darüber hinaus korrelieren die BNP-Serumspiegel invers mit der Prognose dieser Patienten (3). In der Praxis spielen sie noch keine Rolle. Das Kosten/Nutzen-Verhältnis ist ungünstig (Preis GOÄ je 43,75 EUR).
Die Pathogenese der Rechtsherzinsuffizienz und der Ödeme bei COPD ist umstritten. Die Vorstellung, daß es sich dabei allein um ein Rückwärtsversagen des rechten Ventrikels bei erhöhtem pulmonalarteriellem Druck handelt, ist zu mechanistisch. Nur bei einem Teil der Patienten mit COPD und Ödemen finden sich deutlich erhöhte enddiastolische Drücke im rechten Ventrikel oder in der Pulmonalarterie (PA; 4). In einer Arbeit mit 74 COPD-Patienten, davon die Hälfte mit peripheren Ödemen, betrug der mittlere PA-Druck in Ruhe 35 mmHg (Normalwert bis 22 mmHg; 5). Zum Vergleich: bei der PPH sind PA-Mitteldrücke über 50 mmHg und Drücke wie im arteriellen System keine Seltenheit.
Bei der Rechtsherzinsuffizienz handelt es sich, ebenso wie bei der Linksherzinsuffizienz, um ein komplexes Syndrom mit neurohumoraler Entgleisung. Durch die chronische Hypoxämie (und Hyperkapnie) kommt es neben dem vaskulären Remodeling im Lungengefäßsystem auch zu einer peripheren Vasodilatation, zum Abfall des Systemdrucks und zur Minderung des renalen Blutflusses. Diese Effekte auf den pulmonalen, renalen und systemisch-arteriellen Kreislauf werden bei Azidose noch deutlich verstärkt (6). Im Rahmen dieser Blutfluß- und Druckveränderungen aktiviert der Körper analog der Linksherzinsuffizienz das Renin-Angiotensin- sowie das sympathische und das Vasopressin-System mit dem teleologisch zu sehenden Ziel, durch Wasser- und Natriumretention den Blutdruck und die Nierenperfusion aufrechtzuhalten (7). Gegensinnig werden die natriuretisch und vasodilatierend wirkenden Hormone ANP und BNP stimuliert.
Von all diesen Veränderungen spüren Patienten (und Ärzte) lange Zeit nichts. Erst wenn Volumen- und Drucküberlastung zum Remodeling des rechten Ventrikels führt mit Hypertrophie, Fibrose sowie Gefügedilatation (Cor pulmonale) mit Erweiterung des Trikuspidalklappenrings und Trikuspidalinsuffizienz, werden die klinischen Zeichen der Rechtsherzinsuffizienz sichtbar (Jugularvenenstauung, Jugularvenenpuls, hepatojugulärer Reflux, Beinödeme).
Die transienten Ödeme bei exazerbierter COPD werden von vielen Autoren heute allein durch die akuten renalen Effekte bei Hypoxämie und Hyperkapnie erklärt (8). Allein durch Gabe von Sauerstoff und Besserung der Hyperkapnie durch physikalische und antimikrobielle Maßnahmen können in vielen Fällen ohne zusätzliche Diuretikagaben die Ödeme erfolgreich behandelt werden.
Wie soll die Rechtsherzinsuffizienz bei COPD behandelt werden ? In erster Linie muß dafür gesorgt werden, daß die Ursache der COPD abgestellt wird. COPD-Patienten müssen mit dem Rauchen aufhören. Neben der Sauerstofftherapie (s.u.) ist dies die einzige Maßnahme, die nachweislich das Leben verlängern kann. Daneben sollte eine bronchiale Obstruktion nach den Stufenschemata der Fachgesellschaften medikamentös ausreichend behandelt werden (Übersicht bei 9).
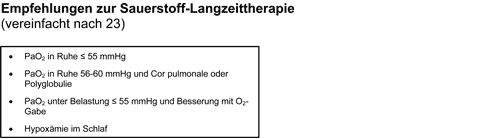
Als zweite wichtige lebensverlängernde Maßnahme hat sich die Sauerstoff-Langzeittherapie bei Patienten mit schwerer chronischer Hypoxämie etabliert (10). Hypoxie und Hyperkapnie sind bei COPD die wesentlichen Determinanten der pulmonalen Hypertonie (2). Mit einer Sauerstofftherapie über mindestens 18 Stunden pro Tag läßt sich nicht nur der PA-Druck senken, sondern auch die Letalität dieser Patienten nahezu halbieren. Die Kriterien für die Indikation einer Sauerstoff-Langzeittherapie sind in Tab. 1. wiedergegeben. Hier wurde der Bedeutung der Rechtsherzinsuffizienz insofern Rechnung getragen, als auch bei noch nicht erreichtem pO2-Grenzwert eine Sauerstofftherapie indiziert ist, wenn ein Cor pulmonale (mittels Echokardiographie) diagnostiziert worden ist.
In der kritischen Phase einer COPD-Exazerbation ist insbesondere bei Hyperkapnie die nichtinvasive, druckunterstützte Beatmung (NPPV) mit einer Gesichtsmaske (11) sinnvoll, weil sich hierdurch Oxygenierung und CO2-Elimination verbessern läßt. Eine raschere Rückbildung zugleich bestehender Ödeme durch die verbesserte Oxygenierung wäre plausibel, ist aber nicht belegt. Zudem tolerieren bei weitem nicht alle Patienten die NPPV.
Auch bei dauerhafter Heimbehandlung mit NPPV ist eine anhaltende Besserung der Blutgase und des funktionellen Status nachgewiesen (12), wobei keine Aussage über die Beeinflussung der Ödeme gemacht wurde. Wahrscheinlich ist die NPPV insbesondere bei den Blue Bloatern mit überlappendem Schlaf-Apnoe-Syndrom sinnvoll.
Ob Vasodilatanzien (z.B. Kalziumantagonisten, Endothelinantagonisten, Prostazykline, NO, Phosphodiesterase-Hemmer u.a.; Übersicht bei 13) über eine Drucksenkung im kleinen Kreislauf zu einer Besserung der Symptome, der Lebensqualität und der Prognose von COPD-Patienten und besonders derer mit Rechtsherzinsuffizienz führen, ist nicht sicher. Wie oben ausgeführt, ist der pulmonale Hypertonus nur ein Teilaspekt in der Pathogenese der Rechtsherzinsuffizienz. Hinzu kommt, daß Vasodilatanzien nur ausreichend gut bei PPH untersucht sind. Studien bei sekundärer pulmonaler Hypertonie infolge COPD sind klein an Zahl und von geringer Qualität und noch dazu widersprüchlich in ihren Ergebnissen (Übersicht bei 2). So führten z.B. Prostaglandininfusionen in einer Studie nicht zur erhofften Drucksenkung im kleinen Kreislauf, sondern zu kritischen Senkungen des Systemdrucks mit Verschlechterung der Nierenfunktion (14).
Im Einzelfall und bei deutlich erhöhten pulmonalen Druckwerten kann sich aber ein Versuch mit Vasodilatanzien lohnen. Insbesondere die Endothelinantagonisten (z.B. Bosentan = Tracleer®) und die Phosphodiesterase-Hemmer (Sildenafil = Viagra®) könnten interessante Substanzen sein (15). Es sollten aber keine unkontrollierten Anwendungen erfolgen, da ähnlich (oder noch häufiger) wie bei der PPH von einer geringen „Responderquote” auszugehen ist (25-30%), die Substanzen teuer sind und viele UAW auftreten können. Die Wirksamkeit einer Behandlung mit Vasodilatanzien muß deshalb durch eine invasive Medikamententestung mittels Rechtsherzkatheter und strengen Erfolgskriterien nachgewiesen werden.
Pathophysiologisch sinnvoll – um der neurohumoralen Aktivierung entgegenzuwirken – ist die Gabe von ACE-Hemmern oder Angiotensin-II-Rezeptor-Antagonisten schon frühzeitig im Verlauf einer Rechtsherzinsuffizienz. Leider gibt es aber, anders als bei Linksherzinsuffizienz oder arterieller Hypertonie, keine verläßliche Studie mit größeren Patientenzahlen, die den Nutzen von ACE-Hemmern bei COPD über einen längeren Zeitraum untersucht hat. Dabei konnte in kleineren Studien durchaus gezeigt werden, daß sich durch ACE-Hemmer die neurohumoralen und die hämodynamischen Parameter verbessern lassen und die Zahl der Krankenhausbehandlungen sinkt (16).
Digitalis hat keinen günstigen Einfluß auf den Verlauf einer Rechtsherzinsuffizienz. Nur bei gleichzeitig bestehendem Vorhofflimmern oder bei Linksherzinsuffizienz kann Digitalis sinnvoll sein (17). Es gibt sogar Warnungen, daß COPD-Patienten aufgrund von Elektrolytstörungen und/oder Polypharmakotherapie empfänglicher sind für eine Digitalisintoxikation.
Mit Hilfe von Diuretika können die Ödeme bei Rechtsherzinsuffizienz ausgeschwemmt werden; ihre Wirkung kann aber bei persistierender Hypoxämie und Hyperkapnie eingeschränkt sein. Diuretika können pathophysiologisch sogar nachteilig sein. So kann bei zu starker akuter Entwässerung die Vorlast des rechten Ventrikels so stark sinken, daß es zu einem kritischen Abfall des Herzzeitvolumens (und des systemischen Blutdrucks) mit konsekutiver Verschlechterung der Nierenfunktion und verminderter Perfusion auch anderer Organe kommt. Deshalb sollte die Wirkung von Diuretika klinisch gut kontrolliert und die Dosis gegebenenfalls rechtzeitig wieder vermindert werden. Auch die Wahl des Diuretikums kann von Bedeutung sein. So kann z.B. Furosemid eine metabolische Alkalose bewirken, die wiederum zu einer unerwünschten Hypoventilation mit Anstieg des PaCO2 führen kann (18).
Azetazolamid (Diamox®), ein Karboanhydrase-Hemmer, stimuliert durch Erzeugen einer metabolischen Azidose die Atmung und kann bei stabilen hyperkapnischen COPD-Patienten eingesetzt werden. Durch Hyperventilation steigt der PaO2 an und der PaCO2 sinkt (jeweils um ca. 10-15%; 19). Azetazolamid scheint zumindest als Kombinations-Diuretikum besonders wirksam zu sein für die Behandlung von Ödemen bei COPD-Patienten mit hohen Bikarbonat-Serumspiegeln.
Der Aderlaß wird heute als symptomatische Therapie bei COPD-Patienten mit Polyglobulie (Blue Bloater) ab einem Hämatokrit von 60% empfohlen (20). Da die Blutviskosität nach dem Hagen-Poiseuilleschen Gesetz den Blutdruck gleichsinnig beeinflußt, führt ein Aderlaß nachweislich zu einer leichten pulmonalen Drucksenkung, nicht aber zu einer Verbesserung der Blutgase. Daß sich ein Aderlaß über Volumenreduktion und Drucksenkung auch auf eine Rechtsherzinsuffizienz günstig auswirkt, ist nicht sehr wahrscheinlich.
Natriumrestriktion ist bei sekundärer Rechtsherzinsuffizienz zumindest theoretisch sinnvoll, um der Natrium- und Wasserretention diätetisch entgegenzuwirken und wird häufig empfohlen. Eine gute Evaluation dieser Maßnahme gibt es aber bislang nicht.
Rehabilitationsmaßnahmen: Mit körperlichen Übungen, die insbesonders die Atemmuskulatur stärken (21), läßt sich zwar keine Lebensverlängerung bei COPD erzielen, jedoch kann die Belastbarkeit und die „Lebensqualität” gesteigert und die Zahl der Hospitalisierungen verringert werden (22).
Literatur
- Medical Research Council Working Party: Lancet 1981, I, 681.
- MacNee, W.: Am. J. Respir. Crit. Care Med. 1994, 150, 833 und 1158.
- Nagaya, N., et al.: Circulation 2000, 102, 865.
- Weitzenblum, E., et al.: Chest 1994, 105, 1377.
- Naeije, R., in: Weir, E.K., et al. (Hrsg.): The diagnosis and treatment of pulmonary hypertension. Fukura publishing, New York 1992, S. 209.
- deLeeuw, P.W., et al.: Eur. Respir. J. 2003, 22 Suppl 46, 33s.
- Anand, I.S., et al.: Circulation 1992, 86, 12.
- Sharkey, R.A., et al.: Chest 1999, 115, 1588.
- AMB 2003, 37, 9 und 17.
- Tarpy, S.P., und Celli, B.R.: N. Engl. J. Med. 1995, 333, 710.
- Brochard, L., et al.: N. Engl. J. Med. 1995, 333, 817.
- Criner, G.J., et al.: Chest 1999, 116, 667.
- Strange, J.W., et al.: Clin. Sci. 2002, 102, 253.
- Archer, S.L., et al.: Chest 1996, 109, 750.
- AMB 2002, 36, 61 und 85.
- Zielinski, J., et al.: Chest 1986, 90, 562.
- Mathur, P.N., et al.: Ann. Intern. Med. 1981, 95, 283.
- Brijker, F., et al.: Chest 2002, 121, 377.
- Wagenaar, M., et al.: Chest 2003, 123, 1450.
- Chetty, K.G., et al.: Chest 1990, 98, 1073.
- Guidelines Am. Thoracic Soc.: Am. J. Respir. Crit. Care Med. 1999, 159, 1666.
- Celli, B.R.: Am. J. Respir. Crit. Care Med. 1995, 152, 861.
- Magnussen, H., et al.: Pneumologie 2001, 55, 454.