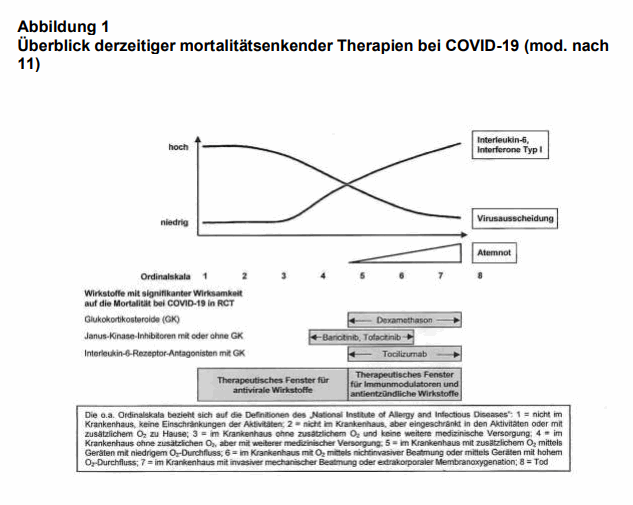
Die meisten Infektionen mit SARS-CoV-2 verlaufen asymptomatisch oder milde (1). Eine kleine Gruppe von Patienten entwickelt aber einen sehr schweren Verlauf mit hoher Letalität, meist infolge einer hyperinflammatorischen Reaktion. Es werden daher Arzneimittel benötigt, die diesen Verlauf mildern oder verhindern. Bisher haben erst zwei Wirkstoffe die Letalität bei diesen Patienten überzeugend reduzieren können: Glukokortikosteroide (z.B. Dexamethason) und Anti-IL6-Antikörper (2, 3). Beide therapeutischen Ansätze greifen in die überschießende Immunantwort ein. Zunehmende Kenntnisse in der Pathophysiologie von COVID-19 machen verständlich, warum in klinischen Studien die Therapie mit antiviralen Wirkstoffen bei symptomatischen Patienten bisher enttäuschend verlaufen ist (4-6). Die Lungenschäden stehen bei fast allen schweren Verläufen im Vordergrund (1). Heute weiß man, dass beim Beginn pulmonaler Symptome die Viruslast schon deutlich abgenommen hat (vgl. Abb. 1). Man teilt theoretisch den Verlauf von COVID-19 meist in 8 Grade bzw. Stadien ein (s. Ordinalskala der Abb. 1), wobei die letzten 4 (also 5-8) als schwer zu bezeichnen sind. Diese Stadien können mit der Viruslast und der immunologischen Reaktion korreliert werden. Daraus ergeben sich auch die medikamentösen Ansätze mit den therapeutischen Zeitfenstern für bestimmte Strategien. Eine antivirale Therapie macht demnach nur in den ersten beiden oder vielleicht noch im Stadium 3 Sinn – also, wenn keine oder nur geringe Symptome bestehen. Danach fällt die Viruslast ab und spielt im weiteren pathologischen Geschehen keine Rolle mehr. Das bedeutet aber auch, dass die meisten Patienten, die in dieser Phase antivirale Wirkstoffe (monoklonale Antikörper gegen SARS-CoV-2 oder Replikationsinhibitoren) erhalten, unnötig behandelt werden, denn die allermeisten schreiten nicht über das Stadium 3 hinaus. Nun wurde ein weiteres anti-entzündliches Prinzip, Hemmer der Janus-Kinasen (JAK), bei hospitalisierten Patienten mit COVID-19 untersucht (7). JAK sind bereits seit längerem zugelassen, beispielsweise in der Rheumatologie, bei chronisch verlaufenden entzündlichen Darmerkrankungen oder myeloproliferativen Neoplasien sowie zur Behandlung der Psoriasis; darüber hinaus sind sie auch wirksam bei der „Graft-versus-Host Disease“ (Übersicht bei 8; vgl. auch12). Diese Wirkstoffe blockieren den sogenannten JAK-STAT-Signalweg. Im Zytoplasma phosphorylieren JAK die sogenannten STAT-Proteine („signal transducer“ und „activator of transcription“). Durch die Phosphorylierung können die STAT-Proteine dann in den Zellkern eindringen, wo sie durch Bindung an die DNA die Transkription bestimmter Gene hochregulieren, wie zum Beispiel die Gene von Zytokinen, Interferonen oder Interleukinen (Übersicht 8). Zur Therapie von Patienten mit COVID-19 mit JAK-Hemmern (Ruxolitinib, Baricitinib) gab es bisher 3 Studien mit guten klinischen Ergebnissen; zwei rekrutierten jedoch nur wenige Patienten (Ruxolitinib: 9; Baricitinib: 10) und die dritte, ebenfalls mit Baricitinib (13), wurde bisher nur als „preprint“ veröffentlicht und nicht „peer-reviewed“, sodass gültige statistische Aussagen nicht möglich sind. Nun erschien eine größere 1:1 randomisierte kontrollierte Studie aus Brasilien zur Frage des klinischen Nutzens von Tofacitinib (7).
Methodik: Erwachsene Patienten mit COVID-19-Pneumonie der Schweregrade 4-6 wurden 1:1 randomisiert. Es wurde die Schweregrad-Skalierung in 8 Graden verwendet. Die eine Gruppe erhielt zweimal/d Plazebo, die andere zweimal/d 10 mg Tofacitinib. Die Therapie dauerte bis zu 14 Tagen. Der primäre Endpunkt war Tod oder respiratorisches Versagen bis Tag 28 nach Randomisierung. Nebenwirkungen und Tod durch alle Ursachen wurden ebenfalls erfasst. Die Studie wurde von Pfizer unterstützt.
Ergebnisse: Es wurden 289 Patienten aus 15 Zentren in Brasilien in die Studie eingeschlossen. Die Patientencharakteristika beider Gruppen waren ausgewogen: medianes Alter 56 Jahre, 35% Frauen, mediane Zeit von Symptombeginn bis Behandlung ca. 10 Tage; ca. 63% waren im Schweregrad 5, ca. 24% im Schweregrad 4 und ca. 13% in Schweregrad 6. Die meisten (89,3%) dieser Patienten erhielten zusätzlich ein Glukokortikosteroid. Die kumulative Inzidenz von Tod oder respiratorischem Versagen (Intubation) bis Tag 28 betrug 18,1% in der Tofacitinib- und 29,0% in der Plazebo-Gruppe (Risiko Ratio: 0,63; 95%-Konfidenzintervall = CI: 0,41-0,97; p = 0,04). Tod aus allen Gründen trat ein bis zum Tag 28 bei 2,8% in der Tofacitinib- und bei 5,5% in der Plazebo-Gruppe (Hazard Ratio: 0,49; CI: 0,15-1,63). Die proportionale Chance („proportional odds“), sich im Schweregrad der Erkrankung zu verschlechtern, war mit Tofacitinib verglichen mit Plazebo 0,60 (CI: 0,36-1,00) am Tag 14 und 0,54 (CI: 0,27-1,06) an Tag 28. Schwerwiegende Nebenwirkungen traten bei 20 Patienten (14,1%) in der Tofacitinib- und bei 17 (12,0%) in der Plazebo-Gruppe auf.
Im Gegensatz zu Anti-IL6-Antikörpern sind die Janus-Kinase-Inhibitoren offenbar bereits in einem früheren Stadium (Schweregrad 4-5) wirksam. Ähnlich wie bei Anti-IL6-Antikörpern fanden sich auch in dieser Studie Hinweise für einen synergistischen Effekt von Glukokortikosteroiden und Janus-Kinase-Inhibitoren. Im begleitenden Editorial zu dieser Studie wird noch einmal betont, dass für die Therapie mit einem Glukokortikosteroid in Monotherapie in den Schweregrad-Stadien 3 und 4 kein Überlebensvorteil gefunden wurde (11).
Fazit: Eine brasilianische Studie zeigt, dass besonders die Kombination eines Glukokortikosteroids mit einem Janus-Kinase-Inhibitor (hier Tofacitinib) die Letalität bei hospitalisierten Patienten mit COVID-19-Pneumonie senken kann. Damit ist bisher für drei Wirkstoffgruppen (Glukokortikosteroide, Anti-IL6-Antikörper, JAK-Hemmer) ein Überlebensvorteil in der Therapie hospitalisierter Patienten mit COVID-19-Pneumonie gezeigt worden.
Literatur
- AMB 2020, 54, 09. Link zur Quelle
- AMB 2020, 54, 79. Link zur Quelle
- AMB 2020, 54, 49. Link zur Quelle
- AMB 2020, 54, 95. Link zur Quelle
- AMB 2021, 55, 08a. Link zur Quelle
- AMB 2021, 55, 55. Link zur Quelle
- Guimarães, P.O., et al. (STOP COVID = Study of tofacitinib in hospitalized patients with Covid-19 pneumonia): N. Engl. J. Med. 2021, 385, 406. Link zur Quelle
- https://www.medmedia.at/faktenrheumatologie/ jak-inhibitoren-neue-daten- neue-indikationen/ Link zur Quelle
- Cao, Y., et al.: J. Allergy Clin. Immunol. 2020, 146, 137. Link zur Quelle
- Kalil, A.C., et al. (ACTT-2 = Adaptive COVID-19 Treatment Trial-2): N. Engl. J. Med. 2021, 384, 795. Link zur Quelle
- Stebbing, J., und Lauschke, V.M.: N. Engl. J. Med. 2021, 385, 463. Link zur Quelle
- Zeiser, R., et al. (REACH3 = A study of ruxolitinib vs best available therapy (BAT) in patients with steroid-refractory chronic graft vs. host disease (GvHD) after bone marrow transplantation): N. Engl. J. Med. 2021, 385, 228. Link zur Quelle
- Marconi, V.C., et al.: Link zur Quelle