Zusammenfassung: Bisphosphonate haben auf Grund ihrer besonderen chemischen Struktur eine große Affinität zum Knochenmineral. Dort bleiben sie jahrelang gebunden und hemmen durch direkte und indirekte Wirkungen auf die Osteoklasten vorwiegend den Knochenabbau. Dieser antiresorptive Effekt ist bei Knochenerkrankungen mit erhöhtem Umbau besonders stark. In geringerem Maße wird auch die Knochenneubildung gehemmt, so daß es insgesamt zu einem Nettozuwachs an Knochenmasse kommt. Beim M. Paget und bei tumorassoziierter Hyperkalziämie mit und ohne Osteolysen sind sie heute Mittel der Wahl. Auch bei postmenopausaler Osteoporose haben sie sich bewährt und sind in besonderen Situationen eine therapeutische Alternative. Wahrscheinlich sind Bisphosphonate auch präventiv und therapeutisch wirksam bei Steroid- und anderen Formen der Osteoporose. Darüberhinaus vermindern sie die Häufigkeit und das Ausmaß der Skelettkomplikationen beim Plasmozytom und verringern möglicherweise auch die Skelettmetastasierung anderer Tumoren bzw. lindern Beschwerden bei vorhandenen Skelettmetastasen. Wenn auch nicht alle Aspekte der Nebenwirkungen bei Langzeitgabe beurteilt werden können, ist die Verträglichkeit der Bisphosphonate bei Beachtung der Kontraindikationen insgesamt gut. Die Auswahl des jeweiligen Bisphosphonats ist schwierig, weil es jeweils über mehrere Substanzen positive Mitteilungen bei verschiedenen Indikationen, aber leider nur wenige vergleichende Untersuchungen gibt. Letztlich entscheidend sind daher Zulassung, Verträglichkeit, Applikationsart und Preis.
Bisphosphonate wurden bereits im vorigen Jahrhundert synthetisiert, werden aber erst seit 1968 nach grundlegenden Untersuchungen von H. Fleisch et al. in Bern medizinisch genutzt (21). Diese Arbeitsgruppe entdeckte, daß anorganische Pyrophosphate, die wegen ihrer kristallhemmenden Wirkungen bereits seit langem industriell in Waschpulvern (inzwischen phosphatfrei!) zur Verhinderung von Kesselstein verwendet wurden, auch in biologischen Flüssigkeiten vorkommen. Wegen ihrer starken Osteotropie wurde vermutet, daß sie eine physiologische Rolle in der Steuerung von Verkalkungsmechanismen spielen. Da sie aber in vivo schnell inaktiviert werden, kamen sie als Arzneimittel nicht in Betracht. Auf der Suche nach Stoffen mit ähnlicher, aber längerer Wirkung stieß man auf die Bisphosphonate.
Chemische Eigenschaften: Die geminalen Bisphosphonate – diese sind gemeint, wenn allgemein von Bisphosphonaten als Pharmaka die Rede ist – sind synthetische, in der Natur nicht vorkommende Analoge der natürlichen Pyrophosphate. Bei ihnen ist das zentrale (zweiwertige) Sauerstoffatom in der P-O-P-Struktur des Pyrophosphats durch ein (vierwertiges) Kohlenstoffatom ersetzt (P-C-P-Struktur; s. Abb.1). Durch Einfügen verschiedener Substituenten an den zwei freien Valenzen R1 und R2 können viele Bisphosphonat-Varianten mit sehr unterschiedlichen Wirkungen hergestellt werden. Im Gegensatz zum Pyrophosphat, das durch hydrolytische Spaltung der P-O-P-Brücke in vivo rasch inaktiviert wird, werden die bisher bekannten Bisphosphonate nicht abgebaut, zumindest nicht die P-C-P-Brücke.
Biologische Wirkungen, Wirkmechanismen, Pharmakokinetik: Die physikalischen Eigenschaften der Bisphosphonate ähneln denen der Pyrophosphate. Sie binden stark an Kristalle, speziell an Kalziumphosphat, hemmen deren Bildung, Aggregation und auch ihre Auflösung. Ihre schnelle und starke Bindung an den Hydroxylapatit des Knochens beruht auf ihrer P-C-P-Struktur. Diese Eigenschaft macht sie zu idealen Trägersubstanzen für die Knochenszintigraphie. Andere biologische und pharmakokinetische Eigenschaften werden wahrscheinlich mehr von den Seitenketten bestimmt. Bisphosphonate vermindern die Knochenresorption durch direkte und indirekte Hemmung der Osteoklastenaktivität. Sie ist je nach Substanz sehr unterschiedlich ausgeprägt (s. Tab. 1). Die Mechanismen auf zellulärer und humoraler/parakriner Ebene sind noch nicht genau bekannt (Übersicht bei 7). Wahrscheinlich werden die Osteoklasten, zumindest teilweise, dadurch gehemmt, daß sie bei ihrem Knochenabbau bisphosphonathaltiges Knochenmineral in sich aufnehmen (21, 58). Aber auch ihre Differenzierung aus Vorläuferzellen, die unter der Steuerung parakriner Osteoblastenfaktoren steht, wird gebremst (77) Schließlich scheinen Osteoklasten unter dem Einfluß von Bisphosphonaten auch früher abzusterben (Apoptose; 58). Bisphosphonate vermindern auch die Knochenneubildung, vermutlich indirekt als Folge ihrer antiresorptiven Eigenschaften. Dieser Effekt ist quantitativ geringer als die Hemmung der Resorption, so daß netto eine Zunahme der Knochenmasse resultiert. Unter hohen Dosen wird auch die Mineralisation des neugebildeten Knochens gehemmt. Diese unerwünschte Wirkung hat bei den heute verwendeten Dosierungen, die zur Senkung der Knochenresorption verwendet werden, und bei den neueren Substanzen jedoch keine klinische Bedeutung.
Bisphosphonate werden intestinal sehr schlecht resorbiert (durch Diffusion im Dünndarm nur 0,5%-10% einer oralen Dosis) und unverändert renal über glomeruläre Filtration und tubuläre Sekretion ausgeschieden. Durch die hohe Affinität zum Knochenmineral wird ein Teil der resorbierten Menge (20-80%) im Skelett festgehalten und nur sehr langsam im Rahmen osteoklastärer Resorption wieder freigesetzt. Die Serumhalbwertszeit ist wegen der hohen renalen Clearance kurz (0,5-2 Stunden), die Körperhalbwertszeit (= Skeletthalbwertszeit) liegt jedoch im Bereich von einigen Jahren. Bei chronischer Applikation erreicht die Akkumulation im Skelett erst nach langer Zeit ein Plateau, während das Plateau der Wirkung schneller erreicht wird und dosisabhängig ist (21). Einige Bisphosphonate stehen auch als i.v. Präparate zur Verfügung.
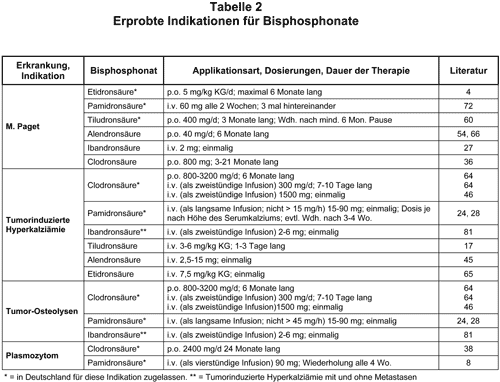
M. Paget: Beim M. Paget (Ostitis deformans), dessen Ursache möglicherweise eine Virusinfektion ist, besteht in den befallenen Arealen ein stark erhöhter Knochenumsatz mit beschleunigtem Abbau und ungeordnetem Anbau. Die Knochenneubildung ist manchmal überschießend, und statt eines lamellären Osteonknochens wird oft ein untermineralisierter Geflechtknochen gebildet, der zu Deformierungen und pathologischen Frakturen neigt. Die befallenen Knochen schmerzen auch häufig. Ansonsten werden die klinischen Symptome dieser chronisch-progredienten Skeletterkrankung von der Lokalisation und von Verdrängungserscheinungen (Paresen, Hörverlust) bestimmt. Die alkalische Phosphatase im Serum (Osteoblasten-Isoenzym) und neuerdings auch die Ausscheidung von Pyridinolin-Crosslinks im Urin (Marker des Knochenabbaus) sind neben den Symptomen gut geeignet, die Krankheitsaktivität bzw. den Therapieerfolg zu beurteilen. Fast alle Bisphosphonate, die klinisch geprüft wurden, sind auch bereits zur Therapie des M. Paget eingesetzt worden (s. Tab. 2). Bisphosphonate sind heute Mittel der Wahl und haben die Calcitonine wegen stärkerer und anhaltenderer Wirkung, angenehmerer Applikationsart und seltenerer sekundärer Resistenz verdrängt (Übersichten bei 15, 18, 21, 34, 59). Die in Tab. 2 aufgeführten Schemata haben sich bewährt. In Deutschland sind für die Behandlung des M. Paget Etidron-, Pamidron- und Tiludronsäure zugelassen; möglicherweise kommen bald weitere hinzu. Vergleichende Studien gibt es nur wenige. Alendron- (60), Tiludron- (66), und Pamidronsäure (80) und andere neuere Bisphosphonate sind der Etidronsäure wahrscheinlich überlegen, speziell bei Rezidiven. Die Indikation zur Therapie, ihre Dauer und die Dosierung bzw. die Applikationsart des Bisphosphonats orientiert sich gerade bei Patienten mit M. Paget sehr individuell an den Symptomen und den Aktivitätsparametern; sie erfordert klinische Erfahrung. Die Behandlung, ob oral oder i.v., erfolgt typischerweise in Zyklen. Ziel ist es, die Aktivitätsparameter in den Normbereich bzw. sehr stark zu senken. Allgemeine Richtlinien zur Behandlung wurden von einem Expertengremium veröffentlicht (57). Grundsätzlich sollten alle Patienten mit Symptomen und auch solche ohne Symptome mit komplikationsträchtiger Lokalisation des Knochenbefalls therapiert werden. Die Häufigkeit und Dauer weiterer Zyklen richtet sich wiederum nach Symptomen, Krankheitsaktivität und der bereits verabfolgten Bisphosphonat-Dosis. Da sich die Bisphosphonate in den Arealen des erhöhten Knochenumbaus anreichern, kommt es häufig zu längeren Remissionen. Eine erneute Therapie nach einem Wiederanstieg der Aktivitätsparameter kann in gleicher Weise wie zu Beginn erfolgen, nach Etidronsäure-Therapie vorzugsweise mit einem potenteren Bisphosphonat. Patienten mit sehr stark erhöhter alkalischer Phosphatase haben häufiger Rückfälle.
Tumorinduzierte Hyperkalziämie, osteolytische Knochenmetastasen, Plasmozytom: Tumor-induzierte Hyperkalziämien werden vorwiegend beim Bronchial-, Mamma- oder Prostatakarzinom sowie beim Plasmozytom gefunden. Sie entstehen durch osteoklastenaktivierende Substanzen, die von Tumorzellen (auch von Metastasen) sezerniert werden, und zwar entweder systemisch (z.B. parathormonähnliches Peptid, PTHrP) oder lokal-parakrin von Knochenmetastasen (z.B. Zytokine, Prostaglandine). PTHrP fördert darüberhinaus die Rückresorption von Kalzium in der Niere und verstärkt dadurch die Hyperkalziämie (52). Andererseits verursachen Knochenmetastasen, auch ohne daß eine Hyperkalziämie entsteht, osteoklastenvermittelte Osteolysen. Prinzipiell besteht die Therapie der tumorinduzierten Hyperkalziämie in der Behandlung des Tumorleidens. Meist ist aber die Hyperkalziämie akut bedrohlich und behandlungsbedürftig, so daß die Wirkung einer antitumorösen Therapie nicht abgewartet werden kann, oder der Patient ist im fortgeschrittenen Stadium einer nicht mehr kausal behandelbaren neoplastischen Erkrankung. Wichtig ist, daß die hyperkalziämischen Patienten, die häufig auch exsikkiert sind, rehydriert werden. Zur Normalisierung des Serumkalziums durch Hemmung der Knochenresorption werden in den letzten Jahren zunehmend Bisphosphonate mit gutem Erfolg bei den meisten Patienten eingesetzt. Die Therapie mit Mithramycin, Calcitonin und Kortikosteroiden ist in den Hintergrund getreten. Mehrere Bisphosphonate sind für diese Indikation erprobt (Übersicht bei 22). Clodron- (46, Übersicht bei 20), Pamidron- (28, 24) und Ibandronsäure (48, 81) sind für die intravenöse, Clodronsäure zusätzlich auch für die orale Anwendung in Deutschland zugelassen (s. Tab. 2). Die jeweilige Dosierung richtet sich nach der Höhe der Hyperkalziämie; die Herstellerangaben dazu und auch im Hinblick auf die Infusionsgeschwindigkeit sind zu beachten. Bei hochdosierter Clodron-, Pamidron- und Ibandronsäure-Therapie reicht oft eine einmalige Infusion, um das Kalzium innerhalb weniger Tage in einen ungefährlichen Bereich zu senken. Die Behandlung muß bei den meisten Patienten, besonders wenn die primäre Erkrankung nicht mehr behandelbar ist, nach einigen Wochen wiederholt werden. In einer Studie, in der Etidron-, Clodron- und Pamidronsäure zur Therapie der Tumorhyperkalziämie verglichen wurden, war Pamidronsäure am wirksamsten (51). Möglicherweise sind diese Wirkungsunterschiede mehr von der Dosierung als von den Substanzen selbst abhängig. Patienten, bei denen die Hyperkalziämie durch PTHrP-Sekretion des Tumors verursacht wird, sprechen schlechter auf eine Bisphosphonat-Therapie an, denn die PTHrP-Wirkung am Knochen wird zwar gehemmt, nicht aber die erhöhte renale Reabsorption von Kalzium, zumal auch die PTHrP-Konzentrationen im Serum unbeeinflußt bleiben (10, 29).
Auch bei normokalziämischen Patienten mit Knochenmetastasen werden Bisphosphonate zunehmend verabreicht, denn es hat sich in fast unüberschaubar vielen Untersuchungen seit mehr als 15 Jahren gezeigt, daß eine solche Therapie die Progredienz der Metastasen, ihre Komplikationen und die Knochenschmerzen vermindern kann (Übersichten bei 6, 20, 22, 63). Positive Resultate ergab z.B. eine Studie mit insgesamt 380 Patientinnen (davon 195 Kontrollen) mit Mammakarzinom im Stadium IV, die zusätzlich zur Chemotherapie 12 Zyklen einer Pamidronat-Infusion (jeweils 90 mg/Zyklus) in 4wöchigen Abständen erhielten (32). Die mediane Zeit bis zum Auftreten der ersten Skelettkomplikation war länger in der Pamidronat-Gruppe (13,1 vs. 7,0 Monate; p = 0,005) und der Anteil der Patientinnen mit Skelettkomplikationen war geringer (43% vs. 56%; p = 0,008). Günstig war auch der Einfluß auf die zunehmenden Knochenschmerzen und im Hinblick auf die Verschlechterung des Allgemeinzustandes. Die Überlebenszeit wurde jedoch nicht verlängert (14,8 vs. 14,2 Monate). Ähnliche Ergebnisse wurden auch mit Etidron- (6, 68) und Clodronsäure (6, 20) bei verschiedenen Tumoren (Mamma-, Prostatakarzinom) mit Knochenmetastasen erzielt. Die meisten Erfahrungen liegen wahrscheinlich mit Clodron- und Pamidronsäure vor, ohne daß ein spezielles Bisphosphonat bei einer bestimmten Tumorart hervorzuheben wäre.
Ähnlich wie die Studie zum metastasierten Mammakarzinom (32) war auch eine Untersuchung mit i.v. Pamidronsäure bei 377 Patienten mit Plasmozytom angelegt (8; s. Tab. 2). Die Patienten erhielten insgesamt 9 monatliche Zyklen zu jeweils 90 mg. Auch hier konnte die Überlebenszeit nicht signifikant verlängert werden (28 Monate in der Pamidronat- vs. 23 Monate in der Kontroll-Gruppe). Skelettkomplikationen und Schmerzen wurden jedoch günstig beeinflußt. Gleiche Ergebnisse liegen mit Clodronsäure vor (38; s. Tab. 2). Eine Bisphosphonat-Therapie bei Patienten mit neoplastischen Erkrankungen und Knochenmetastasen verlängert nach diesen Resultaten zwar nicht das Leben, verbessert aber das Allgemeinbefinden und die Knochenschmerzen. Ob Bisphosphonate primär eine Skelettmetastasierung verzögern können, ist bisher nicht klar, aber auf Grund von Tier- und in-vitro-Untersuchungen sowie klinischen Beobachtungen möglich (37, 76).
Teil 2 dieser Übersicht mit ausführlichem Literaturverzeichnis erscheint in der nächsten Ausgabe (AMB 1998, 32, 49).