Änderungen des Zulassungsstatus auf der Basis von einzelnen Spontanberichten (Juli bis Dezember 1996)
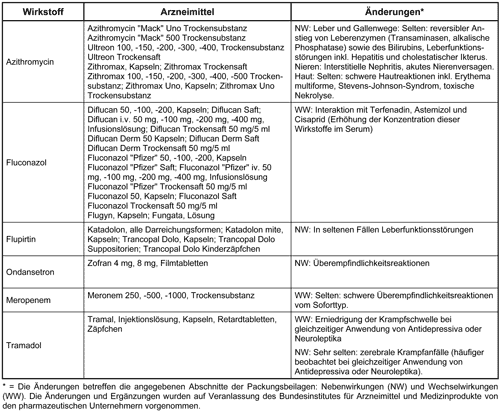
Änderungen des Zulassungsstatus auf der Basis von einzelnen Spontanberichten (Juli bis Dezember 1996)

Aripiprazol zur Behandlung der therapierefraktären Depression im Alter: Die OPTIMUM-Studie (vgl. ) Dr. J.S. aus W. schreibt: >> Sie führen in dem Artikel über die Behandlung der therapierefraktären Depression () im Alter auch den Wirkstoff Aripiprazol auf. Aripiprazol ist jedoch in Deutschland im Gegensatz zu den USA für die Behandlung einer Depression nicht zugelassen. Zumindest […]
Als Biosimilar wird ein Arzneimittel bezeichnet, das als arzneilich wirksamen Bestandteil eine strukturelle, biotechnologisch sehr ähnliche Version des Arzneistoffs eines bereits in der EU zugelassenen Biologikums (Referenzarzneimittel) enthält und eine ähnliche pharmakologisch-klinische Wirkung wie das Referenzarzneimittel hat. Aufgrund des unterschiedlichen gentechnischen Herstellungsprozesses kann ein Biosimilar in Bezug auf Struktur und Funktion jedoch nicht völlig identisch […]
Die Zahl der Apotheken in Deutschland ist in den letzten 8 Jahren um 13% gesunken, von 20.249 auf 17.571. Im Jahr 2023 schlossen 559 Apotheken, und nur 62 eröffneten neu . Hält dieses „Apothekensterben“ an, ist mit negativen Auswirkungen auf die wohnortnahe Gesundheitsversorgung zu rechnen. Derzeit beträgt die Apothekendichte in Deutschland 21 pro 100.000 Einwohner und liegt […]
Wir haben bereits 2005 und 2018 über pharmakogenetische Testungen berichtet . Mittlerweile bieten viele Labors solche Tests an, und einige private Krankenversicherungen versuchen, mit einem entsprechenden Angebot Kunden zu gewinnen. Angeblich soll die Behandlung mit Arzneistoffen durch die Kenntnis des pharmakogenetischen Profils effektiver und sicherer sein. Die Pharmakogenetik trifft Aussagen über die individuelle „metabolische Ausrüstung“ […]
Eine renommierte Wissenschaftlerin aus der Schweiz (Kerstin N. Vokinger; Medizinerin und Juristin) hat sich kürzlich in einem Perspektivartikel im N. Engl. J. Med. zusammen mit einem Autor aus China (Li Guanqiao) und aus den USA (Oliver J. Wouters) einem auch für Europa künftig sehr relevanten Thema gewidmet: der zunehmenden Entwicklung innovativer Arzneimittel in China sowie deren […]
Niemand kann ihr entkommen. Auf den Straßen, in öffentlichen Gebäuden, in Tageszeitungen, im Fernsehen, im Radio und in den Online-Medien: überall gibt es Werbung zu Schmerz- und Erkältungsmitteln, Vitaminen, Mittel gegen Schwindel, Vergesslichkeit, Inkontinenz, Arthrose, trockene Augen, Hitzewallungen, Herpes und Erektionsstörungen. Dazu kommt „Aufklärung“ zu Impfungen, gegen FSME, Pneumokokken, Gürtelrose, HPV und Grippe, zur Krebsfrüherkennung, […]
Wir hatten bereits in der Juli-Ausgabe des ARZNEIMITTELBRIEFs anhand des AMNOG-Reports 2025 der Deutschen Angestellten Krankenversicherung (DAK) auf die deutliche Steigerung der Arzneimittelausgaben für die gesetzliche Krankenversicherung (GKV) in Deutschland hingewiesen, ebenso wie auf die von den Autoren des AMNOG-Reports als notwendig erachtete stärkere Einnahmeorientierung . Das Deutsche Ärzteblatt hat sich in seiner Ausgabe vom […]
Die konventionelle Entwicklung von Arzneistoffen ist ein zeit- und kostenintensiver Prozess. Die Dauer bis zur Marktzulassung bei nicht-beschleunigten Verfahren beträgt üblicherweise > 10 Jahre und die Kosten nach den kaum überprüfbaren Angaben der pharmazeutischen Unternehmer bis 2,5 Mrd. US-$. Sie verläuft üblicherweise in mehreren prädefinierten Phasen: Identifizierung einer geeigneten molekularen Zielstruktur = „Target Identification“; Screening vieler tausend unterschiedlicher […]
Das Arzneimittelmarktneuordnungsgesetz (AMNOG) führte 2011 in Deutschland die frühe Nutzenbewertung von neuen Arzneimitteln durch den Gemeinsamen Bundesausschuss (G-BA) ein. Der G-BA bewertet seitdem den Zusatznutzen eines neuen Medikaments im Vergleich zu einer zweckmäßigen Vergleichstherapie (ZVT). Die Ergebnisse dieser Bewertung dienen als Grundlage für die anschließenden Preisverhandlungen zwischen den pharmazeutischen Unternehmern (pU) und dem GKV-Spitzenverband , . […]
Etwa 50-65% der erwachsenen Patienten in den Hausarztpraxen klagen über Schlafstörungen. Dabei handelt es sich um ein breites Spektrum und bei weitem nicht nur um Ein- und Durchschlafstörungen. Die dritte Ausgabe der Internationalen Klassifikation von Schlafstörungen (ICSD-3-TR; ) nennt sieben Hauptkategorien (s. Tab. 1). Die exakte Diagnose ist entsprechend nicht einfach zu stellen. Oft überlappen sich die Kategorien […]