Die Hemmung der Thrombozytenaggregation ist ein zentraler pharmakologischer Ansatzpunkt bei der Vorsorge und Behandlung arteriosklerotischer Herz- und Gefäßkrankheiten. ASS ist die Basismedikation, darüber hinaus werden in besonderen Situationen Heparine, GPIIb/IIIa-Rezeptor-Blocker und die ADP-Rezeptor-Blocker Clopidogrel (C) oder Prasugrel eingesetzt. Für alle ist eine gute klinische Wirksamkeit nachgewiesen (1-5). Gibt es da noch Lücken für Innovationen?
Clopidogrel ist ein Prodrug. Es muss zunächst intrahepatisch enzymatisch (Zytochrome) in die wirksame Form überführt werden. Dieser Stoffwechselschritt ist durch Interaktionen mit Arzneimitteln (z.B. Protonenpumpen-Hemmmer; 6) und genetische Polymorphismen beeinflussbar. Daher ist die Wirksamkeit von Clopidogrel nicht immer konstant und zuverlässig. Außerdem ist die ADP-Rezeptor-Blockade für die gesamte Lebenszeit der Thrombozyten irreversibel. Prasugrel wirkt etwas schneller und intensiver, blockt aber ebenfalls den ADP-Rezeptor der Thrombozyten irreversibel. Die Wirksamkeit ist von genetischen Polymorphismen unabhängig. Die lang dauernde Gerinnungshemmung stört aber die Planung notwendiger Operationen und steigert das Blutungsrisiko bei so vorbehandelten Patienten. Pharmakologische Fortschritte in der Hemmung der Thrombozytenaggregation sind also wünschenswert.
Jetzt wurde im N. Engl. J. Med. und im Lancet die PLATO-Studie (7-10) vorgestellt, eine Mammut-Untersuchung, in der Ticagrelor (T), ein neuartiger Hemmer der Thrombozytenaggregation, klinisch untersucht wurde. In Voruntersuchungen war er rascher, kürzer und intensiver wirksam als C. Er wird in vivo nicht metabolisiert, interferiert also auch nicht mit dem Zytochromsystem wie C und Prasugrel. Sponsor der Studie war der Hersteller AstraZeneca.
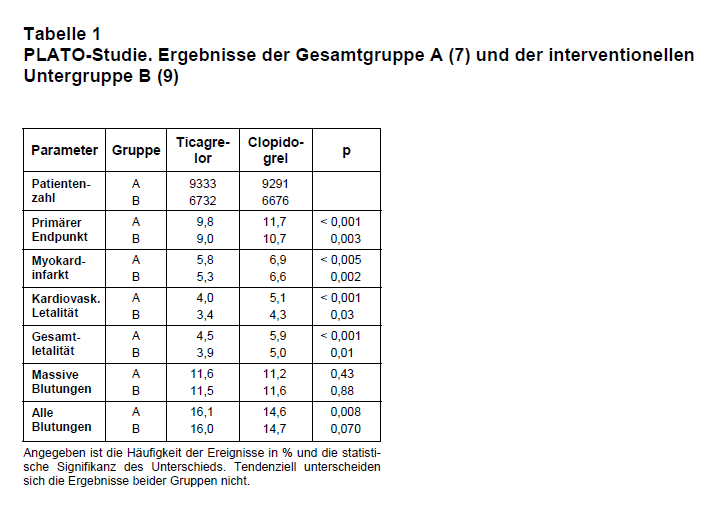
Methodik: In die multizentrische (862 Zentren in 43 Ländern!), doppeltblinde, randomisierte Studie wurden 18 624 Patienten mit Akutem Koronarsyndrom (ACS) mit oder ohne ST-Hebung eingeschlossen (7). Behandelt wurde mit 180 mg T als Loading dose, danach zweimal 90 mg/d bzw. mit 300-600 mg C als Loading dose und danach 75 mg/d 12 Monate lang. Im Lancet (9) wird eine Untergruppe von 13 408 Patienten beschrieben, bei der eine interventionelle Therapie geplant war.
Ergebnisse: Die Ergebnisse beider Veröffentlichungen (7, 9) sind in Tab. 1 dargestellt und werden gemeinsam diskutiert. Prinzipiell unterscheiden sie sich nicht. Sollte diese doppelte Veröffentlichung etwa dazu dienen, stärker auf die neue Substanz aufmerksam zu machen?
Insgesamt trat der kombinierte primäre Endpunkt (kardiovaskuläre Letalität, Myokardinfarkt oder Schlaganfall) und Myokardinfarkt allein unter T signifikant seltener auf als unter C; zudem war nicht nur die kardiovaskuläre, sondern auch die Gesamtletalität niedriger. T führte nicht häufiger zu massiven Blutungen als C. Leichte Blutungen waren allerdings häufiger. 50% aller Patienten erhielten Protonenpumpen-Hemmer, die die Wirksamkeit von C einschränkt haben könnten. Atemnot ist eine für Thrombozytenaggregationshemmer ungewöhnliche UAW. Sie trat bei T signifikant häufiger auf als bei C (13,8% vs. 7,8%; p = 0,001). Im Langzeit-EKG wurden in der ersten Behandlungswoche auch ventrikuläre Pausen > 3 sec (ohne begleitende Synkopen) signifikant häufiger registriert (5,8% vs. 3,6%).
Diskussion: Auch in der TRITON-Studie (4) fand sich unter Behandlung mit Prasugrel eine bessere antithrombotische Wirksamkeit als unter C, allerdings waren auch die massiven Blutungen häufiger. Es ergab sich daher, im Unterschied zur PLATO-Studie, keine geringere Gesamtletalität. Der Unterschied zwischen Prasugrel und T könnte auf die kürzere Wirkdauer von T zurückzuführen sein. Vor allem die Blutungen im Zusammenhang mit dringlichen Bypass-Operationen waren nämlich unter T seltener, möglicherweise, weil die Gerinnungshemmung kürzer dauert. Bessere antithrombotische Wirksamkeit und dennoch seltener bedrohliche Blutungen könnten ein Fortschritt sein. Das Editorial von G.W. Stone (10) zur Veröffentlichung im Lancet (9) endet mit dem Satz „Ticagrelor ist ein Meilenstein, der die Versorgung von Patienten mit Akutem Koronarsyndrom neu definieren sollte.” Vielleicht ist der so allgemein formulierte Optimismus überzogen. Zumindest aber gibt es eine zusätzliche differenzialtherapeutische Alternative für solche Patienten, die hinsichtlich atherothrombotischer Rezidive oder Blutungen besonders gefährdet sind oder bei denen mit einer Operation gerechnet werden muss.
Außer den Blutungen sind aber auch andere Risiken der neuen Therapie zu bedenken: 1. T muss zweimal täglich eingenommen werden. Das gefährdet die Adhärenz. 2. Die UAW Atemnot ist noch nicht endgültig einzuordnen. 3. In der PLATO-Studie nahm etwa die Hälfte der Patienten Protonenpumpen-Hemmer ein, die die Wirkung von C abgeschwächt haben könnten (11). Die Wirksamkeit von T könnte also überschätzt sein. 4. Die Kosten von T sind noch nicht bekannt.
Fazit: Ticagrelor ist ein neuartiger Hemmer der Thrombozytenaggregation mit – im Vergleich zu Clopidogrel – rascherem Wirkungseintritt und kürzerer und intensiverer Wirkung ohne Zunahme bedrohlicher Blutungen. Die klinische Bedeutung (Nutzen, Risiken, Kosten-Nutzen-Verhältnis) der noch nicht zugelassenen Substanz (vorgeschlagener Handelsname Brilinta®) ist zur Zeit nicht ausreichend zu beurteilen.
Literatur
- Baigent, C., et al. (ISIS-2 = Second International Study of Infarct Survival): BMJ 1998, 316, 1337. Link zur Quelle
- CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischemic Events): Lancet 1996, 348, 1329 Link zur Quelle. AMB 1997, 31, 13a. Link zur Quelle
- Yusuf, S., et al. (CURE Clopidogrel in Unstable angina to prevent Recurrent Events trial): N. Engl. J. Med. 2001, 345, 494 Link zur Quelle. AMB 2001, 35, 83. Link zur Quelle
- Wiviott, S.D., et al. (TRITON-TIMI 38 = TRial to assess Improvement in Therapeutic Outcomes by optimizing platelet InhibitioN with prasugrel – Thrombolysis In Myocardial Infarction 38): N. Engl. J. Med. 2007, 357, 2001 Link zur Quelle . AMB 2008, 42, 05. Link zur Quelle
- AMB 1999, 33, 33. Link zur Quelle
- AMB 2009, 43, 26. Link zur Quelle
- Wallentin, L., et al.: (PLATO = PLATelet inhibition and patient Outcomes): N. Engl. J. Med. 2009, 361, 1045. Link zur Quelle
- Schömig, A.: N. Engl. J. Med. 2009, 361, 1108. Link zur Quelle
- Cannon, C.P., et al. (PLATO = PLATelet inhibition and patient Outcomes): Lancet 2010, 375, 283. Link zur Quelle
- Stone, G.W.: Lancet 2010, 375, 263. Link zur Quelle
- AMB 2009, 43, 73. Link zur Quelle