Zusammenfassung: Zur Behandlung starker akuter und chronischer Schmerzen sind Opioide ein unverzichtbarer Bestandteil. Opioide unterscheiden sich in ihrer analgetischen Potenz, Pharmakokinetik und in ihren Applikationsformen. Bei eingeschränkter Nieren- und/oder Leberfunktion sollten solche Opioide gewählt werden, die weitgehend unabhängig von der Nieren- oder Leberfunktion abgebaut werden oder keine aktiven Metabolite haben, da es sonst zu erheblichen UAW und Überdosierungen kommen kann. Die Einstellung auf Opioide bei starken chronischen Schmerzen erfolgt prinzipiell auf ein retardiertes orales Präparat. Ausnahmen sind Patienten mit z.B. Schluckstörungen und Störungen der gastrointestinalen Resorption. Die Opioid-Therapie bei Patienten mit Tumorschmerzen unterscheidet sich deutlich von der Therapie bei nicht-tumorbedingten Schmerzen. Diese sollte sich an der aktuellen S3-Leitlinie LONTS (Langzeitanwendung von Opioiden bei nicht-tumorbedingten Schmerzen) orientieren. Schnellwirkende Opioide sollten dabei wegen des hohen Suchtpotenzials nur in Ausnahmefällen bei akuten, nicht mit Analgetika der Stufe I nach WHO beherrschbaren Schmerzzuständen, nur zur Dosisfindung und nur wenige Tage lang eingesetzt werden. Schnellwirkende Opioide haben einen hohen Stellenwert bei der Behandlung von Patienten mit Durchbruchschmerzen bei malignen Tumorerkrankungen. Die Verordnungen neuerer stark wirkender Opioid-Präparate haben in den letzten Jahren stark zugenommen. Dieser Zuwachs basiert nicht auf Ergebnissen kontrollierter klinischer Studien mit dem Nachweis einer Überlegenheit gegenüber Morphin, sondern in erster Linie auf dem intensiven Marketing der pharmazeutischen Unternehmen.
Zur Behandlung von akuten und chronischen tumorbedingten und nicht-tumorbedingten Schmerzen stehen zahlreiche Opioide zur Verfügung. Fast alle gibt es inzwischen in retardierter und nicht-retardierter Form sowie in verschiedenen Applikationsformen: oral, bukkal, rektal, transdermal, i.v. und seit 2010 auch nasal. Einige Opioide können darüber hinaus auch rückenmarksnah (epidural oder intrathekal) verabreicht werden. Da sich die Opioide in ihrer Pharmakokinetik unterscheiden, muss bei Patienten mit eingeschränkter Nieren- oder Leberfunktion gegebenenfalls die Dosis reduziert werden oder es müssen Opioide ohne stark wirksame aktive Metaboliten verordnet werden. Je nach analgetischer Potenz werden schwach oder mittelstark wirkende Opioide (= Stufe-II-Opioide im WHO-Stufenschema) von stark wirkenden Opioiden (Stufe-III-Opioide im WHO-Stufenschema) unterschieden (s. Tab. 1).
Einordnung der Opioide in die Schmerztherapie: Das WHO-Stufenschema wurde vor mehr als 25 Jahren zur Therapie tumorbedingter Schmerzen veröffentlicht. Es gibt eine gute Übersicht über die verschiedenen Analgetika (s. Tab. 1). Invasive Techniken werden häufig als Stufe IV angefügt, sollen aber hier nicht näher besprochen werden (1, 9).
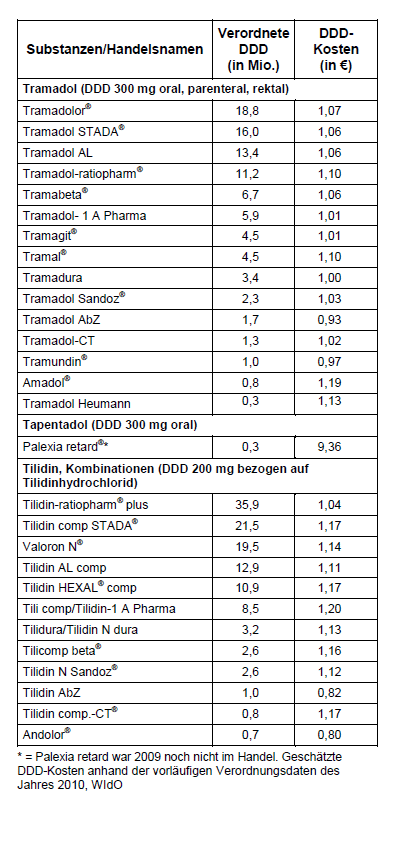
Stufe-II-Opioide: Tramadol, Tilidin: Die schwach bzw. mittelstark wirkenden Opioide Tramadol und Tilidin stehen seit vielen Jahren zur Behandlung chronischer Schmerzen zur Verfügung (2), wobei Tilidin häufiger zur Behandlung nicht-tumorbedingter Schmerzen eingesetzt wird und kontrollierte Studien zum Einsatz von Tilidin (in Kombination mit Naloxon) bei Tumorschmerzen nicht vorliegen (32). Bei beiden Opioid-Analgetika ist die Tageshöchstdosis zu beachten, oberhalb der keine stärkere analgetische Wirkung mehr zu erwarten ist. Sie werden üblicherweise oral eingenommen und sind als retardierte und nicht-retardierte Präparate erhältlich. Die maximale Tagesdosis von Tramadol beträgt 400 mg. Bei eingeschränkter Nierenfunktion kumulieren aktive Abbauprodukte, die eine Dosisreduktion erforderlich machen. Tramadol hemmt über einen zusätzlichen Mechanismus die Wiederaufnahme von Serotonin und Noradrenalin und kann mit selektiven Serotonin- und Noradrenalin-Wiederaufnahme-Hemmern interagieren, die häufig zur Behandlung neuropathischer Schmerzen eingesetzt werden. Eine Kombination muss vermieden werden (13). Bei etwa 10% der weißen Bevölkerung liegt ein Polymorphismus von CYP2D6 (verantwortlich für die Bildung der aktiven Metaboliten) vor, so dass bei diesen Patienten die analgetische Wirksamkeit reduziert ist (34).
Die maximale Tagesdosis von Tilidin beträgt 600 mg. Es wird in der Leber zum aktiven Metaboliten Nortilidin umgewandelt. Bei Patienten mit stark eingeschränkter Leberfunktion ist zu bedenken, dass Tilidin in geringerem Maße in Nortilidin umgewandelt wird und somit möglicherweise nicht ausreichend wirkt. Bei eingeschränkter Nierenfunktion ist keine Reduktion der Dosierung erforderlich, denn es kumulieren keine aktiven Metabolite. Retardiertem Tilidin ist industriell Naloxon zugegeben, was den Missbrauch als Droge minimieren soll. Nicht-retardierte Tramadol- und Tilidin-Tropfen haben ein hohes Suchtpotenzial, da die Anflutung im ZNS sehr schnell ist. Beide Schmerzmittel unterliegen in Deutschland nicht der Betäubungsmittelverordnung (BtMVV) und können auf normalen Rezepten verordnet werden. Damit ist Diebstahl und Fälschen der Rezepte leichter. In der Vergangenheit gab es Initiativen, auch schwach wirkende Opioide der BtMVV zu unterstellen. Das hohe Suchtpotenzial erfordert eine besonders sorgfältige Indikation für Tilidin- und Tramadol-Tropfen. Dieses Problem sollte stets offen mit den Patienten besprochen sowie die Verordnungsmenge exakt dokumentiert und kontrolliert werden. Eine Indikation für nicht-retardierte Stufe-II-Opioide ergibt sich nur zu Beginn der Therapie im Rahmen der Dosisfindung und sollte nach wenigen Tagen beendet werden. Eine Ausnahme davon ist die Behandlung von Durchbruchschmerzen bei Patienten mit fortgeschrittener Tumorerkrankung. Stufe-II-Opioide nach WHO werden mit Stufe-I-Analgetika (z.B. Paracetamol, nicht-steroidale Antirheumatika/NSAID, Metamizol) kombiniert, wenn Schmerzen durch Nicht-Opioid-Analgetika nicht beherrscht werden.
Stufe-III-Opioide: Morphin: Morphin ist das älteste und preisgünstigste Opioid. Es gilt weiterhin als Goldstandard (32, 35, 36). Ergebnisse aus randomisierten kontrollierten Studien (RCT) oder systematischen Übersichtsarbeiten, die eine Überlegenheit neuerer, zunehmend häufig verordneter µ-Opioid-Rezeptoragonisten (z.B. Hydromorphon, Oxycodon, Fentanyl, Methadon) gegenüber Morphin hinsichtlich Wirksamkeit oder Verträglichkeit belegen, existieren nicht (36). Der biologisch aktive Metabolit Morphin-6-Glucuronid wird renal eliminiert und kumuliert bei eingeschränkter Nierenfunktion. Auch bei eingeschränkter Leberfunktion muss die Dosis angepasst bzw. rechtzeitig auf ein anderes stark wirkendes Opioid gewechselt werden. Morphin liegt in nahezu allen Applikationsformen vor (Tropfen, Zäpfchen, retardierte und nicht-retardierte Tabletten, Trinkampullen, Brausetabletten, Ampullen zur i.v. Injektion in verschiedenen Stärken) und hat seit langem einen hohen Stellenwert bei der Behandlung akuter und chronischer Schmerzen (3-6). Alle Äquivalenzdosen anderer Opioide sind auf das Referenzopioid Morphin berechnet (s. Tab. 2).
Hydromorphon (Palladon®): Aktive Metabolite entstehen in geringerer Menge als bei Morphin. Deshalb wird dieser µ-Opioid-Rezeptoragonist bei starker Einschränkung der Nierenfunktion bevorzugt. Einen Vorteil hat der Wirkstoff auch aufgrund seiner wenigen Interaktionen mit anderen Arzneimitteln, die Folge geringer Bindung an Plasmaeiweiße ist (3-6, 35).
Oxycodon mit Zusatz von Naloxon (Targin®): Auf Nachteile dieses oralen 2:1-Kombinationspräparats mit dem µ-Opioid-Rezeptoragonisten Oxycodon und dem kompetitiven Opioid-Antagonisten Naloxon (Unterschiede in der Maximaldosis und Pharmakokinetik, begrenzte Datenlage aus ausschließlich vom Hersteller gesponserten klinischen Studien) sowie die stark zunehmende Verordnung sind wir bereits ausführlich eingegangen (30, s.a. 33). Naloxon bindet an die submukösen μ-Rezeptoren der Darmwand und soll dadurch die Opioid-induzierte Darmträgheit vermindern. Dennoch benötigen etwa die Hälfte der Patienten auch unter Targin® Laxanzien. Die maximal zugelassene Dosis beträgt aktuell 80 mg Targin®/d. Für höhere Dosen gibt es keine Daten zur Verträglichkeit und zur dabei möglichen zentralen Naloxon-Wirkung, d.h. Abschwächung der Analgesie. UAW im Sinne des Opioidentzugs sind jedoch beschrieben. Trotz des hohen Preises wird Targin® in der Chirurgie viel verordnet, wenn z.B. nach abdominalchirurgischen Eingriffen eine zusätzliche Obstipation durch Schmerzmittel vermindert werden soll. Es liegen jedoch keine vom Hersteller unabhängige klinische Studien vor, die der wichtigen Frage nachgehen, ob durch die konsequente Verordnung stark wirkender Opioide kombiniert mit Laxantien das gleiche Ergebnis (Vermeidung der Obstipation) kostengünstiger als mit Targin® erreicht wird.
Oxycodon ohne Zusatz von Naloxon (Oxygesic®, mehrere Generika) ist in Form nicht-retardierter und retardierter Präparate auf dem Markt. Allen diesen Präparaten ist gemeinsam, dass sie einen Anteil von etwa einem Drittel Wirkstoff haben, der schnell anflutet, dass die Wirkung nach ca. 10-20 Minuten eintritt und dass somit im eigentlichen Sinne kein retardiertes Präparat vorliegt (11). Die Folge davon ist, dass es eine erhebliche Zahl von Patienten mit chronischen, nicht-tumorbedingten Schmerzen gibt, die eine Abhängigkeit von diesen Präparaten entwickelt haben. Beim Wechsel auf ein anderes Opioid bzw. bei einer Dosisreduktion von Oxycodon bekommen sie stärkere Entzugserscheinungen als bei einem Wechsel von einem anderen Opioid bzw. bei Dosisreduktion eines Opioids ohne schnell anflutende Komponente. Entscheidet man sich für Oxycodon, ist diese Besonderheit zu beachten und unbedingt mit dem Patienten zu besprechen. Kontrollierte Studien zu diesem praktisch sehr wichtigen Problem sind unseres Wissens bisher nicht veröffentlicht worden.
Oxycodon hat eine Wirkung am μ-Opiat-Rezeptor, wie alle anderen Opioide auch, und zusätzlich eine Wirkung am κ-Opiat-Rezeptor. Die klinische Bedeutung (z.B. bessere analgetische Wirksamkeit bzw. Verträglichkeit) dieses theoretischen Vorteils gegenüber den anderen Opioiden ist jedoch bisher ebenso wenig wie die angeblich bessere Wirkung von Oxycodon bei neuropathischen Schmerzen durch aussagekräftige klinische Studien belegt worden (36). Inzwischen gibt es Veröffentlichungen, die zeigen, dass neuropathische Schmerzen generell auch mit anderen Opioiden behandelt werden können und Oxycodon nicht der Vorzug zu geben ist (6-8, 12). Für die Dosisreduktion von Oxycodon bei Leber- oder Niereninsuffizienz gelten die gleichen Regeln wie für Morphin.
Fentanyl (Durogesic®, Generika): Fentanyl ist ein µ-Opioid-Rezeptoragonist mit hoher Lipidlöslichkeit, der in retardierter Form zur transdermalen Applikation (Membranpflaster) vorliegt. Für Patienten, die Opioid-Analgetika nicht oral einnehmen können, z.B. bei Schluckstörungen infolge HNO-Tumoren oder bei gestörter gastrointestinaler Resorption, und bei Patienten mit chronischen (tumorbedingten) Schmerzen, die stabile Opioid-Dosen benötigen, sind Fentanyl-Pflaster eine geeignete Alternative (32, 37). Fentanyl-Pflaster werden zunehmend, z.T. sogar in höherer Dosierung, Patienten verordnet, die zuvor nicht mit Stufe-III-Opioiden behandelt wurden (38). Dies erhöht das Risiko für schwerwiegende UAW. Die Pflaster müssen alle zwei (sehr selten) bis drei Tage erneuert und dabei jeweils eine neue Hautstelle gewählt werden. Es ist jedoch zu beachten, dass die Wirkspiegel nur dann zuverlässig erreicht werden, wenn die Pflaster korrekt kleben. An Stellen starker Schweißsekretion dürfen sie nicht platziert werden. Auch nimmt die Resorption bei erhöhter Körpertemperatur zu, was zu Überdosierungen führen kann. Dagegen ist bei schlechter peripherer Durchblutung die Resorption vermindert. Die Schmerzen können dann zunehmen, z.B. bei der Palliativbetreuung in der Sterbephase. Hier ist eine orale, s.c. oder i.v. Applikation zuverlässiger. Wird das Pflaster aufgeklebt, dauert es 8-12 Stunden bis der Wirkspiegel erreicht ist. Akute Schmerzen können also nicht transdermal mit Fentanyl behandelt werden. Ebenso lange besteht die Wirkung weiter, wenn das Pflaster entfernt wird. Eine Überdosierung erfordert daher eine Überwachung von 8-12 Stunden. Dosisänderungen wirken sich erst mit entsprechender Verzögerung aus. Es erfordert Erfahrung, in dieser Situation nicht-retardierte Präparate zusätzlich einzusetzen. Bei Patienten mit Leber- oder Nierenfunktionsstörungen sollte sorgfältig auf Anzeichen einer Fentanyl-Toxizität geachtet und gegebenenfalls die Dosis reduziert werden.
Zur Behandlung von Durchbruchschmerzen bei tumorbedingten Schmerzen sind verschiedene nicht-retardierte Präparate von Fentanyl auf dem Markt. Ihre Zulassung besteht nur dafür! Sie fluten schnell an, ähnlich wie bei i.v. Applikation und sind in der Mundhöhle als Sublingual-, Lutsch- oder Bukkaltablette oder nasal als Spray anzuwenden. Diese Applikationsform hat ein noch höheres Sucht- und damit auch Missbrauchpotenzial als nicht-retardierte Tabletten. Die Verantwortung, an diese Zusammenhänge zu denken und sich an die vorgeschriebene Zulassung zu halten, liegt beim verordnenden Arzt.
Die durchschnittlichen Kosten für eine Dosis schnellwirksamen Fentanyls sind hoch und liegen bei 8-12 € für eine Einmaldosis von 200-400 μg. Die bukkale (mehrere Stunden lang saurer Geschmack bei versehentlicher Berührung mit der Zunge) oder nasale Anwendung als Spray erfordert einen kooperativen Patienten mit guter Adhärenz. Bei nasaler Applikation sollte ein Spray verwendet werden, bei dem die entnommene Dosis ebenso eindeutig zu erkennen ist wie die noch vorhandenen Dosen. Es können sonst Unklarheiten über die verabreichte Menge auftreten, und es ist schwierig, auftretende UAW eindeutig zuzuordnen. Die sublinguale Anwendung ist etwas einfacher und geschmacksneutral (3-5, 10).
Buprenorphin (Temgesic®, Transtec® u.a.): Buprenorphin ist ein Agonist am μ-Rezeptor und hat antagonistische Wirkungen am κ-Rezeptor. Buprenorphin gibt es in transdermaler retardierter Form als Pflaster. Je nach Präparat muss alle 3,5 oder alle 7 Tage gewechselt werden. Prinzipiell gelten dieselben Grundsätze zur transdermalen Therapie wie bei Fentanyl. Ein nicht-retardiertes Präparat ist Temgesic® 0,2 mg oder 0,4 mg sublingual. Die Wirkdauer ist mit ca. sechs Stunden deutlich länger als bei anderen nicht-retardierten Opioiden. Für hohe Dosen ist ein so genannter Ceiling-Effekt beschrieben, d.h., eine weitere Dosissteigerung von Buprenorphin ist nicht stärker analgetisch wirksam, wie es sonst bei allen anderen Stufe-III-Opioiden der Fall ist (4-6). Buprenorphin erfordert keine Dosisanpassung bei eingeschränkter Nierenfunktion.
Tapentadol (Palexia®): Tapentadol ist seit 1.10.2010 als retardiertes Präparat auf dem Markt. Es hat strukturell Ähnlichkeiten mit Tramadol und Oxycodon. Der Wirkmechanismus ist anders als bei anderen stark wirkenden Opioiden und vereint, wie Tramadol, in einem Molekül die Wirkung am μ-Rezeptor als Agonist und eine Noradrenalin-Wiederaufnahme-Hemmung, d.h. eine analgetische Wirkung, wie sie auch von einigen Antidepressiva bekannt ist. Die Zulassung besteht für „starke chronische Schmerzen bei Erwachsenen, die eine Behandlung mit Opioiden notwendig machen”. Die bisher vorliegenden, vom Hersteller unterstützten und vom Design her identischen drei doppeltblinden, plazebokontrollierten RCT bei Patienten mit nicht-tumorbedingten Schmerzen (Osteoarthritis der Kniegelenke bzw. Rückenschmerzen) ergaben, dass Tapentadol besser verträglich war als vergleichsweise hoch dosiertes Oxycodon hinsichtlich Übelkeit, Erbrechen, Obstipation und Juckreiz (39). Schwindel, Benommenheit, Kopfschmerzen, Übelkeit und Verstopfung zählen jedoch laut Fachinformation auch bei Tapentadol zu den häufigen UAW (40). Mit dem im Wirkungsmechanismus ähnlichen Tramadol wurde Tapentadol in klinischen Studien bisher nicht verglichen und RCT zur Wirksamkeit von Tapentadol bei tumorbedingten Schmerzen liegen nicht vor. Eine zuverlässige Einordnung von Tapentadol in das WHO-Stufenschema ist deshalb nicht möglich. Insgesamt lassen die Ergebnisse der vorliegenden klinischen Studien nicht erkennen, dass das sehr teure Tapentadol (s. Tab. 3) einen überzeugenden therapeutischen Fortschritt darstellt (14, 15, 39). Das Scottish Medicines Consortium hat in einer aktuellen Bewertung Tapentadol deshalb in Schottland nur zum eingeschränkten Gebrauch für die Behandlung schwerer chronischer Schmerzen zugelassen (39). Die Einschränkung besagt, dass nur solche Patienten mit Tapentadol behandelt werden dürfen, bei denen retardiertes Morphin keine ausreichende Schmerzkontrolle erreichte oder nicht vertragen wurde. Bei Patienten mit mäßig eingeschränkter Leberfunktion ist die Dosis von Tapentadol zu reduzieren und bei stark eingeschränkter Leber- oder Nierenfunktion sollte dieses neue Analgetikum nicht angewendet werden. Interaktionen von Tapentadol mit serotoninergen Stoffen, wie selektiven Serotonin-Wiederaufnahme- und Monoaminooxidase-Hemmern müssen beachtet werden.
Methadon: Levomethadon (L-Polamidon®) ist wegen der langsamen Elimination ein schlecht steuerbares Opioid-Analgetikum. Die Wirkung tritt rasch ein und beträgt 6-12 Stunden. Es kann oral in flüssiger Form, i.v., s.c. oder i.m. angewendet werden. In der Palliativmedizin wird es gelegentlich eingesetzt bei therapieresistenten Schmerzen, bei denen andere Opioide nicht ausreichend wirken. Es ist von der WHO als Alternative zu Morphin empfohlen. Bei Patienten im Methadon-Substitutionsprogramm erfolgt die Behandlung akuter Schmerzen über eine Dosisanpassung des Opioids. Die Therapie mit Methadon ist speziell erfahrenen Ärzten vorbehalten und erfordert zu Beginn ein engmaschiges Monitoring des Patienten (6, 18, 19).
Einige Grundregeln der Tumorschmerz-Therapie mit Opioiden: In den letzten Jahren ist der Umgang mit Opioiden und die Indikation zur Verordnung kritisch betrachtet worden. Zunehmend finden sich in schmerztherapeutischen Einrichtungen Patienten mit nicht-tumorbedingten langjährigen Schmerzen, die trotz hoch dosierter Opioide keine ausreichende analgetische Wirkung erleben, jedoch durch die UAW der Opioide stark eingeschränkt sind: Tagesmüdigkeit, Konzentrationsstörungen, Obstipation, Entwicklung von Abhängigkeit (20, 21). Andererseits kommen Patienten in schmerztherapeutische Ambulanzen mit stärksten Schmerzen bei metastasierten Tumoren und begrenzter Lebenserwartung, die entweder gar nicht oder völlig unzureichend mit Opioiden versorgt sind. Häufig werden auch die wichtigsten UAW, Übelkeit und Obstipation, nicht adäquat behandelt, d.h. es wurden keine Antiemetika oder Laxanzien fest verordnet. Deshalb sind die Indikationen und Regeln der Therapie tumorbedingter Schmerzen von denen nicht-tumorbedingter Schmerzen getrennt zu betrachten (vgl. 23, 32).
Die Behandlung tumorbedingter Schmerzen erfolgt prinzipiell mit retardierten Präparaten. Zusätzlich benötigen diese Patienten ein schnell wirkendes Opioid zur Behandlung der unerwartet und in hoher Intensität auftretenden Durchbruchschmerzen. In idealer Weise, jedoch nicht zwingend, sollte es derselbe Wirkstoff sein. Wichtig hierbei ist, das richtige Verhältnis von Tagesdosis des retardierten Präparats zur Dosis des schnell wirkenden Präparats zu beachten, da dieses sonst nicht ausreichend analgetisch wirkt. Prinzipiell gilt, dass die Dosis der Bedarfsmedikation 1/6 bis 1/10 der Tagesdosis betragen sollte. Erhält z.B. ein Patient dreimal 60 mg/d Morphin (= 180 mg/d), muss die Bedarfsmedikation im Bereich von 20-30 mg Morphin liegen. Ist die Bedarfsmedikation ein anderer Wirkstoff, sind die Äquivalenzdosen exakt zu beachten (z.B. 20 mg Morphin entsprechen 4 mg Hydromorphon oder 200 μg Fentanyl; s.a. Tab. 2). Zeigt die Bedarfsmedikation nach ungefähr drei bis maximal 30 Minuten (unterschiedlich je nach Präparat) keine analgetische Wirkung, kann die Dosis wiederholt werden. Als Orientierung für den Patienten sollte die Häufigkeit der Bedarfsmedikation fest benannt werden, z.B. „alle 1-2 Stunden möglich”. Ohne eine solche Angabe bestehen beim Patienten erhebliche Unsicherheiten.
Der Beginn einer Opioidtherapie erfordert, so genannte Adjuvanzien (z.B. Laxanzien, Antiemetika) zur Behandlung der UAW fest anzusetzen. Die hauptsächlichen UAW der Opioide sind Übelkeit zu Beginn der Therapie und Obstipation, die möglicherweise die gesamte Zeit der Behandlung anhält. Entsprechend werden Antiemetika und Laxanzien fest verordnet und der Patient darüber aufgeklärt (9, 10, 12, 14, 22, 30). Insbesondere bei Beginn einer Opioidtherapie, bei Einnahme schnell wirkender Präparate, bei Dosiserhöhung und bei Kombination mit anderen sedierenden Medikamenten kann im Einzelfall das Reaktionsvermögen soweit beeinträchtigt sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen eingeschränkt ist. Darüber muss der Patient aufgeklärt werden, und diese Aufklärung ist schriftlich zu dokumentieren (31). Unter einer stabilen Einstellung mit retardierten Opioiden scheint die Fahrtüchtigkeit jedoch nicht wesentlich beeinträchtigt zu sein (35).
Treten unter einer Opioidtherapie trotz Gabe von Adjuvanzien starke, anhaltende UAW auf oder ist die Analgesie trotz adäquater Gabe von Koanalgetika und angemessener Dosissteigerung nicht ausreichend, kann ein Wechsel des Opioids (Opioid-Rotation) sinnvoll sein (35, 41). Von Experten wurden kürzlich Empfehlungen für die Opioid-Rotation ausgesprochen, gleichzeitig aber betont, dass die aus klinischen Studien vorliegende Evidenz für einen Wechsel der Opioide sehr gering ist und ein Konsens für ein „best practice” Vorgehen derzeit nicht existiert (41).
Opioide zur Behandlung chronischer nicht-tumorbedingter Schmerzen: Wie bereits erwähnt, gibt es zahlreiche Patienten, die bei nicht-tumorbedingten Schmerzen langjährig mit Opioiden behandelt werden, ohne dass sich eine Reduktion der Schmerzen und/oder eine verbesserte Lebensqualität durch Veränderung der Schmerzsymptomatik nachweisen lässt. International wird zunehmend häufiger über behandlungsbedürftige Suchterkrankungen diskutiert, die durch legal verordnete Opioide ohne erkennbare analgetische Wirkung entstanden sind (20, 21, 26). Im Jahr 2009 wurde die S3-Leitlinie zur Langzeitanwendung von Opioiden bei nicht tumorbedingten Schmerzen (LONTS) veröffentlicht (23). Sie wurde von 29 Schmerzexperten aus verschiedenen Fachgesellschaften im Auftrag und mit finanzieller Unterstützung der Deutschen Gesellschaft zum Studium des Schmerzes e.V. (DGSS) zwischen 2006 und 2009 erarbeitet. Seither ist sie hart kritisiert, aber auch verteidigt worden (24-28). Sicher ist, dass bei nicht durch Tumore bedingten Schmerzen in Deutschland viel zu häufig Opioide verordnet werden.
Die Leitlinie beinhaltet folgende Kernaussagen zur langfristigen Opioidtherapie von nicht-tumorbedingten chronischen Schmerzen: Opioidhaltige und andere Analgetika bewirken bei der Behandlung chronischer nicht-tumorbedingter Schmerzen nach einer Einstellungsphase bis zu zehn Wochen ohne Unterschied eine nur geringe Linderung der Schmerzen. Die Umstellung auf ein Opioid sollte erst nach Abklärung psychiatrischer Komorbiditäten, Ausschluss von Kontraindikationen und Versagen aller anderen medikamentösen und nicht-medikamentösen Therapiemaßnahmen erfolgen. Die Vor- und Nachteile einer Opioidtherapie sind nach umfassender Anamnese, gründlicher Untersuchung und ausführlicher individueller Aufklärung des Patienten mit ihm zu besprechen. Die orale Applikation eines retardierten Präparats nach einem festen Zeitschema ist zu bevorzugen. Bereits nach sechs Wochen sollte die Wirksamkeit der Opioide hinsichtlich Schmerzlinderung und Funktionsverbesserung überprüft werden. Der Versuch einer Dosisreduktion und/oder einer Opioidpause sollte nach 3-6 Monaten erfolgen. Über drei Monate hinausgehende Daueranwendungen opioidhaltiger Analgetika haben nachweislich keine Schmerzlinderung erbracht.
Orientierender Verordnungs- und Kostenvergleich: Tab. 3 vergleicht neben der Zahl der ärztlichen Verordnungen im Jahr 2009 auch orientierend die Kosten einiger Stufe-III-Opioide. Dabei müssen die Dosierungen definiert sein, deren Kosten verglichen werden und außerdem, wo die Preise bezahlt werden (Herstellerabgabe; Apothekenverkauf; Krankenhaus; gesetzliche Krankenversicherung = GKV). DER ARZNEIMITTELBRIEF legt, wie der Arzneiverordnungs-Report, die national und international abgestimmte, möglichst äquipotente, mittlere Tagesdosierung für Erwachsene zu Grunde (DDD = Defined Daily Dose). Sie wird unter Berücksichtigung der Herstellerangaben, der nationalen Verbrauchsdaten und unter wesentlicher Beteiligung der WHO festgelegt und jährlich im Arzneimittelindex vom wissenschaftlichen Institut der Ortskrankenkassen mitgeteilt. Es handelt sich dabei also nicht etwa um Behandlungsempfehlungen, sondern um medizinische und ökonomische Maß- und Vergleichseinheiten (16). Die Preise in Tab. 3 sind den Tabellarien der GKV Arzneimittelausgaben entnommen, wie sie regelmäßig im Arzneiverordnungs-Report veröffentlicht werden. Sie wurden mit Hilfe des wissenschaftlichen Instituts der Ortskrankenkassen für Juni 2011 aktualisiert.
Die Zahlen in Tab. 3 verdeutlichen, dass der Verordnungsanteil an Morphin, der vor 12 Jahren noch über 60% der Verordnungen für stark wirkende Opioide ausmachte, heute eine untergeordnete Rolle spielt und nur noch etwa 15% beträgt (17). Insbesondere die Verordnungen von Fentanyl, aber auch von Oxycodon, Hydromorphon und Buprenorphin, sind deutlich angestiegen und im Jahre 2009 entfielen mehr als die Hälfte der verordneten Tagesdosen auf die transdermal angewendeten Wirkstoffe. In einer kürzlich veröffentlichten Auswertung wurden die Verordnungen von Fentanyl-Pflastern in den Jahren 2004-2006 anhand einer pharmakoepidemiologischen Datenbank mit Ergebnissen von vier Krankenkassen und insgesamt 14 Millionen Versicherten innerhalb der GKV analysiert. Die Ergebnisse dieser Auswertung (38) belegen eindrucksvoll das Ausmaß der Über- bzw. Fehlversorgung mit Fentanyl-Pflastern in Deutschland (z.B. Einsatz bei zuvor nicht mit Opioiden behandelten Patienten und bei akuten Schmerzen) und verdeutlichen, dass Empfehlungen für den rationalen Einsatz von transdermalem Fentanyl (37) ebenso wie Warnhinweise in den Fachinformationen nicht ausreichend beachtet werden. Auch der anhaltend starke Anstieg der Verordnungen von Oxycodon bzw. Oxycodon mit Zusatz von Naloxon (Targin®) basiert nicht auf Ergebnissen kontrollierter klinischer Studien mit Nachweis einer Überlegenheit dieser neueren, stark wirkenden Opioide gegenüber Morphin, sondern in erster Linie auf den intensiven Marketingaktivitäten der pharmazeutischen Unternehmen. Das Kombinationspräparat Targin® zeigte auch in 2010 einen massiven Verordnungszuwachs und macht inzwischen mehr als ein Drittel der Oxycodonverordnungen aus (42).
Literatur
- World HealthOrganization. Cancer Pain Relief. Genf: World Health Organization, 1986.
- Bromm, B., et al.:Fortschr. Med. 1989, 107,385. Link zur Quelle
- Tegeder, I., et al.:Schmerz 1999, 13, 183. Link zur Quelle
- Barkin, R.L., et al.:Rheum. Dis. Clin. North Am.2007, 33, 1. Link zur Quelle
- Nikolaus, T., und Zeyfang, A.:Drugs Aging 2004, 21, 19. Link zur Quelle
- Jage, J., et al.:Anaesthesist 2008, 57, 491. Link zur Quelle
- Reid, C.M., et al.:Arch. Intern. Med. 2006, 166, 837.Link zur QuelleErratum: Arch. Intern. Med. 2006, 166, 2387.
- Cicero, T.J., et al.: J.Pain 2005, 6, 662. Link zur Quelle
- Azevedo São LeãoFerreira, K., et al.: Support. CareCancer 2006, 14, 1086 16761128. Link zur Quelle
- Donner, B., et al.: J. Pain Sympt. Manage. 1998, 15, 168. Link zur Quelle
- FachinformationOxycodon retard betapharm, 2007. Link zur Quelle
- van den Beuken-van Everdingen, M.H., etal.: Pain 2007, 132, 312. Link zur Quelle
- Baron, R., et al.: Lancet Neurol. 2010, 9, 807. Link zur Quelle
- Wild, J.E., et al.: Pain Pract. 2010, 10, 416. Link zur Quelle
- Buynak, R., et al.: Expert Opin. Pharmacother. 2010, 11, 1787. Link zur QuelleErratum: Expert Opin. Pharmacother. 2010, 11, 2773.
- Schwabe, U.: http://www.akdae.de … Link zur Quelle (Zugriff 9.9.2011)
- Coca, V., und Nink, K. in Schwabe, U., und Paffrath,D. (Hrsg.): Arzneiverordnungs-Report 2010, Springer Verlag Berlin, Heidelberg.S. 949.
- Hampel, C., et al.: Schmerz 2006, 20,445. Link zur Quelle
- Bausewein, C., et al. (Hrsg.): LeitfadenPalliativmedizin/Palliative Care, 3. Aufl. 2007, Urban & Fischer, München.S. 351.
- Maier, C., et al.: Pain2002, 97, 223. Link zur Quelle
- Cicero, T.J., et al.:Pain 2008, 139, 127. Link zur Quelle
- van den Beuken-vanEverdingen, M.H., et al.: Ann. Oncol.2007, 18, 1437. Link zur Quelle
- Reinecke, H., und Sorgatz, H. (S3-Leitlinie LONTS = Langzeitanwendungvon Opioiden bei Nicht Tumorbedingten Schmerzen):Schmerz 2009, 23, 440. Link zur Quelle http://www.awmf.org … Link zur Quelle (Zugriff9.9.2011)
- Sorgatz, H., und Maier, C.: Schmerz 2010, 24,309. Link zur Quelle
- Überall, M., et al.:MMW-Fortschr. Med. Supplement2010, 1, 3. http://www.schmerz-therapie-deutschland.de Link zur Quelle (Zugriff 9.9.2011)
- Compton, W.M., und Volkow, N.D.: Drug Alcohol Depend.2006, 81, 103. Link zur Quelle
- Überall, M.: Schmerztherapie 4/2010: Link zur Quelle (Zugriff 9.9.2011)
- Schmidt, H., et al.: Schmerz 2010, 24, 71. Link zur Quelle
- Pereira, J., et al.: J.Pain Sympt. Manage. 2001, 22, 672. Link zur Quelle
- AMB 2009, 43,65. Link zur Quelle
- AMB 2009, 43,89. Link zur Quelle
- http://www.akdae.de/Arzneimitteltherapie/TE/Archiv/Tumorschmerzen.pdf Link zur Quelle (Zugriff 9.9.2011)
- Sax, P.: Israel Drug Bulletin 2011, 17, No.102. Link zur Quelle (Zugriff 9.9.2011)
- Arzneimittelkommission der deutschen Ärzteschaft:Arzneiverordnungen, 22. Auflage
- Nauck, F.: internistische praxis 2010, 50,143.
- Quigley, C.: Clin. Evid. 2008, 7,2408. Link zur Quelle Link zur Quelle(Zugriff 9.9.2011)
- AMB 2001, 35,68. Link zur Quelle
- Garbe, E., et al.:Pharmacoepidemiol. Drug Saf. 2011; DOI: 10.1002/pds 21681850. Link zur Quelle
- Scottish Medicines Consortium:Resubmission tapentadol, 50, 100, 150, 200 and 250 mg prolonged-releasetablets. Link zur Quelle (Zugriff 9.9.2011)
- FachinformationTapentadol. Link zur Quelle
- Fine, P.G., und Portenoy, R.K.: J. PainSymptom Manage. 2009, 38, 418. Link zur Quelle
- Schwabe, U., und Paffrath, D. (Hrsg.):Arzneiverordnungs-Report 2011, Springer Verlag Berlin, Heidelberg, im Druck.