Zusammenfassung: Patienten mit nachgewiesener Myokardischämie und medikamentös kontrollierbaren Symptomen müssen nicht routinemäßig koronarangiographiert werden. Sie können nach den Ergebnissen der ISCHEMIA-Studie ebenso sicher primär konservativ behandelt werden, wenn die Basisbehandlung („gesunder Lebensstil“ mit Aufgabe Rauchens und medikamentös) gemäß den Leitlinien erfolgt und eine regelmäßige Nachsorge garantiert ist. Gleiches gilt auch für Patienten mit zusätzlicher fortgeschrittener oder terminaler Niereninsuffizienz, bei denen ein deutlich höheres Risiko für kardiale Ereignisse besteht. Dieses Vorgehen gilt nicht für Patienten mit akutem Koronarsyndrom, koronarer Hauptstamm-Stenose, niedriger Ejektionsfraktion, hochsymptomatischer Herzinsuffizienz und Patienten, die trotz optimaler Arzneimitteltherapie nicht tolerierbare Symptome haben.
Ist es vertretbar, einen 64-jährigen Mann, der 3-4mal Angina pectoris (AP) pro Monat bei nachgewiesener Vorderwand-Ischämie hat, primär konservativ zu behandeln, also nur mit Arzneimitteln und individuellen Veränderungen des Lebensstils, oder sollte er doch besser zu einer Koronarangiographie mit dem Ziel einer Revaskularisation angemeldet werden? Muss eine 55-jährige Diabetikerin mit einer präterminalen Niereninsuffizienz (GFR 25 ml/min) und gelegentlichem Thoraxdruck zu einem Stresstest angemeldet werden und, wenn dieser positiv ausfällt, dann zu einer Koronarangiographie mit dem Ziel einer Revaskularisation?
Die Mehrzahl der Kardiologen würde wohl zu einer aktiven Abklärung und einem invasiven Vorgehen raten, zumal dieser Eingriff minimal invasiv und schnell verfügbar ist und die AP-Symptome danach meist gebessert sind. Viele haben auch die Sorge, dass bei einem konservativen Vorgehen maligne Arrhythmien auftreten (vgl. 1). Auch die 2019 aktualisierten Leitlinien der Europäischen Gesellschaft für Kardiologie zur Behandlung der chronischen koronaren Herzerkrankung (KHK) tendieren in solchen Situationen zu einem invasiven Vorgehen. Aber weder die ORBITA-Studie (verblindet, randomisiert; kein Endpunkt-Vorteil für Koronarangioplastie = PCI vs. Sham-Prozedur) noch die COURAGE-Studie (randomisiert; kein Endpunkt-Vorteil für PCI vs. primär konservative Therapie) werden in dieser Leitlinie nach unserer Einschätzung angemessen gewürdigt (vgl. 2).
Im April wurden im N. Engl. J. Med. nun endlich die Ergebnisse der ISCHEMIA-Studie in vier getrennten Publikationen mitgeteilt (3-6). Es ist eine „Meilensteinstudie“, über die wir bereits in der Dezemberausgabe 2019 kurz berichtet haben (2). Die Besonderheiten von ISCHEMIA im Vergleich zu allen früheren, ähnlichen Studien bestehen darin, dass alle Patienten vor Randomisierung einen positiven Ischämienachweis haben mussten und eine invasive Diagnostik erst nach der Randomisierung erfolgte.
ISCHEMIA wurde vom National Heart, Lung, and Blood Institute der USA durchgeführt und mit Unterstützung pharmazeutischer Unternehmer finanziert. In die Hauptstudie wurden in den Jahren 2012-2018 insgesamt 5.179 Patienten an 320 Zentren in 37 Ländern eingeschlossen. In einer Substudie mit dem Akronym ISCHEMIA-CKD wurden zudem 777 Patienten mit chronischer Niereninsuffizienz untersucht – davon mehr als die Hälfte dialysepflichtig (5).
Hauptstudie: Eingeschlossen wurden Patienten mit einer nachgewiesenen, mindestens moderaten, reversiblen myokardialen Durchblutungsstörung in einem klinisch indizierten Ischämietest. Dabei handelte es sich bei 75% um ein bildgebendes Verfahren: bei Myokardszintigraphie mit ≥ 10% Ischämie, bei Stressechokardiographie mit Wandbewegungsstörung in mindestens 3 von 16 Segmenten oder bei Stress-MRT mit mindestens 12% Ischämie und/oder Wandbewegungsstörung in mindestens 3 von 16 Segmenten. Wegen der bekannten Probleme mit der Spezifität dieser Tests mussten die Befunde noch von einer unabhängigen Stelle (Core-Labor) bestätigt werden. Bei knapp 25% der Patienten erfolgte der Ischämienachweis mittels Belastungs-EKG (typische AP bei Belastung, horizontale ST-Senkung ≥ 1,5 mm in ≥ 2 Ableitungen oder ≥ 2 mm in einer Ableitung). Diese Option war ursprünglich nicht vorgesehen, wurde aber nachträglich wegen Rekrutierungsproblemen ins Protokoll aufgenommen.
Die meisten der eingeschlossenen Patienten erhielten zusätzlich ein Koronar-CT zur Bestätigung einer ursächlichen Koronarsklerose und zum Ausschluss einer bedeutsamen Hauptstamm-Stenose (≥ 50%) der linken Koronararterie. Bei 27% erfolgte kein CT, weil die Koronaranatomie bereits bekannt war oder eine Kontraindikation für ein CT vorlag.
Ausgeschlossen waren u.a. Patienten mit einem kurz zurückliegenden akuten Koronarsyndrom oder einer PCI, einer stark eingeschränkten Nierenfunktion (GFR < 30 ml/min), einer bedeutsamen Herzinsuffizienz (linksventrikuläre Ejektionsfraktion = LVEF < 35%, NYHA-Klasse III oder IV) und inakzeptabler AP trotz ausreichender medikamentöser Therapie.
Intervention: Die Patienten wurden in 2 Gruppen randomisiert: entweder zu einer initial invasiven Strategie mit Koronarangiographie plus gegebenenfalls Revaskularisation (PCI oder Bypass) plus leitliniengemäßer Sekundärprävention oder zu einer initial konservativen Strategie mit leitliniengemäßer Sekundärprävention und einer Koronarangiographie nur bei Therapieversagen, z.B. Auftreten eines akuten Koronarsyndroms, ischämischer Herzinsuffizienz oder therapierefraktärer AP.
Die Sekundärprävention musste nach den geltenden Leitlinien (vgl. 2) erfolgen und bestand aus Interventionen im Lebensstil (Rauchstopp; ≥ 30 min Bewegung an ≥ 5 Tagen in der Woche; Ernährung mit < 7% gesättigten Fettsäuren; systolischer RR < 130 mmHg; LDL-Cholesterin < 70 mg/dl; BMI < 25 bzw. Reduktion um 10%; HbA1c < 8%) sowie Arzneimitteln (Thrombozytenfunktionshemmer oder orales Antikoagulans, Statin, Ezetimib und/oder Evolocumab, Betablocker bei einer Anamnese mit Myokardinfarkt oder LVEF < 40%, Hemmstoffe des Renin-Angiotensin-Aldosteron-Systems (RAAS) bei Hypertonie, Diabetes, LVEF < 40% oder GFR < 60 ml/min).
Primärer Studienendpunkt war ursprünglich eine Kombination aus zwei Ereignissen (Time-to-First-Event-Analyse): kardiovaskulärer Tod und nicht durch PCI ausgelöster Myokardinfarkt. Da die Ereignisrate niedriger war als erwartet, erfolgte 2018 eine damals zu Recht kritisierte Erweiterung (7) um drei deutlich „weichere“ Endpunktkomponenten: Hospitalisierungen wegen instabiler AP, Herzinsuffizienz oder nach Herzstillstand. Die AP-Intensität und die Lebensqualität waren sekundäre Endpunkte und wurden mittels Fragebögen erfasst. Diese subjektiven Endpunkte sind Gegenstand einer eigenen Publikation (4). Das ursprüngliche Studiendesign sah auch vor, 8.000 Patienten einzuschließen, die 4 Jahre nachbeobachtet werden sollten. Bereits 2015 wurde das Protokoll geändert und sowohl die Fallzahl reduziert als auch die Nachbeobachtungszeit verkürzt.
Ergebnisse: Es wurden 26.000 Patienten mit Ischämienachweis gescreent. Knapp die Hälfte erfüllten die Einschlusskriterien, und ein Drittel hatte zudem keine Ausschlusskriterien. Von den verbliebenen 8.518 Patienten wurden nochmals 3.339 ausgeschlossen, weil die Core-Labors die Diagnosen aus den Ischämietests nicht bestätigen konnten (15,8%) oder weil nach dem CT gar keine stenosierende KHK (14,3%) oder eine Hauptstamm-Stenose (5%) vorlag.
Von den 5.179 randomisierten Patienten wurden 2.588 initial invasiv und 2.591 initial konservativ behandelt. Die Basis-Charakteristika der Patienten waren etwa gleich: das mediane Alter betrug 64 Jahre, 77% waren Männer, 73% Hypertoniker, 41% Diabetiker und 12% aktive Raucher (Prozentangaben jeweils abgerundet). Es hatten 19% einen Myokardinfarkt und 20% eine PCI in der Vorgeschichte. Mehr als ein Drittel der Patienten war beschwerdefrei: 10% hatten noch nie AP und 25% hatten seit mindestens einem Monat keine pektanginösen Beschwerden mehr, 44% gaben mehrfach pro Monat und 20% mehrfach in der Woche AP an. Der Seattle Angina Questionnaire (SAQ) Angina Frequency Score betrug im Mittel 88 Punkte, wobei 0-30 tägliche, 31-60 wöchentliche, 61-99 monatliche und 100 keine AP bedeutet. Dies wurde an Hand von Patienten-Tagebüchern bewertet.
Die mediane Nachbeobachtungszeit betrug 3,2 Jahre, und in beiden Gruppen konnten nur wenige Patienten nicht nachbeobachtet werden (2,5% bzw. 1,2%). Die Therapieadhärenz wird in beiden Armen mit 81% angegeben und die Arzneimitteltherapie und Stoffwechseleinstellung (RR, Cholesterin, HbA1c) waren bei der letzten Visite etwa gleich.
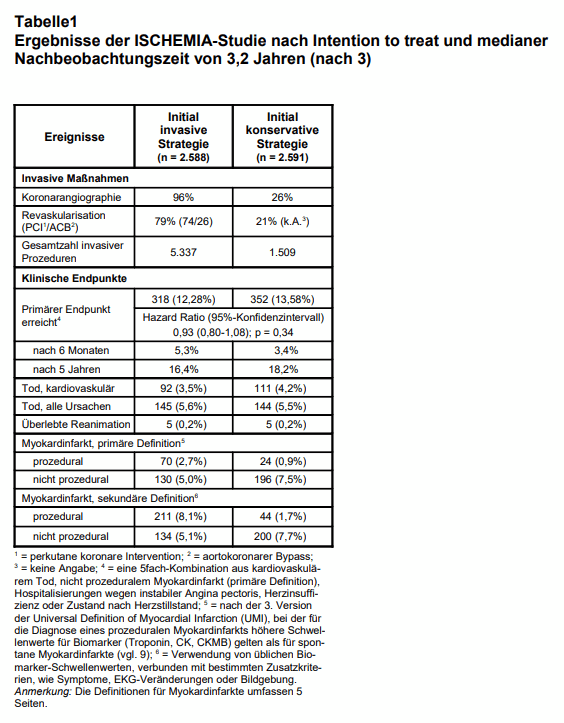
Die klinischen Ereignisse sind in Tab. 1 zusammengefasst. Es zeigte sich, dass nur ein Viertel der Patienten im konservativen Arm im Verlauf eine Koronarangiographie und 21% eine Revaskularisation erhielten. In diesem Stratum wurden 3.828 Prozeduren (Angiographien und Revaskularisationsmassnahmen) weniger durchgeführt. Bei < 13% der Patienten trat ein Endpunktereignis ein. Dies war deutlich weniger als kalkuliert (20% über 4 Jahre im konservativen Arm) und wird von den Autoren den wirksamen Maßnahmen im Rahmen der Sekundärprävention zugeschrieben.
Die invasive Strategie war hinsichtlich der untersuchten objektiven Endpunkte der primär konservativen Strategie nicht überlegen. Somit muss die Grundannahme der Studie (relative Risikoreduktion um 18% durch ein invasives Vorgehen) als widerlegt angesehen werden. Es fand sich sogar ein höheres frühes kardiales Risiko bei den invasiv behandelten Patienten, bedingt durch periprozedurale Komplikationen (v.a. Myokardinfarkte). Im Studienverlauf glich sich dieser Nachteil jedoch aus, und es wurden im konservativen Arm etwas mehr spontane Infarkte registriert. In beiden Armen starben gleich viele Patienten. Bei der Heterogenitätsanalyse konnte kein Patientenmerkmal identifiziert werden, das einen Vorteil bei invasivem Vorgehen anzeigt. Untersucht wurden u.a. Ausmaß der Ischämie, Vorliegen eines Diabetes, AP-Häufigkeit, Mehrgefäß-KHK oder ≥ 50% Stenose der proximalen Vorderwandarterie.
Der Gesundheitszustand der Patienten besserte sich in allen abgefragten Qualitäten (SAQ Summary Score, SAQ Angina Frequency Score, SAQ Quality of Life Score, SAQ Physical Limitation Score, Rose Dyspnea Scale und EQ-5D Visual Analogue Scale) und in beiden Behandlungsarmen jeweils rasch nach der Randomisierung. Den Patienten im invasiv behandelten Arm ging es leicht, aber signifikant besser als denen im konservativ behandelten Arm. Der mittlere SAQ-Wert (Summary Score) betrug nach 3 Monaten 84,7 vs. 81,8, nach 12 Monaten 87,2 vs. 84,2 und nach 36 Monaten 88,6 vs. 86,3. Der Unterschied von 2-3 Punkten ist zwar signifikant, aber auf einer 100-Punkte-Skala nur sehr klein. Da 35% der Patienten bei Studienbeginn gar keine AP hatten, lohnt sich eine Betrachtung der Patienten mit stärkeren Beschwerden: Bei Patienten mit täglicher oder wöchentlicher AP (n = 934) betrug die Differenz zwischen invasivem und konservativem Vorgehen nach 3 Monaten +8,5 und nach 36 Monaten +5,3 Punkte und bei Patienten mit monatlicher AP (n = 2.043) +5,5 und +3,1 Punkte. Die anfänglichen Vorteile der invasiven Strategie bei den subjektiven Endpunkten schwinden also mit der Zeit. Hier ist zu bedenken, dass das Open-Label-Design dieser Studie (keine Verblindung) die große Gefahr einer Bevorzugung des invasiven Vorgehens für diese subjektiven Endpunkte durch Plazeboeffekte und Observer Bias beinhaltet.
Substudie chronische Niereninsuffizienz: ISCHEMIA-CKD wurde 2 Jahre später als die Hauptstudie gestartet und an 118 Zentren in 30 Ländern durchgeführt (5). Alle Patienten mussten eine eGFR < 30 ml/min haben; ansonsten galten die meisten Ein- und Ausschlusskriterien wie in der Hauptstudie. Die Patienten erhielten aus Sicherheitsgründen kein Koronar-CT, um die Kontrastmittelexposition zu vermeiden. Auch die Kontrolle der Stresstests durch ein Core-Labor fiel weg, was die KHK-Diagnose viel ungenauer machte. Und auch der primäre Endpunkt war anders zusammengesetzt, es war eine Kombination aus Tod (alle Ursachen) und nicht-tödlichem Myokardinfarkt.
Wegen Rekrutierungsproblemen wurde auch ISCHEMIA-CKD im Nachhinein verkleinert, von geplanten 1.000 auf 777 Patienten. Das mediane Alter betrug 63 Jahre, 57% waren Diabetiker und 92% Hypertoniker. Es waren 53% dialysepflichtig, bei den Übrigen betrug die mediane eGFR 23 ml/min. Insgesamt hatten 48% keine AP, 39% AP mehrfach monatlich und 12% mehrfach wöchentlich (Prozentangaben abgerundet).
Im invasiven Arm (n = 388) erhielten 85% eine Koronarangiographie und 50% eine Revaskularisation (85% eine PCI und 15% einen ACVB). Bei 51% wurde eine Mehrgefäßerkrankung diagnostiziert, bei 57% eine Stenose der Vorderwandarterie. Von den mit Angiographie untersuchten Patienten hatten 26% trotz Ischämienachweis in Tests keine stenosierende KHK, was erneut ein schlechtes Licht auf die Spezifität dieser Tests wirft. Im konservativen Arm (n = 389) erhielten im Studienverlauf 31% eine Koronarangiographie und 19% eine Revaskularisation. Auch bei den Nierenkranken war der Arzneimittelgebrauch bei der letzten Visite in beiden Behandlungsarmen sehr ähnlich (100% Thrombozytenaggregationshemmer oder Antikoagulans, 95% Statin, 24% Ezetimib, 69% RAAS-Hemmer, 69% Betablocker).
Nach einer medianen Nachbeobachtungszeit von 2,3 Jahren trat der primäre Endpunkt im invasiven Arm bei 31,7% und im konservativen Arm bei 33,1% auf (adjustierte HR: 1,01; 95%-Konfidenzintervall = CI: 0,79-1,29; p = 0,95). Es gab keine Unterschiede bei der Todesrate, den Myokardinfarkten oder der Häufigkeit von Hospitalisierungen wegen AP oder Herzinsuffizienz. Die Patienten im invasiven Arm hatten jedoch eine höhere Inzidenz von Schlaganfällen (adjustierte HR: 3,76; CI: 1,52-9,32; p = 0,004) und die Subgruppe der Patienten mit noch nicht dialysepflichtiger Einschränkung der Nierenfunktion hatten ein höheres Risiko für eine Verschlechterung und Dialysepflichtigkeit.
Der Gesundheitsstatus war mit der invasiven Strategie nur vorübergehend besser als mit der konservativen (6). Die Differenz im SAQ-Summationswert betrug nach 3 Monaten +2,1 Punkte und nach 6 Monaten nur noch +0,5 Punkte. Ein Nutzen war nur bei Patienten mit täglicher oder wöchentlicher AP nachweisbar.
Das begleitende Editorial der ISCHEMIA-Studie stammt von zwei Nestoren der klinischen Kardiologie, Elliott Antman und Eugene Braunwald von der Harvard Medical School (8). Sie heben hervor, dass in beiden Studien mehr Patienten randomisiert wurden, als je in einer vergleichbaren Studie zuvor und dass bei den Patienten eine ausgezeichnete Kontrolle ihrer kardiovaskulären Risikofaktoren gelungen ist. Diese leitliniengetreue Sekundärprävention erkläre die geringe Ereignisrate. Es sei grundsätzlich denkbar, dass sich bei einer größeren Patientenzahl und/oder einer längeren Nachbeobachtungszeit doch ein signifikanter Vorteil bei invasiver Strategie gezeigt hätte. Sie empfehlen daher, die Patienten noch weiter zu beobachten. Außerdem schlagen sie vor, auf der Basis der erhobenen Daten einen Risiko-Score zu entwickeln, mit dem solche Patienten mit stabiler KHK identifiziert werden können, die von einer invasiven Strategie profitieren. Allerdings hat die primär invasive Strategie selbst bei den Hochrisikopatienten, wie den niereninsuffizienten mit den mehr als dreimal höheren Ereignisraten als bei den nierengesunden, keine deutlichen Vorteile zeigen können.
Die klinischen Fragen zu den beiden Patienten am Anfang unseres Artikels können somit wie folgt beantwortet werden: Der Patient mit stabiler AP kann erst einmal konservativ behandelt werden, wenn er keine Hauptstamm-Stenose und eine gute LV-Funktion hat, sich die Symptome gut behandeln lassen und er selbst nicht auf eine invasive Abklärung drängt („shared decision“ nach „informed consent“). Die diabetische Patientin mit fortgeschrittener Niereninsuffizienz sollte nur bei therapierefraktären Beschwerden oder anderen Merkmalen für ein höheres kardiales Risiko, wie Herzinsuffizienz, Blutdruckabfällen und ungünstiger EKG-Dynamik zu einer Koronarangiographie überwiesen werden. Über die geringe Spezifität der aufwändigen und teuren Stresstests wird künftig noch kritisch zu sprechen sein.
Literatur
- AMB 2018, 52, 48DB01. Link zur Quelle
- Knuuti, J., et al.: Eur. Heart J. 2020, 41, 407. Link zur Quelle Vgl. AMB 2019, 53, 89. Link zur Quelle
- Maron, D.J., et al.: (ISCHEMIA = International Study of Comparative Health Effectiveness with Medical and Invasive Approaches): N. Engl. J. Med. 2020, 382, 1395. Link zur Quelle
- Spertus, J.A., et al. (ISCHEMIA): N. Engl. J. Med. 2020, 382, 1408. Link zur Quelle
- Bangalore, S., et al. (ISCHEMIA-CKD = International Study of Comparative Health Effectiveness with Medical and Invasive Approaches-Chronic Kidney Disease): N. Engl. J. Med. 2020, 382, 1608. Link zur Quelle
- Spertus, J.A., et al. (ISCHEMIA-CKD): N. Engl. J. Med. 2020, 382, 1619. Link zur Quelle
- Rajkumar, C.A., et al.: Circ. Cardiovasc. Qual. Outcomes 2018, 11, e004665. Link zur Quelle
- Antman, E.M., und Braunwald, E.: N. Engl. J. Med. 2020, 382, 1468. Link zur Quelle
- Thygesen, K., et al.: Eur. Heart J. 2019, 40, 237. Link zur Quelle