Zusammenfassung: Grundlagen der Therapie bei neurokardiogenen Synkopen sind ärztliche Beratung (eventuell psychosomatische Mitbetreuung), verschiedene Allgemeinmaßnahmen (Vermeiden synkopenfördernder Situationen, Verhaltensweisen und Medikamente) und je nach Situation vermehrte Salz- und/oder Flüssigkeitszufuhr oder Kompressionsstrümpfe. Eine neue, sehr effektive Behandlungsstrategie scheint das kombinierte Kipptisch- und Stehtraining zu sein. In der medikamentösen Therapie gilt die Wirksamkeit von Betarezeptoren-Blockern (z.B. Atenolol, Metoprolol), Midodrin und Serotonin-Wiederaufnahme-Hemmern (z.B. Paroxetin, Fluoxetin, Sertralin) als gesichert. Wegen der breiten klinischen Erfahrung in der Behandlung der orthostatischen Hypotonie kann auch in besonderen Situationen Fludrokortison empfohlen werden. Die Wahl des Medikaments oder auch einer Kombination richtet sich nach eventuell vorliegenden Begleiterkrankungen (z.B. Hypertonie, Hypotonie, Depression) oder – falls durchgeführt – dem Ergebnis der Kipptisch-Untersuchung.
Pathophysiologie und klinische Symptome: Der Mechanismus der neurokardiogenen Synkope (NCS) ist durch Reflexe vermittelt. Die Trigger können sowohl psychisch als auch somatisch sein. Die häufigsten psychischen Auslöser sind Angst, Streß und Schmerz. Hierbei wird eine direkter Einfluß auf das Vasomotorenzentrum im Hirnstamm vermutet.
Auf somatischer Ebene können Dehydratation oder verminderter venöser Rückstrom durch das sog. „Pooling“ eine Reflexkaskade in Gang setzen (1). Ausgehend von Barorezeptoren im rechten Vorhof und im linken Ventrikel führt ein reflektorisch erhöhter Sympathikotonus zu Vasokonstriktion, Tachykardie und verstärkter linksventrikulärer Kontraktilität. Mechanorezeptoren in den Vorhöfen, Ventrikeln und Pulmonalarterien können in dieser Situation über Impulse zum dorsalen Vaguskern gegenregulatorisch den Vagotonus erhöhen. Daraus resultiert dann eine arterielle Hypotonie mit unterschiedlich stark ausgeprägter Bradykardie. Je nach Ausprägung spricht man von vasodepressorischer (überwiegend Vasodilatation), gemischter oder kardioinhibitorischer (überwiegend Bradykardie) NCS (2).
Die NCS hat klassischerweise Prodromalsymptome, wie uncharakteristisches Unwohlsein („Mir wird so komisch“), Schwindel, Schwarzwerden vor den Augen, Herzklopfen, von der Magengrube aufsteigendes Hitzegefühl, Schwitzen und Übelkeit. Die Patienten sind oft blaß. Eine Beschreibung findet man schon bei Wilhelm Busch:
„O Gott, da springt ein grüner, nasser,
erschrecklich großer Frosch ins Wasser,
Adele, die ihn hüpfen sah,
fällt um und ist der Ohnmacht nah!“.
Wichtig sind die Begleitumstände, die zur Synkope geführt haben (1, 3). Lang anhaltende Residualsymptome, wie Übelkeit und Schwäche, sind sehr häufig. Im Gegensatz dazu ist die orthostatische Kreislauf-Dysregulation nicht durch diese komplexen, reflexnervös bedingten pathophysiologischen Abläufe gekennzeichnet. Sie beginnt direkt nach dem Lagewechsel vom Liegen zum Stehen und kann durch den einfachen Schellong-Test diagnostiziert werden (4).
Oft ergibt sich die Diagnose der NCS aus der typischen Anamnese; dann sind weitere diagnostische Maßnahmen nicht erforderlich. Bei vielen Patienten fehlen allerdings typische Begleitsymptome und Auslösesituationen. Dann kann die Kipptisch-Untersuchung (KTU) häufig die Ätiologie aufdecken (5). Während einer Stehperiode von mindestens 45 Minuten mit einem Kippwinkel von 60° (-70°), an die sich eine milde medikamentöse Provokation anschließt (meist ein Hub Glyceroltrinitrat sublingual), werden kontinuierlich Herzfrequenz, Blutdruck und Bewußtseinszustand überwacht.
Allgemeinmaßnahmen: Zur allgemeinen basalen Therapie der NCS gehören:
- Aufklärung über die gutartige Natur der Erkrankung und Erlernen, Prodromi zu erkennen
- Vermeiden NCS-provozierender Situationen und Verhaltensweisen
- Maßnahmen, die bei Prodromi zu ergreifen sind
- Absetzen synkopenfördernder Medikamente
- Ggf. Verordnen von Kompressionsstrümpfen oder -strumpfhosen
- Ggf. psychosomatische Mitbetreuung
Durch Stellen der Diagnose und entsprechende Beratung werden die meisten Patienten bereits oligo- oder sogar asymptomatisch (3, 6, 7). Medikamentös müssen demnach nur solche Patienten behandelt werden, bei denen die Häufigkeit der Synkopen die „Lebensqualität“ deutlich beeinträchtigt und „Risiko-Patienten“, bei denen die Vorwarnzeit so kurz ist, daß sie nicht mehr reagieren können und Verletzungen möglich sind. Hierzu gehören auch Patienten, die bei Ausübung ihres Berufes unbedingt synkopenfrei sein müssen (8). Es gibt z.B. die Empfehlung, nach Synkope drei Monate lang auf das Autofahren zu verzichten, wenn der Auslösemechanismus nicht sicher vermieden werden kann (12).
Kipptisch-Training: Dies ist eine neue Therapieform. Dabei werden die Patienten in der Klinik seriell gekippt, bis sie durch dieses Training eine Stunde lang ohne Synkope stehen können. Daran schließt sich zu Hause ein Stehtraining an, bei dem die Patienten bis zu zweimal täglich und jeweils bis zu einer halben Stunde lang an eine Wand gelehnt stehen. Bisher sind drei Studien zu dieser Behandlung der NCS mit insgesamt etwa 100 Patienten publiziert; es wird von einem fast hundertprozentigen Therapieerfolg berichtet (9, 10, 11).
Medikamentöse Behandlung: Die der Zahl Studien zur medikamentösen Therapie der NCS ist kaum zu überschauen, aber nur wenige sind randomisiert und plazebokontrolliert. Das Problem aller dieser Studien ist die viel zu kleine Patientenzahl und die zu kurze Nachbeobachtungszeit. Es ist bei der Bewertung der Therapie auch zu bedenken, daß – unabhängig von der Behandlung bzw. spontan – über zwei Drittel der Patienten irgendwann asymptomatisch werden. Die Nachbeobachtungszeit muß mehrere Jahre betragen, da die NCS episodenhaft auftreten kann. Ein weiteres Problem ist die Definition von Studienendpunkten. So gilt z.B. ein Patient, der vor Beginn einer Behandlung sechs Synkopen pro Monat hatte, weiterhin als symptomatisch, wenn er unter Therapie eine einzige Synkope erleidet, obwohl dieser Patient sich deutlich gebessert fühlen kann. Das Ziel ist also häufig nicht die Heilung, sondern ein zufriedener Patient.
Angriffspunkte für eine medikamentöse Therapie der NCS sind an mehreren Stellen im Reflexbogen gegeben (13):
- A. Verbesserung des Volumenstatus
- B. Blockieren des erhöhten Sympathikotonus oder der aktivierten Mechanorezeptoren
- C. Beeinflussen der zentralen Verschaltung
- D. Blockieren des Vagotonus
- E. Blockieren des afferenten (venöses „Pooling“) und efferenten (arterielle Vasodilatation) Schenkels
A. Salz- und Flüssigkeitszufuhr; Mineralokortikoide: Wirkprinzip ist hier die Vergrößerung des zirkulierenden intravasalen Volumens, um einer möglichen Dehydratation oder dem venösen „Pooling“ entgegenzuwirken.
Eine Studie (14) fand eine Verbesserung der Orthostase-Toleranz während eines Beobachtungszeitraums von 2 Monaten unter zusätzlicher Kochsalzzufuhr (120 mmol NaCl/d), allerdings nur bei den Patienten, die zuvor wenig Salz zu sich genommen hatten. El-Sayed et al. (14) untersuchten doppeltblind, plazebokontrolliert (das Salz war in geschmacksneutralen Kapseln eingeschlossen) insgesamt 31 Patienten mit NCS (20 doppeltblind, 11 in einer offenen Studie) ohne zusätzliche kardiovaskuläre oder andere ödembildende Erkrankungen, die einen erhöhten Salzkonsum verboten hätten. 15 Patienten (70%) der Salzgruppe zeigten eine Verbesserung der orthostatischen Toleranz und eine Zunahme des Plasma- und Blutvolumens. Ähnliches wurde von Younoszai et al. (15) durch vermehrte Flüssigkeitszufuhr berichtet.
Gesunde Patienten mit NCS profitieren also möglicherweise von höherer Salzzufuhr – wenn auch in den vorliegenden Studien keine statistische Signifikanz diesen ärztlichen Rat stützt.
Haupteffekt des Mineralokortikoids Fludrokortison (9a-Kortison; Astonin H), einem vor allem bei Kindern und Jugendlichen angewendeten Medikament, ist die Zunahme des zirkulierenden intravasalen Volumens infolge vermehrter renaler Natriumrückresorption. Es gibt Hinweise auf zusätzliche Wirkungen im Sinne von Desensibilisierung der Barorezeptoren, Sensibilisierung von Blutgefäßen gegenüber Noradrenalin und Verminderung des Sympathikotonus (16, 17).
In einer Studie von Scott et al. wurden die Patienten randomisiert entweder mit Fludrokortison oder Atenolol unabhängig von der jeweiligen Synkopenform (vasodepressorische oder kardioinhibitorische) behandelt (18). Die Patienten waren aufgrund einer positiven KTU eingeschlossen worden. Nach 6 Monaten berichteten 83% der 58 Patienten über eine Besserung oder völliges Ausbleiben der Synkopen. Die Ergebnisse sind allerdings nicht nach den beiden Substanzen aufgeschlüsselt; es wird lediglich mitgeteilt, daß es in der Erfolgsrate keinen Unterschied gab.
Mehrere andere, nicht randomisierte Studien mit geringen Patientenzahlen beschreiben die Wirksamkeit von Mineralokortikoiden. Eine Studie von Grubb et al. fällt besonders auf (19). Bei 10 von 21 Kindern wurde die KTU nach Behandlung negativ, und nach 20 Monaten hatten 20 Kinder keine Synkopen mehr.
Als Nebenwirkungen können Hypertonie, Ödeme, Akne und Depressionen auftreten, in seltenen Fällen auch Hypokaliämie. Eine generelle Therapieempfehlung kann aus dieser Datenlage nicht abgeleitet werden. Allerdings wird – wohl wegen der großen klinischen Erfahrung in der Behandlung der orthostatischen Hypotonie – Fludrokortison (0,1-0,3 mg/d) auch zur Therapie der NCS bei solchen Patienten versucht, die nach Allgemeinmaßnahmen nicht symptomfrei werden, insbesondere bei rein vasodepressorischer NCS.
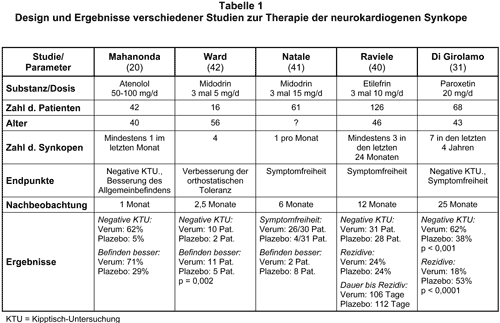
B. Betarezeptoren-Blocker; Disopyramid: Das Wirkprinzip der Beta-Blocker in der Behandlung der NCS besteht darin, daß durch die Abnahme der Kontraktilität des Myokards die Mechanorezeptoren vermindert aktiviert werden. Diese Substanzklasse ist bei NCS bisher wohl am häufigsten untersucht worden (insgesamt etwa 25 Studien mit über 800 Patienten). Dennoch gibt es nur eine plazebokontrollierte Studie von Mahanonda et al. mit Atenolol bei 42 Patienten (20; s. Tab. 1). In der Kontroll-KTU nach einem Monat waren in der Verum-Gruppe 62% gegenüber 5% der Patienten in der Plazebo-Gruppe frei von Synkopen. Eine Besserung des Befindens gaben 71% der Patienten unter Atenolol an gegenüber nur 29% unter Plazebo.
In einer anderen Untersuchung war Metoprolol Clonidin überlegen (21), in einer weiteren auch Verapamil (22).
Andere, allerdings nicht kontrollierte Studien bestätigen den positiven Eindruck (23, 24), so daß insgesamt die Wirksamkeit der Beta-Blocker als gesichert gelten kann. Es gibt allerdings auch eine Studie ohne positiven Therapieeffekt (25).
Bei Disopyramid, einem Klasse-Ia-Antiarrhythmikum, werden die negativ inotropen und anticholinergen Nebenwirkungen therapeutisch genutzt. Es gibt nur eine plazebokontrollierte Arbeit aus dem Jahr 1993 (26). Sowohl auf dem Kipptisch als auch während der Nachbeobachtung über 29 Monate war Disopyramid dem Plazebo nicht überlegen. Milstein et al. berichteten dagegen über eine positive Beeinflussung bei der KTU und über Symptomfreiheit bei 9 von 10 Patienten während eines Zeitraums von 20 Monaten (27). Weitere ältere Arbeiten beschreiben die Wirksamkeit von Disopyramid insbesondere bei Patienten, die nicht auf Beta-Blocker angesprochen hatten (28, 29), wobei in einer Untersuchung hohe Tagesdosen (bis zu 1200 mg) erforderlich waren (30).
Die anticholinergen Nebenwirkungen von Disopyramid (Mundtrockenheit, Obstipation, Harnverhalt) sind erheblich, am schwersten wiegt aber der potentiell proarrhythmische Effekt, der zur Torsades de pointes führen kann. Aufgrund dieser Tatsache und der eher unsicheren Datenlage zur Wirksamkeit, ist Disopyramid kein Mittel der ersten Wahl.
C. Serotonin-Wiederaufnahme-Hemmer (SSRI): Der Neurotransmitter Serotonin spielt eine Rolle in der Blutdruckregulation. Die Aktivierung von Serotonin-Rezeptoren setzt den Sympathikotonus herab und trägt damit vermutlich zur Hypotonie im Moment der Synkope bei.
Kürzlich ist eine plazebokontrollierte Studie mit Paroxetin erschienen (31; s. Tab. 1). Sie wurde an Patienten durchgeführt, bei denen andere Substanzen (Etilefrin, Propranolol, Fludrokortison und Disopyramid) versagt hatten. Bei der Kontroll-KTU nach einem Monat waren 62% in der Verum-Gruppe gegenüber 38% in der Plazebo-Gruppe negativ. Die Nachbeobachtungszeit betrug insgesamt 25 Monate; Endpunkt war das Wiederauftreten von Synkopen, nicht das Verhalten bei weiteren KTU. Auch hier schnitt die Verum-Gruppe mit 18% gegenüber 53% signifikant besser ab. Positive Ergebnisse gibt es auch mit Fluoxetin und Sertralin (32, 33).
Das Nebenwirkungsspektrum dieser Substanzgruppe umfaßt Angstzustände, Schlaf- und Appetitlosigkeit sowie Müdigkeit. Auch sind wichtige Interaktionen mit anderen Arzneimitteln zu bedenken, weil sie über dieselben Zytochrome abgebaut werden (vgl. AMB 2000,34,17).
D. Anticholinergika: Nur eine Arbeit mit insgesamt 60 Patienten hat bisher Scopolamin gegenüber Plazebo untersucht. Weder bei KTU noch während der Nachbeobachtungszeit war Scopolamin überlegen (34). Weitere, wenn auch positive, Berichte beruhen auf Beobachtungen bei einzelnen Patienten.
Zwei Studien mit Propanthelin zeigen einen positiven Einfluß bei der KTU und im Hinblick auf Synkopenrezidive (35, 36). Die Patientenzahlen sind aber klein, und es fehlen die Plazebo-Kontrollen.
E. Alpha-Agonisten: Alpha-Agonisten bewirken eine arterielle Vasokonstriktion mit Blutdrucksteigerung und über eine Tonuserhöhung der Venen eine Abnahme des „Pooling“.
In einer nicht randomisierten Studie besserte Ephedrin bei 15 von 16 jugendlichen Patienten während der Nachbeobachtungszeit von 12 Monaten die NCS-Symptome (37). Dies wurde von anderen Untersuchern bestätigt (20). Auch Etilefrin (Effortil u.v.a.) wurde in dieser Indikation sehr häufig verwendet (38). Skepsis kam durch eine Studie auf, in der beim Vergleich von Etilefrin mit Plazebo schließlich auch in der Plazebo-Gruppe bei seriellen KTU kaum noch Synkopen auszulösen waren (39). Nach einer doppeltblinden, plazebokontrollierten und randomisierten Multicenter-Studie mit 106 Patienten ist man heute überzeugt, daß Etilefrin in der Behandlung der NCS nicht wirksam ist (40; s. Tab. 1).
Anders sind die Ergebnisse mit Midodrin (Gutron); es existieren sowohl plazebokontrollierte (41, 42) als auch nicht plazebokontrollierte Arbeiten (43, 44), welche die Wirksamkeit bei NCS zeigen.
Natale et al. (41; s. Tab. 1) behandelten 30 Patienten sechs Monate lang mit Midodrin; davon erlitten 26 Patienten keine Synkopen mehr, zwei berichteten zusätzlich über eine deuliche Besserung des Allgemeinbefinden und lediglich ein Patient mußte die Therapie wegen Nebenwirkungen abbrechen. In der Plazebo-Gruppe wurden nur 4 Patienten symptomfrei und 8 im Allgemeinbefinden gebessert. Ward et al. randomisierten Midodrin gegen Plazebo in einem Cross-over-Design mit jeweils vierwöchiger Dauer (42; s. Tab. 1). Midodrin war sowohl in der KTU als auch in der Besserung des Allgemeinbefindens dem Plazebo überlegen; die „Lebensqualität“ wurde mit einer Skala gemessen.
Midodrin ist ein reiner Alpha-Agonist ohne beta-mimetische Aktivität, was die bessere Wirksamkeit gegenüber Etilefrin erklären könnte.
F. Übrige: Nelson et al. beschrieben die Wirksamkeit von Theophyllin bei NCS (45): 82% der behandelten Patienten waren in der KTU synkopenfrei, und immerhin 50% blieben es während der Nachbeobachtungszeit von 10 Monaten; allerdings mußten 7 von 14 Patienten die Therapie wegen Unverträglichkeit abbrechen. Clonidin wurde bisher einmal gegen Metoprolol geprüft und hat keine therapeutische Bedeutung erlangt (17); für Verapamil gilt gleiches wie für Clonidin (18). Die Beobachtung, daß ACE-Hemmer die Katecholaminfreisetzung aus sympathischen Nervenenden inhibieren können, führte zu ihrer Anwendung bei der NCS. Die einzige bisher erschienene Studie ist klein; eine Aussage über die Wirksamkeit der ACE-Hemmer bei NCS ist bisher noch nicht möglich (46).
Differentialtherapie und Maßnahmen bei Versagen der Therapie: Es fehlen Studien, in denen Patienten je nach bestimmten Reaktionsmustern während der KTU (z.B. vasodepressorische Synkope) oder nach Altersgruppen oder nach Begleiterkrankungen differenziert behandelt wurden. Deshalb können nur pathophysiologisch begründete Empfehlungen gegeben werden.
Bei begleitender arterieller Hypertonie ist sicher ein Beta-Blocker die primäre Wahl. Ebenso bei Patienten, bei denen adrenerge Stimuli als häufige Auslöser vermutet werden. Besteht eine Neigung zur Hypotonie oder scheint ein Volumenmangel auslösend zu sein, sollte Fludrokortison gegeben werden und auf gute Hydratation geachtet werden. Bei Nichtansprechen kann Midodrin versucht werden. SSRI werden zur Zeit bei Versagen dieser drei Medikamente verwendet; als primäre Therapie der NCS sind sie bei Patienten mit depressiven Begleitsymptomen geeignet. Für die Auswahl der medikamentösen Therapie kann auch das Ergebnis der KTU richtungsweisend sein. So könnte z. B. ein Patient mit rein vasodepressorischer Reaktion bei der Synkope mit Mineralokortikoid und Alpha-Agonist behandelt werden.
Bei therapierefraktären Patienten, insbesondere mit kardioinhibitorischer Form der NCS, kann eine Schrittmachertherapie diskutiert werden. Diese ist allerdings niemals ein frühzeitiger Schritt, vor allem nicht bei jüngeren Patienten (47). Die Ausschöpfung aller konservativer Behandlungsverfahren, inklusive psychosomatischer Mitbetreuung (48), und eine Persistenz der Symptome über mindestens ein Jahr nach Diagnosestellung ist hier zu fordern.
Literatur
1. Sutton, R.: Eur. Heart J. 1999, Suppl. D, 109.
2. Sutton, R., et al.: Eur. J. Pacing Electrophysiol. 1992, 3, 180.
3. Klingenleben, T., et al.: Z. Kardiol. 1995, 84, 137.
4. Thulesius, O., et al.: Z. Kreisl. Forsch. 1961, 61, 742.
5. Benditt, D., et al.: J. Am. Coll. Cardiol. 1996, 28, 263
6. Benditt, D., et al.: Circulation 1999, 100, 1242.
7. Grubb, B.P., und Olshansky, B. (Hrsg.): Syncope. Mechanisms and management. Futura Publishing, Armonk (NY), 1998.
8. Bloomfield, D., et al.: Am. J. Cardiol. 1999, 84, 33Q.
9. Ector, H., et al.: PACE 1998, 21, 193.
10. Reybrouck, T., et al.: Eur. Heart J. 1999, 20, 639A.
11. Di Girolamo, E., et al.: Circulation 1999, 100, 1798.
12. Li, H., et al.. Am. J. Cardiol. 2000, 85, 184.
13. Calkins, H.: Am. J. Cardiol. 1999, 84, 20Q.
14. El-Sayed, H., et al.: Heart 1996, 75, 134
15. Younoszai, A.K., et al.: Arch. Pediatr. Adolesc. Med. 1998, 152, 165.
16. Bannister, R.: Multiple system atrophy and pure autonomic failure. In Low, P. (Hrsg.): Clinical autonomic disorders. Little Brown & Co., Boston, 1993. S. 517.
17. Mion, D.R., et al.: Hypertension 1994, 23, 123.
18. Scott, W.A., et al.: Am. J. Cardiol.1995, 76, 400.
19. Grubb, B.P., et al.: PACE 1992, 15, 742.
20. Mahanonda, N., et al.: Am. Heart J. 1995, 130, 1250.
21. Biffi, M., et al.: Heart 1997, 77, 268.
22. Jhamb, D.K., et al.: Am. Heart J. 1996, 132, 608.
23. Cox, M., et al.: J. Am. Coll. Cadiol. 1995, 26, 1293.
24. Natale, A., et al.: PACE 1995, 18, 655.
25. Sheldon, R., et al.: Am. J. Cardiol. 1996, 78, 536.
26. Morillo, C.A., et al.: J. Am. Coll. Cardiol. 1993, 22, 1843.
27. Milstein, S., et al.: Am. J. Cardiol. 1990, 65,1339.
28. Leor, J., et al.. Am. Heart J. 1994, 127, 1539.
29. Sra, J., et al.: N. Engl. J. Med. 1993, 328, 1085.
30. Kelly, P.A., et al.: PACE 1994, 17,573.
31. Di Girolamo, E., et al.: J. Am. Coll. Cardiol. 1999, 33, 1227.
32. Grubb, B.P., et al.: PACE 1993, 16, 458.
33. Grubb, B.P., et al.: J. Am. Coll. Cardiol. 1994, 24, 490.
34. Lee, T.M., et al.: Am. J. Cardiol. 1996, 78, 480.
35. Yu, J.C., et al.: Cardiovasc. Drugs Ther. 1997, 10, 687.
36. Corbala, F., et al.: Arch. Inst. Cardiol. Mex. 1997, 67, 227.
37. Strieper, M.J., et al.: J. Am. Coll. Cardiol. 1993, 22, 594.
38. Raviele, A., et al.: Drug treatment of vasovagal syncope. In Blanc, J.J., et al. (Hrsg.): Neurally mediated syncope. Pathophysiology, investigations and treatment. Futura Publishing, Armonk (NY), 1996.
39. Moya, A., et al.: J. Am. Coll. Cardiol. 1995, 25, 65.
40. Raviele, A., et al.. Circulation 1999, 99, 1452.
41. Natale, A., et al.: J. Am. Coll. Cardiol. 1999, 269A, 1134.
42. Ward, C.R., et al.: Heart 1998, 79, 45.
43. Sra, J., et al.: J. Cardiovasc. Electrophysiol. 1997, 8, 42.
44. Benditt, D., et al.: Circulation 1998, Suppl. I, 706A.
45. Nelson, S.D., et al.: Arch. Intern. Med .1991, 151, 2425.
46. Zeng, C., et al.: Am. Heart J. 1998, 136, 852.
47. Connolly, S.J., et al.: J. Am. Coll. Cardiol. 1999, 33, 16.
48. Koenig, D., et al.: J. Intern. Med. 1992, 232, 169.