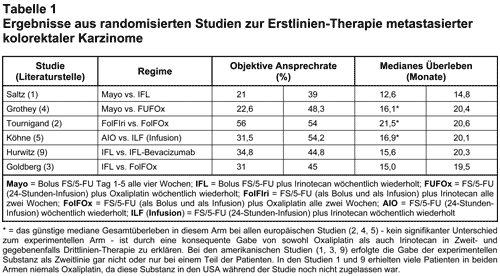
Dickdarmkrebs ist in den westlichen Industrienationen die häufigste Tumorerkrankung, bei der etwa die Hälfte der betroffenen Patienten im Verlauf eine Metastasierung erleidet und schließlich daran stirbt. Während über Jahrzehnte 5-Fluorouracil (5-FU) das einzige wirksame Zytostatikum bei der Erkrankung war, sind in den letzten Jahren mehrere neue systemische Behandlungsmöglichkeiten hinzugekommen. Oxaliplatin (Eloxatin®) und Irinotecan (Campto®) wurden als nicht kreuzresistente Zytostatika zunächst in der Zweitlinien-Therapie metastasierter kolorektaler Karzinome als zusätzliche Option eingesetzt und sind inzwischen als Kombinationspartner, insbesondere von 5-FU, auch in der Erstlinien-Therapie weit verbreitet (1-5, s.a. 11, 12). Auf Cetuximab, einen monoklonalen Antikörper (moAk) gegen den „Epidermal Growth Factor Receptor” (EGFR), sind wir kürzlich ausführlich eingegangen (13). Bevacizumab (Avastin®) ist ein humanisierter moAk gegen den „Vascular Endothelial Growth Factor” (VEGF), der die Tumorangiogenese beeinflußt. Alle malignen Tumoren, bzw. deren Metastasen, benötigen ab einer Größe von 1-2 mm ein eigenes Tumorgefäßbett, dessen Aufbau unter Vermittlung von VEGF erfolgt. Neben der direkten antiangiogenetischen Wirkung kann Bevacizumab vermutlich durch Veränderungen am Tumorgefäßbett auch die intratumorale Verteilung von Zytostatika beeinflussen. Im Rahmen klinischer Studien wurde Bevacizumab sowohl als Monotherapie als auch in Kombination mit Chemotherapien untersucht, wobei die klinischen Studien zum Stellenwert dieses moAk in Kombination mit Chemotherapie beim metastasierten kolorektalen Karzinom am weitesten fortgeschritten sind (6). Bereits früher wurde Bevacizumab in einer randomisierten Phase-II-Studie als Erstlinien-Therapie in zwei unterschiedlichen Dosierungen in Kombination mit einer Folinsäure-modulierten 5-FU-Therapie (FS/FU) gegenüber der alleinigen Chemotherapie verglichen (7). Bei Patienten, die die niedrigere Dosis des Antikörpers (5 mg/kg Körpergewicht i.v. alle zwei Wochen) erhielten, fanden sich gegenüber der reinen Chemotherapie eine verbesserte Ansprechrate (40% vs. 17%), verlängerte Zeit bis zum Progreß der Erkrankung (9,0 vs. 5,2 Monate) und eine Verlängerung des medianen Überlebens (21,5 vs. 13,8 Monate). Daraufhin wurde von Genentech (Hersteller von Bevacizumab in den USA) eine Phase-III-Studie initiiert, die plazebokontrolliert die Wirksamkeit der Hinzunahme des moAK zum IFL-Regime (Irinotecan, Bolus-5-FU und Folinsäure, wöchentlich wiederholt) überprüfte. Primärer Endpunkt der Studie war das Gesamtüberleben, sekundäre Endpunkte die Ansprechrate, das progreßfreie Überleben, die Dauer des Ansprechens und die Lebensqualität. IFL war inzwischen in den USA zugelassen worden und wird dort als ein Standard in der Erstlinien-Therapie eingesetzt (1). Da die Sicherheit der Kombination von Bevacizumab mit dem IFL-Schema noch nicht untersucht war, startete die Studie zunächst dreiarmig mit IFL plus Plazebo, FS/FU plus Bevacizumab (wie in der Phase-II-Studie) und mit einem Arm, in dem IFL und Bevacizumab (5 mg/kg KG alle zwei Wochen) kombiniert wurde. Nach rund 100 Patienten pro Arm erfolgte eine Zwischenanalyse hinsichtlich Unbedenklichkeit dieses experimentellen Arms, die ein akzeptables Sicherheitsprofil für IFL plus Bevacizumab ergab. Daraufhin wurde der Arm ohne Irinotecan gestoppt, so daß insgesamt 411 Patienten IFL plus Plazebo, 402 Patienten IFL plus Bevacizumab und 110 Patienten FS/FU plus Bevacizumab erhielten. Ein Cross-over vom Plazeboarm war in der Studie nicht erlaubt. Das Gesamtüberleben, das progreßfreie Überleben und die objektive Ansprechrate wurden durch die Kombination von Bevacizumab plus IFL signifikant verbessert (s. Tab. 1). IFL plus Plazebo wurde im Median über 6,3 und IFL plus Bevacizumab über 9,3 Monate appliziert. Schwere unerwünschte Arzneimittelwirkungen (UAW) traten bei Patienten, die den Antikörper erhielten, häufiger auf (84,9% vs. 74,0%; p = < 0,01). Insbesondere wurde eine arterielle Hypertonie (22,4% vs. 8,3%), die als Grad 3 UAW auch eine Behandlung erforderlich machte (11% vs. 2,3%), signifikant häufiger beobachtet. Bei sechs der 402 Patienten, die IFL plus Bevacizumab erhielten, kam es zu einer gastrointestinalen Perforation, die in einem Fall sogar tödlich verlief. Ob ein kausaler Zusammenhang mit der Antikörper-Therapie besteht, ist ungeklärt (9). Nicht signifikant häufiger als unter Plazebo wurden in der Phase-III-Studie Blutungen, Thrombosen und Proteinurie beobachtet, die in anderen Studien als Bevacizumab-assoziert gedeutet worden waren (7, 8). Inzwischen wurden aber in den USA, wo Bevacizumab für die Erstlinien-Therapie des kolorektalen Karzinoms bereits zugelassen ist, Warnbriefe verschickt, da es unter dieser Therapie vermehrt zu schweren arteriellen thromboembolischen Ereignissen (Myokardinfarkt, Angina pectoris, Schlaganfall, transiente ischämische Attacke) gekommen war (10). Bei Patienten, die ein arterielles thromboembolisches Ereignis unter laufender Therapie erleiden, muß Bevacizumab abgesetzt werden. Auf Grund der bisher verfügbaren Daten aus klinischen Studien geht der Hersteller von einer Verdoppelung des Risikos für arterielle Thromboembolien durch Bevacizumab aus (auf ca. 5%), wobei eine entsprechende Vorgeschichte, Alter über 65 Jahre und Bevacizumab als Risikofaktoren gelten. In den USA wurde die Packungsbeilage entsprechend geändert. Patienten, die in Deutschland im Rahmen von klinischen Studien Bevacizumab erhalten, müssen über dieses Risiko gesondert aufgeklärt werden. Die Zulassung für Bevacizumab wurde in den USA für die Erstlinien-Therapie in Kombination mit 5-FU-basierter Chemotherapie ohne Festlegung auf ein bestimmtes Chemotherapieregime erteilt. Das mediane Überleben der Patientengruppe, die in der Zulassungsstudie IFL plus Bevacizumab erhielt, liegt mit 20,3 Monaten in einem Bereich, der mit Kombinations-Chemotherapien, die Infusions-5-FU verwenden, auch ohne VEGF-Antikörper erreicht wird (Tab. 1). Bisher liegen keine Ergebnisse aus Studien vor, die Bevacizumab zusammen mit den in Europa vorwiegend eingesetzten Chemotherapieschemata, z.B. Infusions-5-FU oder Capecitabin (Xeloda®) plus Oxaliplatin oder Irinotecan, untersuchten. Der Einsatz des moAk als Zweit- oder Drittlinien-Therapie alleine oder aber kombiniert mit Chemotherapie ist bisher nicht untersucht worden. In den USA fallen durch Bevacizumab aktuell etwa 4400 $ zusätzlich an Kosten pro Monat an, so daß eine begleitende Therapie während der gesamten palliativen Behandlungssequenz (medianes Überleben > 20 Monate) erhebliche finanzielle Ressourcen beanspruchen würde. Mit einer Zulassung von Bevacizumab in Europa durch die EMEA wird Anfang nächsten Jahres gerechnet.
Fazit: Bevacizumab ist ein humanisierter moAk gegen VEGF, der vermutlich durch Beeinflussung der Angiogenese in einer Phase-III-Studie in Kombination mit Chemotherapie zu einer Verbesserung der Therapieergebnisse bei Patienten mit metastasiertem kolorektalen Karzinom geführt hat. Die in dieser Studie für IFL plus Bevacizumab mitgeteilte Wirksamkeit in Bezug auf Ansprechrate und medianes Überleben der Patienten entspricht den Ergebnissen der in Europa verbreiteten palliativen Erstlinien-Therapieschemata ohne Bevacizumab. In der Monotherapie hat der moAk keine antitumoröse Wirksamkeit. Die z.T. schweren UAW (arterielle Hypertonie, thromboembolische Ereignisse) von Bevacizumab müssen nach Zulassung durch die EMEA bei der Behandlung größerer Patientenkollektive unbedingt sorgfältig analysiert und dokumentiert werden. Der in der Laienpresse vielfach gefeierte Durchbruch in der Krebstherapie ist für uns nicht zu erkennen.
Literatur
- Saltz, L.B., et al.: N. Engl. J. Med. 2000, 343, 905.
- Tournigand, C., et al.: J. Clin. Oncol. 2004, 22, 229.
- Goldberg, R.M., et al.: J. Clin. Oncol. 2004, 22, 23.
- Grothey, A., et al.: Proc. ASCO 2002, 21, Abstr. 512.
- Köhne, C.H., et al.: Proc. ASCO 2003, 22, Abstr. 1018.
- Ferrara, N., et al.: Nat. Rev. Drug Discov. 2004, 3, 391.
- Kabbinavar, F., et al.: J. Clin. Oncol. 2003, 21, 60.
- Johnson, D.H., et al.: J. Clin. Oncol. 2004, 22, 2184.
- Hurwitz, H., et al.: N. Engl. J. Med. 2004, 350, 2335.
- www.fda.gov/medwatch/SAFETY/2004/avastin_deardoc_mod.pdf
- AMB 2002, 36, 3.
- AMB 2003, 37, 70a.
- AMB 2004, 38, 70.