Die verschiedenen Methoden der Preisfestlegung von Arzneimitteln innerhalb der Europäischen Union waren Inhalt des Teils 1 dieser Übersicht (1). Nun wird anhand von konkreten Beispielen die Zusammensetzung des Endpreises eines Arzneimittels (= Publikumspreis) dargestellt. Die teilweise sehr unterschiedlichen Gewinnspannen von Einzel- und Großhandel, gewährte Rabatte sowie die uneinheitliche Besteuerung von Arzneimitteln in den EU-Mitgliedsländern können zu enormen Unterschieden beim Publikumspreis führen. Ein fairer Preisvergleich von Arzneimitteln ist durch diese unterschiedlichen nationalen Rahmenbedingungen sehr schwierig und eigentlich nur auf der Ebene der Hersteller, z.B. beim Fabrikabgabepreis, möglich.
In Abb. 1 wird schematisch dargestellt, welche Auswirkungen die unterschiedlichen in Europa angewendeten Modelle der Distributionsvergütung auf den Preis eines Arzneimittels haben. Die angeführten, vereinfachten Beispiele illustrieren, wie die Abgeltung der Apotheken und Großhändler über Aufschläge den Endpreis eines Arzneimittels beeinflussen. Die letzte Position – die Mehrwert-/Umsatzsteuer – ist der Anteil des Staats am Preis eines Arzneimittels. Nur in Zypern, Malta, Schweden und Großbritannien verzichtet der Staat auf die Umsatzsteuer, vor allem für erstattete Arzneimittel.
In der Europäischen Union gibt es 27 verschiedene Abgeltungssysteme. Daher ist für einen wissenschaftlich fundierten Preisvergleich, insbesondere wenn dieser nicht nur auf der Herstellerebene erfolgt, sondern auch andere Preisstufen (Apotheken-Einkaufspreis, Publikumspreis) umfasst, die Kenntnis dieser Rahmenbedingungen erforderlich. Die unterschiedlichen Preisbildungsmodelle werden dennoch in der öffentlichen Diskussion von Arzneimittelpreisen gerne vernachlässigt. Darüber hinaus bilden publizierte bzw. für Gesundheitsberufe zugängliche Preisquellen, z.B. die Rote Liste (2) in Deutschland, nur die offiziellen Apotheken-Verkaufspreise ab, während Rabatte, wie sie z.B. den Krankenkassen von den pharmazeutischen Unternehmen gewährt werden, nicht berücksichtigt sind.
Beim österreichischen EU-Durchschnittspreissystem gemäß § 351c Abs. 6 des Allgemeinen Sozialversicherungsgesetzes (3) werden daher der Fabrik- bzw. der Depot-Abgabepreis (FAP bzw. DAP) und auch der Apotheken-Einstandspreis (AEP; auch als Großhandelspreis bezeichnet) der Arzneispezialität berücksichtigt. Wie das nachfolgende Preisbeispiel (vgl. Abb. 2) für das Präparat Hepsera® 10 mg Tablette (Adefovir) zur Behandlung der Hepatitis B zeigt, bestehen in europäischen Ländern teils beträchtliche Preisunterschiede. Dies betrifft nicht nur die FAP/DAP-Ebene, sondern alle Preisstufen. Es ist erkennbar, dass in Schweden keine Umsatzsteuer für das Produkt anfällt, während dieser Anteil des Fiskus in Österreich nur von Dänemark übertroffen wird. Das Produkt ist in allen sechs dargestellten Ländern „kassenfähig”, wird aber beispielsweise in Dänemark überwiegend in Krankenhäusern verordnet.
In Österreich ist diese Arzneispezialität in der „Gelben Box (RE 2)” des Erstattungskodex enthalten und wird beim Vorliegen bestimmter Indikationen bzw. Rahmenbedingungen (ähnlich wie in Belgien) erstattet. Der österreichische Abgabepreis wirkt auf den ersten Blick als der höchste aller untersuchten Länder, wobei dies allerdings nur auf den Privatverkaufspreis zutrifft (Abb. 2, Balken A1). Bei einer Abgabe zu Lasten eines der österreichischen Sozialversicherungsträger ist der Aufschlag deutlich niedriger und beträgt anstelle von 5,41 EUR pro Tablette nur 0,72 EUR (Abb. 2, Balken A2).
Diese Tatsache verdeutlicht, dass die Kenntnis der den Arzneimittelpreisen zugrunde liegenden Preisbildungsverfahren und gesetzlichen Rahmenbedingungen in Bezug auf z.B. die Erstattung große Bedeutung hat. So werden in Frankreich, Dänemark und Schweden die Kosten des Arzneimittels nicht notwendigerweise zu 100 Prozent von der Sozialversicherung getragen.
Am Beispiel des monoklonalen Antikörpers Trastuzumab (Herceptin® 150 mg) zur Behandlung spezieller Formen von Brustkrebs wird sichtbar, dass die Preise von patentgeschützten Arzneispezialitäten, für die es keine oder nur wenige Behandlungsalternativen gibt, vom pharmazeutischen Hersteller konstant hoch gehalten werden (s. Abb. 3).
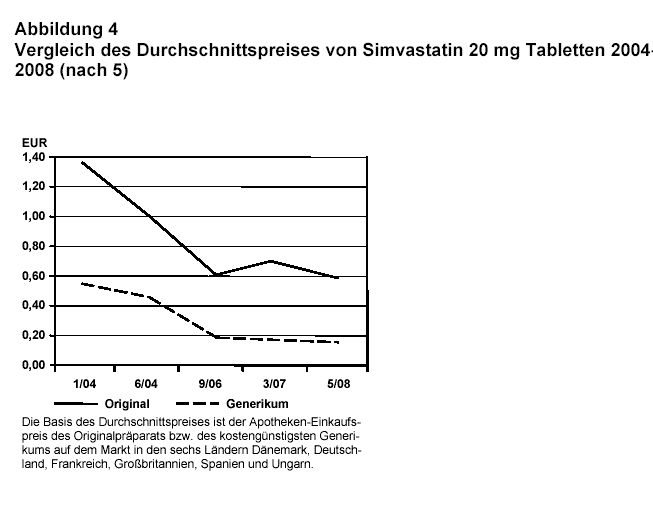
Abb. 4 zeigt andererseits die Preisentwicklung von Simvastatin, bei dem der Patentschutz des Originalpräparats (Zocor® bzw. Zocord®) bereits abgelaufen ist. Es ist offensichtlich, dass beim Markteintritt von Generika auch der Preis des Originalprodukts um mehr als die Hälfte sinkt. Dies geschieht auch in Frankreich und Dänemark, wo ein Nachfolgeprodukt bei der Aufnahme in den Erstattungsmarkt nicht automatisch im Preis gesenkt werden muss, wie das z.B. in Österreich der Fall ist (vgl. 1).
Bei der Interpretation der Preise ist auch unbedingt zu beachten, dass sowohl die nationalen Vorschriften für den Betrieb und die Infrastruktur von Apotheken (Fläche, Ausbildungsstand des Personals etc.) als auch die abgegebenen Arzneimittelpackungen in den einzelnen Ländern sehr unterschiedlich sind. Daher können die Packungspreise durchaus variieren. In Frankreich werden z.B. weitaus mehr und kleinere Arzneimittelpackungen verbraucht als in den anderen Ländern. In Dänemark und Schweden ist hingegen aufgrund des dort bestehenden verbrauchsabhängigen Erstattungssystems (je mehr Arzneimittel der Patient erhält bzw. konsumiert, desto geringer ist die prozentuelle Eigenbeteiligung) die durchschnittliche Packung viel größer als in Mittel- und Südeuropa. Auch in Deutschland sind Großpackungen viel üblicher als in Österreich, wo auf dem Kassenmarkt in erster Linie die kleinste mögliche, therapeutisch sinnvolle Packung abgegeben werden soll.
Literatur
- AMB 2008, 42, 25. Link zur Quelle
- http://www.rote-liste.de Link zur Quelle (mit DocCheck-Passwort zugänglich)
- Aktualisiert am 1. Januar 2008: www.bmgfj.gv.at/cms/site/standard.html?channel=CH0723&doc=CMS1078931881119 Link zur Quelle
- AMB 2008, 42, 20b. Link zur Quelle
- http://www.oebig.at Link zur Quelle
- In Studien zum Arzneimittelverbrauch ist es internationaler Standard, diesen nicht in verordneten Packungen, sondern in DDD zu messen. Auch Preise werden – je nach Verwendungszusammenhang – anhand von Kosten oder Umsatz je DDD verglichen. In Deutschland sind Kostenvergleiche auf Basis der DDD explizit zur Information der Vertragsärzte und zur Förderung einer wirtschaftlichen Verordnungsweise im Sozialgesetzbuch aufgenommen.