Viele Menschen mit erhöhten Lipidwerten suchen nach Alternativen für Statine zur Cholesterinsenkung. Sie haben Nebenwirkungen (selten), Angst vor Nebenwirkungen (häufig) oder wollen keine Arzneimittel einnehmen (häufig). Viele Supplemente wie Rotschimmelreis, Fischölkapseln oder Kurkuma werden hierfür angeboten, wobei meist unklar ist, ob und wie diese Mittel mit dem Lipidstoffwechsel interagieren und ob die Einnahme irgendjemandem nutzt, außer den Herstellern und Händlern.
In der Cleveland-Klinik (Ohio, USA) wurde zu diesem Thema eine kleine, aber zu dieser Frage interessante prospektive randomisierte und plazebokontrollierte Studie mit dem Akronym SPORT durchgeführt [1]. Sie wurde von den Studienautoren initiiert und von AstraZeneca unterstützt.
Ziel war es, die Wirkungen auf den Lipidstoffwechsel von 5 verschiedenen Supplementen, die in den USA zur Cholesterinsenkung angeboten werden, im Vergleich zu Plazebo und einer niedrigen Dosis Rosuvastatin zu ermitteln. Hierzu wurden insgesamt 203 Personen zwischen 40-75 Jahren (mittleres Alter 64,4 Jahre, 59% Frauen) ohne kardiovaskuläre Vorerkrankungen und einem berechneten kardiovaskulären Risiko > 5% über 10 Jahre (im Mittel 7,9%) eingeschlossen. Das LDL-Cholesterin sollte zwischen 70-189 mg/dl liegen (Mittelwert bei Studienbeginn 128 mg/dl), und die Probanden durften nicht mit Statinen oder anderen rezeptpflichtigen Lipidsenkern vorbehandelt sein. Wer bereits eines der untersuchten Nahrungsergänzungsmittel einnahm, musste dieses 4 Wochen vor Studienbeginn absetzen.
Studiendesign: Die Probanden wurden in 8 Behandlungsarme mit je 25 Personen gelost: niedrig dosiertes Rosuvastatin (5 mg/d); Plazebo; 2.400 mg natürliches Fischöl; 2.400 mg eines Zimtpräparats; Knoblauchkapseln mit 5.000 µg Allicin; Kurkuma mit 4.500 mg Piperin; 1.600 mg natürliche Pflanzensterine; 2.400 mg Rotschimmelreis (enthält Monacolin K). Die verwendeten Dosierungen orientierten sich an den Herstellerangaben. Die Studienmedikation wurde in unbeschrifteten Behältern an die Probanden verteilt. Eine Verblindung der Probanden war jedoch wegen der unterschiedlichen Darreichungsformen und -mengen nicht möglich. Nur die Untersucher waren gegenüber der Zuteilung verblindet. Alle Probanden erhielten eine basale Analyse der Blutwerte und eine zweite nach 28 Tagen. Der primäre Studienendpunkt war die prozentuale Veränderung des LDL-Cholesterinspiegels (LDL-C). Zu den sekundären Endpunkten zählten die Veränderungen des hochsensitiven C-reaktiven Proteins (hsCRP), des High-Density-Lipoprotein-Cholesterins (HDL-C) und der Triglyzeride.
Ergebnisse: 1.009 Personen wurden gescreent, 203 erfüllten die Einschluss- bzw. hatten keine Ausschlusskriterien, 199 wurden randomisiert, und 190 beendeten die Nachbeobachtung. Die vorgegebene Behandlung wurde gut eingehalten (Adhärenz); nur 4 Teilnehmer gaben ≥ 30% ihrer zugewiesenen Studienmedikation wieder zurück.
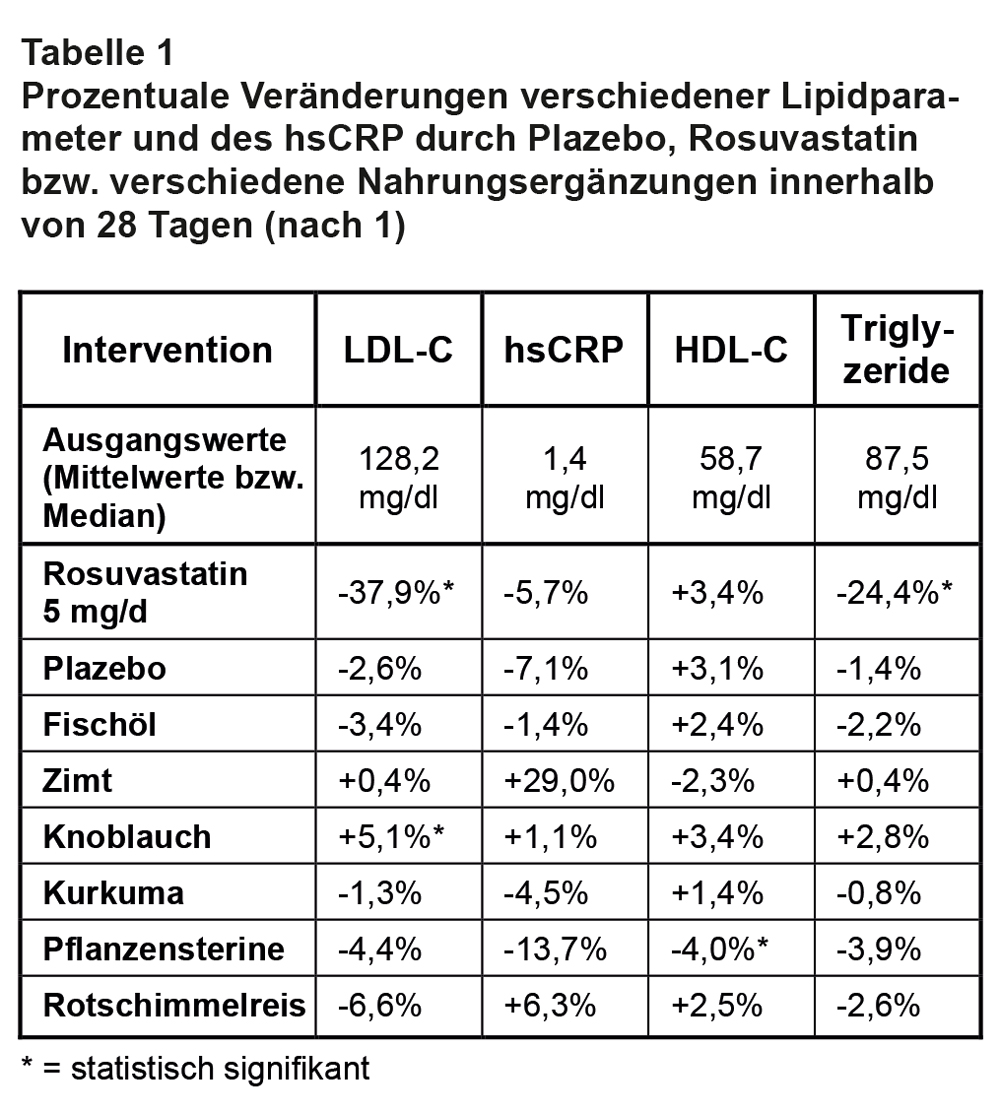
Die Effekte der 8 Therapien über einen Monat sind in Tab. 1 im Verhältnis zu den Ausgangswerten dargestellt. Es zeigte sich, dass die LDL-senkende Wirkung der geprüften Nahrungsergänzungsmittel in den von den Herstellern empfohlenen Dosierungen auf dem Niveau von Plazebo liegen. Die relativ stärkste LDL-senkende Wirkung hatten Rosuvastatin (-37,9%) und Rotschimmelreis (-6,6%), jedoch war der Unterschied zu Plazebo nur für Rosuvastatin signifikant. Das Knoblauchpräparat führte sogar zu einem signifikanten Anstieg des LDL-C. Bei keinem der Präparate konnten signifikante Unterschiede beim Einfluss auf das hsCRP gemessen werden.
Die Verträglichkeit aller Präparate war gleich gut, wobei die Nebenwirkungsrate in den Gruppen zwischen 12 und 28% lag. Es wurden keine signifikanten Veränderungen bei den Leber- und Nierenfunktionswerten oder dem Blutzucker beobachtet.
Diskussion: Die Autoren nennen als Einschränkungen ihrer Untersuchungsbefunde die kleinen Fallzahlen und die kurze Nachbeobachtungszeit. Die Ergebnisse stünden jedoch im Einklang mit mehreren Übersichtsarbeiten und Metaanalysen zu den einzelnen Präparaten ([2], [3], [4], [5], [6]). Viel wichtiger sei jedoch, dass trotz der teilweise geringen lipidsenkenden Wirkungen bislang keine positiven Auswirkungen dieser Supplemente auf die kardiovaskuläre Morbidität und Mortalität nachgewiesen werden konnten [7]. Die Autoren fordern daher dazu auf, die Patienten offensiv über den fehlenden Nachweis eines Nutzens dieser Präparate aufzuklären.
Die Leitlinien zur kardiovaskulären Prävention der europäischen Fachgesellschaften (ESC/EAS) von 2021 gehen explizit auf Fischöl, Rotschimmelreis und Pflanzensterine ein [8]. Von Rotschimmelreis wird wegen einer unklaren Nutzen-Risiko-Relation abgeraten. Den Pflanzensterinen wird bei einer Tagesdosis von 2 g zusätzlich zu einer fettarmen Ernährung eine LDL-C-Senkung um 10% eingeräumt, allerdings ohne nachgewiesene Wirkung auf klinische Endpunkte. Die Effekte von Fischöl-Präparaten werden offen diskutiert, wobei die angenommenen positiven Wirkungen auf kardiovaskuläre Endpunkte auf die Ergebnisse der REDUCE-IT-Studie zurückgehen, die jedoch wegen ihres Designs stark zu kritisieren ist (vgl. [9]). Die „U.S. Preventive Services Task Force“ hat in ihren gerade veröffentlichten Empfehlungen zur Primärprävention wegen fehlender Beweise für die Wirksamkeit jedweder Supplemente von ihrer Verwendung abgeraten ([10], vgl. [11]).