Zusammenfassung: In der FOURIER-Studie reduzierte der monoklonale Antikörper Evolocumab, ein Hemmer der Proproteinkonvertase Subtilisin/Kexin Typ 9 (PCSK9), während einer im Median 26-monatigen Behandlung kardiovaskulärer Hochrisikopatienten in der Sekundärprophylaxe den kombinierten Endpunkt (Herzinfarkt, Schlaganfall, Koronarinterventionen) absolut um 1,5%, relativ um 15% (in der europäischen Studienpopulation nur um 9%). Die Letalität wurde nicht beeinflusst. Die vorausgesagte Halbierung des kardiovaskulären Risikos durch extreme Senkung des LDL-Cholesterins tritt also zumindest innerhalb der ersten zwei Jahre nicht ein. Wegen unzureichender Sicherheitsdaten kann das Verhältnis von Nutzen zu Risiken in der Langzeitbehandlung noch nicht bewertet werden. Daher sind die PCSK9-Hemmer nach unserer Einschätzung zwar eine interessante neue Therapieform, aber verglichen mit ihrem Nutzen ungerechtfertigt teuer. Eine Indikation sehen wir zurzeit nur bei extrem hohem Risiko, z.B. bei homozygoter familiärer Hypercholesterinämie.
Zeitgleich mit der Präsentation auf dem diesjährigen Kongress des American College of Cardiology in Washington wurden im N. Engl. J. Med. die Ergebnisse der FOURIER-Studie veröffentlicht (1). Diese Studie liefert erstmals die lang geforderten klinischen Ergebnisse einer Behandlung mit einem PCSK9-Hemmer (Evolocumab, Repatha®, Amgen). Wir haben 2015 über die Erstzulassung dieser neuartigen Cholesterinsenker berichtet und wegen einer unklaren Nutzen-Risiko-Relation sowie fraglicher Kosteneffizienz (Jahrestherapiekosten ca. 8.000 €) zur Zurückhaltung bei der Verordnung geraten (2). Ungeachtet dessen läuft das Marketing für diese Wirkstoffe seit über zwei Jahren auf vollen Touren. Hersteller und Key Opinion Leaders sagen sogar eine „Halbierung des Herz-Kreislauf-Risikos“ voraus und orakeln vom Ende der Statine (3).
Dieser Optimismus erhält nun durch die Daten aus FOURIER einen deutlichen Dämpfer. Die von Amgen initiierte und finanzierte Großstudie hat an 1.242 Zentren in 49 Ländern insgesamt 27.564 Patienten eingeschlossen. Die Patienten (75% Männer) waren im Mittel 62,5 Jahre alt. Alle hatten eine manifeste atherosklerotische kardiovaskuläre Erkrankung (81% Myokardinkarkt, 19% ischämischer Schlaganfall, 13% symptomatische pAVK) sowie mindestens einen Major-Risikofaktor (Diabetes, Rauchen u.a.) oder mindestens zwei Minor-Risikofaktoren (Koronarintervention, erhöhtes CRP, metabolisches Syndrom u.a.). Es handelt sich also um Hochrisikopatienten in der Sekundärprophylaxe.
Um in die Studie eingeschlossen zu werden, musste das LDL-Cholesterin dieser Patienten trotz „optimierter lipidsenkender Therapie“ ≥ 70 mg/dl und/oder das Nicht-HDL-Cholesterin ≥ 100 mg/dl betragen. Vor Studienbeginn erhielten daher 69% der Patienten eine hochdosierte Behandlung mit einem Statin (definiert als ≥ 40 mg/d Atorvastatin oder ein Äquivalent, z.B. ≥ 20 mg/d Rosuvastatin oder ≥ 80 mg/d Simvastatin mit oder ohne Ezetimib). Eine moderate Dosis eines Statins hatten 30%, und 5,3% nahmen Ezetimib. Das mittlere LDL-Cholesterin betrug zu Studienbeginn 92 mg/dl (SD: 80-109 mg/dl).
Insgesamt gab es in der FOURIER-Studie 25 Ausschlusskriterien (u.a. fortgeschrittene Herz-, Nieren- oder Leberinsuffizienz, schlecht kontrollierte Hypertonie, Funktionsstörungen der Schilddrüse u.a.). Leider wird, entgegen den CONSORT-Richtlinien (vgl. 4), nicht angegeben, wie das Verhältnis zwischen gescreenten und randomisierten Patienten war. Das ist wichtig, um einen möglichen Selektionsbias zu erkennen.
Methodik: Intervention: Die Patienten erhielten zusätzlich zu ihrer Standard-Behandlung, also auch zu ihren gewohnten Lipidsenkern entweder Evolocumab oder Plazebo. Sie konnten wählen, ob sie die Prüfsubstanzen einmal monatlich (420 mg) oder einmal alle 2 Wochen(140 mg) subkutan erhielten. Die Behandlung erfolgte formal doppelblind. Es ist jedoch unklar, wie die Verblindung aufrechterhalten wurde, denn die Anwendung des Verums ist an einer deutlichen Senkung des LDL-Cholesterins zu erkennen.
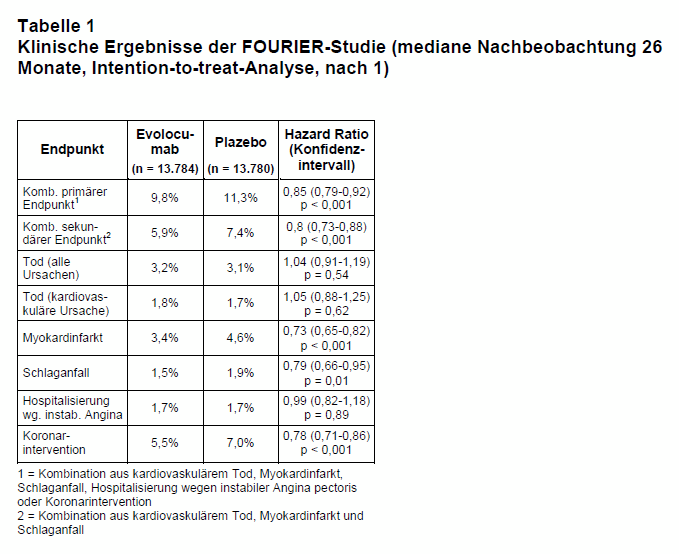
Studienendpunkt: Als primärer Endpunkt wurde eine Fünffach-Kombination aus kardiovaskulärem Tod, Myokardinfarkt, Schlaganfall, Krankenhausbehandlung wegen instabiler Angina pectoris oder Koronarintervention gewählt und als Sicherheitsendpunkte unerwünschte klinische und laborchemische Ereignisse mit besonderem Augenmerk auf einen neu aufgetretenen Diabetes mellitus. Wegen des Verdachts, dass PCSK9-Hemmer bzw. eine zu starke Senkung des LDL-Cholesterins zu bedeutsamen neurokognitiven Beeinträchtigungen führen, wurde bei einer Subgruppe die Hirnleistung evaluiert. Diese Untersuchung erfolgte aus uns nicht bekannten Gründen nicht im Rahmen der FOURIER-Studie, sondern als eigene Studie mit dem Akronym EBBINGHAUS (5).
Ergebnisse: Die Studie sollte laut Protokoll nach Erreichen von 1.630 sekundären Endpunkten (kardiovaskulärer Tod, Myokardinfarkt, Schlaganfall) schließen. Die mediane Nachbeobachtungszeit betrug somit 26 Monate. In der Publikation werden – was etwas irritiert – auch immer wieder die Drei-Jahres-Daten von insgesamt 1.375 Patienten angegeben, bei denen diese Nachbeobachtungsdauer erreicht wurde. 12,5% der randomisierten Patienten beendeten die Studie vorzeitig, meist wegen unerwünschter Wirkungen bzw. auf eigenen Wunsch, ohne Unterschied in den beiden Gruppen.
Bei 9,8% der Patienten wurde während der Studie die lipidsenkende Basistherapie verändert, meist wurde die Dosis des Statins reduziert. Während das LDL-Cholesterin in der Plazebo-Gruppe um etwa 90 mg/dl konstant blieb, fiel es in der Evolocumab-Gruppe unmittelbar nach Therapiebeginn und anhaltend auf ca. 30 mg/dl ab. Die LDL-Senkung betrug im Vergleich zu Plazebo 59% (95%-Konfidenzintervall = CI: 58-60; p < 0,001). In der Evolocumab-Gruppe kam es im Vergleich zu den Ausgangswerten auch zu einer Senkung des Nicht-HDL-Cholesterins um 52%, von Apolipoprotein B um 49% und von LP(a) um 26,9%. Im Plazebo-Arm gab es keine Änderungen dieser Parameter.
Die klinischen Ergebnisse (Intention-to-treat-Analysen; s. Tab. 1) zeigen eine statistisch signifikante Reduktion beim kombinierten primären Endpunkt (Relative Risikoreduktion = RRR: -15%). Die Number needed to treat (NNT) beträgt 66. Der Nutzen von Evolocumab ergibt sich dabei durch eine Reduktion von Myokardinfarkten (-1,2%), Schlaganfällen (-0,4%) und Koronarinterventionen (-1,5%). Ein Effekt auf die Letalität ist nicht nachweisbar. Nach den Kaplan-Meier-Kurven nimmt der Unterschied zwischen den beiden Gruppen im Studienverlauf leicht, aber stetig zu, was die Autoren zu der möglichen, aber noch zu beweisenden Annahme veranlasst hat, dass in der Zukunft auch eine signifikante Senkung der Letalität eintreten wird. Nach drei Jahren betrug der absolute Unterschied zwischen den beiden Gruppen 2% (12,6% vs. 14,6%; n = 1.375).
Der Effekt von Evolocumab war in nahezu allen Subgruppen nachweisbar: Alter < oder ≥ 65 Jahre, Geschlecht, Art der atherosklerotischen Erkrankung, begleitende Statin-Dosis, Applikationsintervall von Evolocumab. Die Risikoreduktion war tendenziell bei einem niedrigen Ausgangs-LDL (< 80 mg/dl) etwas größer als bei einem höheren (> 109 mg/dl): Hazard ratio (HR) 0,80 vs. 0,89. Bemerkenswert ist allerdings, dass der Nutzen von Evolocumab in der europäischen Studienpopulation (n = 17.335) am geringsten und nur grenzwertig signifikant war (HR: 0,91; CI: 0,83-1,00; p-Wert nicht angegeben). Den mit Abstand größten Nutzen hatten die nordamerikanischen Patienten (Absolute Risikoreduktion = ARR: 5,1%; HR: 0,77; CI: 0,66-0,90). Außerdem fällt auf, dass in der kleinen Subgruppe der Patienten, die Ezetimib einnahmen (n = 1.440), kein Nutzen von Evolocumab nachweisbar war (HR: 0,98; CI: 0,74-1,31). Diese interessanten Daten werden weder von den Autoren noch vom Kommentator der Publikation (7) thematisiert.
Hinsichtlich der Verträglichkeit wurden während der Nachbeobachtungszeit keine bedeutsamen Unterschiede zwischen den beiden Gruppen gefunden. In beiden Armen wurden bei 77,4% unerwünschte Ereignisse (UAE) gemeldet und davon 24,7% als schwerwiegend klassifiziert. Signifikante Unterschiede zwischen Verum und Plazebo waren nur bei den Reaktionen an der Injektionsstelle (2,1% vs. 1,6%) nachweisbar. Allergien traten etwa gleich häufig auf (bei 3,1% vs. 2,9%); 43 Patienten (0,3%) entwickelten Antikörper gegen Evolocumab.
Ein neuer Diabetes (16.676 Nicht-Diabetiker zu Studienbeginn) wurde bei 8,1% bzw. 7,7% diagnostiziert (HR: 1,05; CI: 0,94-1,17). Muskuläre UAE wurden bei 5,0% bzw. 4,8% gemeldet, eine Rhabdomyolyse bei 0,1% (in beiden Studienarmen). Die Häufigkeit der gemeldeten neurokognitiven UAE betrug 1,6% bzw. 1,5%. Wie bereits erwähnt, erfolgte ein spezielles Screening auf neurokognitive Veränderungen im Rahmen der EBBINGHAUS-Studie. Die Ergebnisse wurden ebenfalls auf dem Kongress des American College of Cardiology von R. Giugliano vorgestellt und liegen bislang nur als Pressemeldung vor (6). Demnach wurden 1.974 Patienten aus der FOURIER-Population mit neuropsychologischen Tests zu Studienbeginn und erneut nach 24, 48 und 96 Wochen sowie am Studienende auf ihre Hirnleistung getestet. Es gab keinen Unterschied zwischen Plazebo und Evolocumab (Abnahme beim „Spatial Working Memory Index“: -0,29 vs. -0,21 Punkte; p für Nichtunterlegenheit < 0,0001). Auch bei weiteren Tests der Hirnleistung seien keine Nachteile von Evolocumab erkennbar gewesen und auch nicht bei Patienten mit sehr starker Senkung des LDL-Cholesterins (< 25 mg/dl).
Die optimistische Beurteilung der Studie in einem begleitenden Editorial (7) ist nicht sehr überzeugend. Der Kommentator lobt die Studie als „landmark trial”, die nun formal die Evidenz liefert, dass PCSK9-Hemmer einen bedeutsamen Zusatznutzen bei kardiovaskulären Hochrisikopatienten haben. Dies werde sich auch bald in den Behandlungsleitlinien abbilden und die Ärzte angewiesen werden („directing“), diese neue und teure Wirkstoffklasse anzuwenden. Das Sicherheitsprofil von PCSK9-Hemmern sei gut, wobei noch die Ergebnisse von separaten Substudien abzuwarten seien. Weniger optimistisch reagierte die Börse: Als die Ergebnisse der FOURIER-Studie bekannt wurden, gab der Kurs von AMGEN erst einmal um knapp 10% nach.
Insgesamt wirkt die Publikation übereilt und wirft viele neue Fragen auf. Es besteht die Möglichkeit für Selektionsbias und Verzerrungen durch Entblindung. Die unterschiedlichen Ergebnisse in der europäischen und nordamerikanischen Population könnten durch einen unbeachteten Störfaktor verursacht sein. Außerdem bleiben die Risiken einer Dauerbehandlung mit Evolocumab weiterhin unklar, sodass eine abschließende Beurteilung von Nutzen und Risiko weiterhin nicht möglich ist. Der Nutzen scheint jedoch deutlich geringer zu sein als von Vielen erhofft und vorausgesagt. Die Ergebnisse sollten aus unserer Sicht Einfluss auf die ökonomische Bewertung der PCSK9-Hemmer haben: Bei 8.000 € Jahrestherapiekosten kostet ein verhinderter Schlaganfall oder Herzinfarkt (NNT 66/2,2 Jahre) ca. 1,2 Mio. €. Das ist deutlich zu viel, oder anders ausgedrückt: Der monoklonale Antikörper ist seinen hohen Preis nicht wert.
Literatur
- Sabatine,M.S., et al. (FOURIER = Further cardiovascular OUtcomes Research withPCSK9 Inhibition in subjects with Elevated Risk): N. Engl. J. Med. 2017,March 17. DOI: 10.1056/NEJMoa1615664. Link zur Quelle
- AMB 2015, 49,74. Link zur Quelle
- Deutsches Ärzteblatt 16.3.2015: Link zur Quelle
- AMB 2001, 35,46. Link zur Quelle
- EBBINGHAUS = Evaluating PCSK9 binding antiBodyInfluence oN coGnitive HeAlth in high cardiovascUlarrisk Subjects: Link zur Quelle
- http://www.acc.org/… Link zur Quelle
- Dullaart, R.P.F.: N.Engl. J. Med. 2017, March 17. DOI: 10.1056/NEJMe1703138. Link zur Quelle