Zusammenfassung: Von den Impfstoffkandidaten gegen SARS-CoV-2, die sich bereits in der Phase III der klinischen Prüfung befinden, sind 60% den genetischen Vakzinen zuzurechnen (nukleinsäurebasierte und virale Vektorimpfstoffe). Bei zwei dieser Kandidaten (einem mRNA- und einem viralen Vektorimpfstoff) werden derzeit (Stand 20.10.2020) von der Europäischen Arzneimittel-Agentur (EMA) im Rahmen eines „rolling review“-Verfahrens bereits erste (nicht klinische) Daten geprüft. Unter dem Zeitdruck der Pandemie wurden die laufenden klinischen Phasen I und II zur Prüfung der Sicherheit durch Zusammenschieben und Zusammenlegen deutlich verkürzt („Teleskopierung“). Durch die Verkürzung üblicher Beobachtungszeiträume erhöht sich das Risiko, dass Nebenwirkungen während der klinischen Prüfung unerkannt bleiben. Somit tangieren die beschleunigten Testphasen auch die gesundheitspolitische Verantwortung bei der staatlichen Vorsorge. Ein weiteres Problem ergibt sich daraus, dass derzeit fast alle Impfstoffe an jüngeren Erwachsenen und nicht an älteren Menschen mit deutlich höherem Risiko für schwere Verläufe getestet werden. Auch wird ein sehr wichtiger Wirksamkeitsendpunkt der Impfstoffe, die „sterile Immunität“, in den laufenden Studien kaum berücksichtigt. Würde durch eine Impfung eine anhaltende sterile Immunität erreicht – die ideale Wirkung einer Impfung – könnten Infektionsketten unterbrochen werden. Die bisher publizierten Ergebnisse der laufenden Impfstudien lassen das aber kaum erwarten.
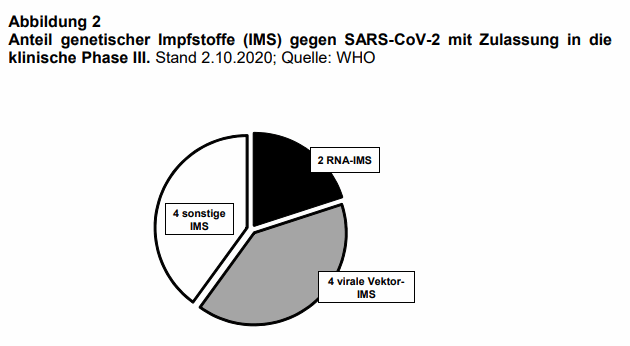
Hintergrund: Im Januar 2020 wurde das Genom des SARS-CoV-2 erstmals sequenziert (1). Seither steigt die Zahl der bei der Weltgesundheitsorganisation (WHO) gemeldeten Impfstoffe kontinuierlich an. Am 2.10.2020 umfasste die Meldeliste weltweit 192 Kandidaten (2), von denen sich am 19.10.2020 insgesamt 44 in klinischer Testung befanden. Davon waren 20 Impfstoffe den genetischen Impfstoffen zuzurechnen (s. Abb. 1 und 2). Sie lassen sich schneller herstellen und in großen Mengen produzieren, jedoch sind die klinischen Erfahrungen mit dieser Technologie noch sehr begrenzt. Genetische Impfstoffe lassen sich in zwei Kategorien einteilen: nukleinsäurebasierte Impfstoffe und virale Vektorimpfstoffe.
Nukleinsäurebasierte Impfstoffe: Sie beruhen auf der Transduktion von Nukleinsäuren (DNA oder RNA) in die Zellen des Wirtsorganismus. Durch Eingriffe in die Proteinbiosynthese der Zellen entsteht im geimpften Organismus ein virales Protein, das als Antigen und somit als Antikörpergenerator fungiert. RNA-Impfstoffe bringen hierfür in der Regel die in Lipid-Nanopartikel verpackte und dadurch vor dem enzymatischen Abbau geschützte mRNA (messenger RNA), die ein virales Antigen kodiert, in die Zielzellen ein. Die mRNA ist ein einsträngiges Transkript eines entsprechenden Abschnitts des viralen Genoms, hier von SARS-CoV-2. Sie wird in den Zielzellen außerhalb des Zellkerns an den Ribosomen abgelesen (Translation), sodass diese im Rahmen der Proteinbiosynthese das Erreger-Antigen herstellen. Da die Integrationsmechanismen der mRNA den Zellkern nicht tangieren, wird das Genom der Zielzelle nicht verändert.
Bei DNA-Impfstoffen wird die Information für die Synthese des Erreger-Antigens in Form genetisch veränderter Plasmide (ringförmige DNA-Moleküle) eingebracht. Im Rahmen der Integrationsmechanismen, die im Gegensatz zu den RNA-Impfstoffen auch den Zellkern einschließen, kommt es in der Zelle zur Transkription des Proteinbauplans in mRNA mit anschließender Translation an den Ribosomen und Herstellung des viralen Antigens im Rahmen der Proteinbiosynthese.
Virale Vektorimpfstoffe: Diese sind eine erweiterte Form der genetischen Impfstoffe. Sie beruhen auf der genetischen Manipulation eines Vektor-, also Trägervirus, das im Regelfall nicht das Erregervirus ist, gegen das eine Immunisierung stattfinden soll. Dem Vektorvirus wird die genetische Information in Form von DNA oder RNA eingesetzt, die ein bestimmtes virales Antigen kodiert. Für diese Art von Impfstoffen werden sowohl DNA- als auch RNA-Viren als Vektoren verwendet. Durch Infektion mit DNA-Vektorviren (hierfür werden zum Beispiel Adenoviren verwendet) wird das gewünschte virale Antigen in den geimpften Organismus gebracht und dort exprimiert. Beispiele für diese Technologie sind Impfstoffe gegen Dengue-Fieber und Ebola. Über diese Strategie haben wir bereits berichtet (3). Sowohl bei den nukleinsäurebasierten als auch bei viralen Vektorimpfstoffen wird häufig die Bildung des Spikeproteins von SARS-CoV-2 als Antigen angestrebt.
Die genetischen Impfstoffe gegen SARS-CoV-2 werden derzeit als besonders erfolgversprechend angesehen (4). Weltweit wurden – noch vor seiner Zulassung – bereits 2,4 Mrd. Dosen des viralen Vektorimpfstoffs AZD1222 eingekauft, davon etwa 400 Mio. Dosen von EU-Staaten, darunter auch Deutschland und Österreich (5). Dieser Impfstoff der Firma Vaccitech ist von AstraZeneca in Zusammenarbeit mit der Universität Oxford entwickelt worden (Oxford-Impfstoff). Er basiert auf einem modifizierten Schimpansen-Adenovirus (DNA-Virus) der Impfstoffplattform ChAdOx1 von Vaccitech. Darüber hinaus haben EU-Staaten auch etwa 100 Mio. Dosen des nukleinsäurebasierten mRNA-Impfstoffs BNT162b2 des Mainzer Unternehmens BioNTech in Kooperation mit Pfizer bestellt (5). BNT162b2 enthält Nukleosid-modifizierte und in Lipid-Nanopartikel verpackte mRNA, die für das gesamte Spike-Protein kodiert.
Beide Impfstoffe befinden sich seit Anfang Oktober in einem „rolling review“, also in einem laufenden Zulassungsprozess (6, 7). „Rolling“ bedeutet hier, dass die Begutachtung der Daten durch die EMA bereits während der klinischen Testphasen begonnen hat. Die beiden Hersteller streben die Zulassung ihrer Vakzine laut Pressemeldungen für Ende 2020 an (8, 9).
Im September 2020 wandten sich 140 nationale Akademien der Wissenschaften in einer gemeinsamen Pressemitteilung an die Öffentlichkeit. Sie kritisierten die millionenfachen Vorbestellungen der nicht zugelassenen Impfstoffe durch verschiedene Staaten als „Impfstoffnationalismus“. Der Zugang zu Impfstoffen durch Länder und Einzelpersonen habe sich nicht nach der Zahlungsfähigkeit, sondern nach dem Bedarf zu richten. Außerdem wurde vor beschleunigten Verfahren bei der Impfstoffsicherheit gewarnt und transparente, gründliche, internationale Bewertung von Wirksamkeit und Sicherheit in den klinischen Phasen der Prüfung angemahnt (35, vgl. auch 10).
Die Beschleunigung der Prüfphasen zur Impfstoffsicherheit: Im Durchschnitt dauert das Testverfahren eines Impfstoffs (Phasen I-III) 8-10 Jahre bevor er zugelassen wird (detaillierte Darstellung bei 36). Ziel des langen Verfahrens ist die Evaluierung der Sicherheit des Impfstoffs. Das Vertrauen in die Sicherheit von Impfstoffen ist von sehr großer Bedeutung, einerseits, weil damit Gesunde geimpft werden und andererseits, weil in vielen Industrienationen eine irrationale Skepsis gegenüber Impfungen besteht. Der bisher weltweit am schnellsten zugelassene Impfstoff, der nach der Zulassung nicht vom Markt genommen werden musste, beanspruchte 4 Jahre. Es handelte sich um einen Impfstoff gegen Mumps (11).
Für die beschleunigte Zulassung eines Impfstoffs gegen SARS-CoV-2 folgten die Zulassungsbehörden weltweit einem Modell, das der Öffentlichkeit im April 2020 u.a. von Bill Gates vorgestellt wurde. Es hat zum Ziel, binnen weniger als 18 Monaten nach der Erstsequenzierung des Genoms von SARS-CoV-2 einen Impfstoff zu entwickeln (12). Dieses Modell wurde bildhaft als „Teleskopierung“ der klinischen Testphasen bezeichnet (15). Dabei werden einzelne Prüfphasen und Testaufgaben zusammengeschoben. Beispielsweise erfolgten bei den oben genannten Kandidaten AZD1222 und BNT162b2 die Zulassungen für die klinische Prüfung bereits, bevor die präklinischen Versuche an Primaten endgültig ausgewertet waren. Außerdem wurden die klinischen Phasen I und II zu einer Phase I/II zusammengefasst und zeitlich verkürzt, was auch der Kandidatenliste der WHO zu entnehmen ist (2).
Die Beschleunigung der Prüfung eines Impfstoffs verkürzt zwangsläufig die Beobachtungszeiträume. Dies birgt Risiken in sich, da insbesondere in der klinischen Phase III, die aus guten Gründen oft Jahre dauert, seltene und verzögert auftretende Impfnebenwirkungen (Reaktogenität) klinisch relevant werden können. Die Teleskopierung birgt auch Risiken zur Einschätzung der klinischen Wirksamkeit der Impfung. Hier ist zwischen Immunogenität und klinischer Wirksamkeit zu unterscheiden. Der Nachweis der Immunogenität erfolgt serologisch durch den Nachweis neutralisierender Antikörper und T-Zell-vermittelter Immunität in Phase II. Der Nachweis der klinischen Wirksamkeit erfolgt in Phase III. Als wirksam kann ein Impfstoff nur dann eingestuft werden, wenn er menschliche Probanden beim natürlichen Kontakt mit dem Erreger vor der Infektion schützt. Der experimentelle Kontakt ist, insbesondere im Rahmen der beschleunigten Phasen zur Prüfung der Impfstoffsicherheit ebenfalls denkbar, medizinethisch aber umstritten.
Alternativ zum Kontakt mit dem Erreger besteht die Möglichkeit, die serologischen Befunde zur Immunogenität mit den serologischen Daten bereits zugelassener, wirksamer Impfstoffe zu vergleichen und auf dieser Basis die Wirksamkeit des neuen Impfstoffs einzuschätzen. Dies ist aber beim SARS-CoV-2 nur unter Vorbehalten möglich, da es in der Humanmedizin noch keinen zugelassenen Impfstoff gegen einen Erreger aus der Familie der Coronaviridae gibt. Bislang wurde in der Humanmedizin noch kein nukleinsäurebasierter Impfstoff gegen eine Infektionskrankheit zugelassen (weder ein RNA- noch ein DNA-Impfstoff), und virale Vektorimpfstoffe werden noch nicht lange bei Menschen angewendet.
Eine weitere Möglichkeit, die Wirksamkeit eines Impfstoffs abzuschätzen, besteht darin, Kohorten aus geimpften und nicht geimpften Probanden zu verfolgen, und nach einer angemessenen Zeitspanne zu evaluieren, ob sich die Infektionsraten signifikant unterscheiden. Solche Kohortenstudien brauchen jedoch Zeit und sollten zumindest eine winterliche Erkrankungswelle mit einbeziehen. Dieses Verfahren ist also mit dem angestrebten Zeithorizont für die Entwicklung einer wirksamen und verträglichen Impfung gegen SARS-CoV-2 nicht vereinbar. Von besonderer Bedeutung für die Eindämmung der Pandemie ist auch, ob ein Impfstoff zur „sterilen Immunität“ führt, also Geimpfte nicht nur vor der Erkrankung schützt, sondern auch verhindert, dass das Virus weitergeben werden kann (13, 14).
Der renommierte Genetiker und Virologe William Haseltine äußerte sich in einem Aufsatz im Scientific American zu den gegenwärtigen Strategien (15): „Die Teleskopierung von Testabfolgen und Genehmigungen setzt uns alle einem unnötigen Risiko im Zusammenhang mit der Impfung aus. (…) Schon eine ernste Nebenwirkung pro 1.000 Impfungen bedeutet bei 100 Mio. Menschen für 100.000 einen Schaden, obwohl sie zuvor gesund waren“. Die potenziellen Impfnebenwirkungen müssen gegen den Nutzen (Wirksamkeit und sterile Immunität) eines Impfstoffs – insbesondere hinsichtlich harter Endpunkte wie Tod oder bleibende Behinderungen – abgewogen werden. Wenn man von einer Letalität bei COVID-19 von im Median ca. 0,05% bei < 70-Jährigen weltweit ausgeht (16), wird es sehr schwer, in dieser Gruppe überhaupt einen Nutzen eines Impfstoffs nachzuweisen. Daher müssten die Impfstoffe eigentlich vorwiegend in der Gruppe der > 70-Jährigen getestet werden, was aber zurzeit nicht geschieht. Es ist auch zu befürchten, dass Impfstoffe für Ältere gar nicht zugelassen werden, weil sie bei ihnen nicht geprüft wurden. Ein weiterer wichtiger Nutzen wäre die Unterbrechung der Infektionskette, also die Erzeugung einer sterilen Immunität.
Aktuell erkennbare Probleme bei genetischen Impfstoffen gegen SARS-CoV-2: AZD1222-Impfstoff: Die vorläufige Auswertung der beschleunigten klinischen Phase I/II des viralen Vektorimpfstoffs AZD1222 von AstraZeneca/Vaccitech (randomisiert und einfachblind) zeigte bei 543 damit geimpften Probanden eine signifikante Häufung von Impfnebenwirkungen im Vergleich zu 534 Probanden, die mit einem zugelassenen Meningokokken-Impfstoff geimpft wurden (p < 0,05). Bei 70% der Probanden – mit oder ohne prophylaktische Einnahme von Paracetamol (P) – trat Fatigue auf, außerdem Kopfschmerzen bei 68% (61% mit P), systemische Muskelschmerzen bei 60% (48% mit P), Schüttelfrost bei 56% (27% mit P), erhöhte Temperatur bis 38°C bei 51% (36% mit P), Fieber > 38°C bei 18% (16% mit P) und allgemeines Krankheitsgefühl bei 61% (48% mit P). Von den 543 mit AZD1222 geimpften Probanden wurden 10% (n = 54) in ein vierwöchiges serologisches Monitoring eingebunden (Aufgabe aus Phase I), wobei sich bei 46% eine temporäre Neutropenie zeigte (17).
Während der Phase III wurde ein mit AZD1222 geimpfter Proband wegen einer transversen Myelitis (entzündliche demyelinisierende Erkrankung des Rückenmarks) im Krankenhaus behandelt (18). Diese Erkrankung mit Lähmungserscheinungen kann bei viralen Infektionen, als Autoimmunreaktion, bei Multipler Sklerose (MS), aber auch als Immunreaktion nach einer Impfung auftreten (19). Inzwischen wurde bekannt, dass eine weitere Versuchsperson bereits im frühen Stadium der Phase III (Juli 2020) die Symptome einer transversen Myelitis entwickelt hatte, was von AstraZeneca/Vaccitech auf eine MS-Erkrankung zurückgeführt wird. Laut einem in Nature publizierten Report seien Anfragen zu diesem Vorfall aus der zunehmend besorgten wissenschaftlichen Gemeinschaft von den Unternehmen unbeantwortet geblieben (20). Hier fehlt es an der Transparenz, die unabdingbar ist für das Vertrauen der Bevölkerung in die Sicherheit von Impfstoffen (vgl. 21). Nachdem Symptome einer transversen Myelitis zum zweiten Mal auftraten, wurde die Studie für 6 Tage unterbrochen und danach in Großbritannien, Südafrika und Brasilien fortgesetzt, ebenso nach einer etwas längeren Unterbrechung in den USA (21).
Im Tierversuch mit Rhesusaffen zeigte der AZD1222-Impfstoff nur eine eingeschränkte Wirksamkeit, und es wurde keine sterile Immunität (s.o) erreicht. Alle Tiere infizierten sich bei der Exposition mit SARS-CoV-2 („Challenge“), und replizierfähiges Virus konnte von der Nasenschleimhaut gewonnen werden. Auch war die Viruslast bei den geimpften Affen nicht geringer als bei den ungeimpften Kontrollen (22). William Haseltine (s.o.) schreibt, dass die Titer der erreichten neutralisierenden Antikörper sehr niedrig waren (23). Üblicherweise können die durch eine Impfung induzierten neutralisierenden Antikörper bei > 1.000-facher Verdünnung des Serums noch nachgewiesen werden und nicht wie in dieser Studie nur bei 4- bis 40-facher.
Der einzige, jedoch schwache klinische Hinweis auf eine gewisse Wirksamkeit dieses Impfstoffs kommt aus der Beobachtung, dass bei 3 der 6 geimpften Affen im Vergleich zu den anderen 3 und den ungeimpften die Atemfrequenz nicht so stark anstieg. Möglicherweise wurde also die Hälfte der geimpften Tiere etwas weniger krank.
Am Tag 7 nach dem „Challenge“ wurden die Affen obduziert. Bei 2 von 3 ungeimpften gab es Zeichen einer interstitiellen Pneumonie. Bei den geimpften Affen wurde dies nicht gefunden, möglicherweise ein weiterer schwacher Hinweis für Wirksamkeit des AZD1222-Impfstoffs (22). Auch wurde durch die Impfung der Schweregrad der Erkrankung nach der Virusexposition nicht verstärkt. Aber wie von anderen Impfstoffen bekannt, bedeutet dies nicht, dass eine solche Aggravierung beim Menschen nicht doch eintreten kann (23). Insgesamt ist die Wirksamkeit des Oxford-Impfstoffs im Tierexperiment bisher jedoch nicht vielversprechend. Ob die Vorbestellung durch Bundesgesundheitsminister Spahn für mehrere Millionen € eine gute Entscheidung war, bleibt abzuwarten.
BNT162b2-Impfstoff: Zum mRNA-Impfstoff BNT162b2 von BioNTech/Pfizer wurde bislang eine Auswertung von 45 Probanden aus der beschleunigten klinischen Phase I/II mit drei Dosierungen (10 μg, 30 μg, 100 μg) veröffentlicht. Die höchste Dosierung wurde wegen der Häufung schwerer Nebenwirkungen nach der ersten Impfung nicht weiter eingesetzt. Die favorisierte mittlere Stufe (30 μg) verursachte nach der obligatorischen zweiten Impfung Reaktogenität: Bei 75% der Probanden trat Fieber > 38°C auf, bei 85% Fatigue, bei 65% Schüttelfrost, bei 60% systemische Muskelschmerzen, bei 25% Gliederschmerzen und bei allen Probanden Kopfschmerzen. Nach der ersten Impfung wurde bei 45% (5 von 11) eine Abnahme der Lymphozyten im Blut festgestellt (davon bei einer Person hochgradig). Gemittelt über alle Nebenwirkungen berichteten in der Plazebogruppe nur 11,1% (1 von 9) über Nebenwirkungen (24).
Falsche Endpunkte, falsche Zielgruppe: In einem lesenswerten aktuellen Beitrag von Peter Doshi im BMJ (13) werden weitere wichtige Kritikpunkte an den Studien mit den derzeit in Phase III befindlichen SARS-CoV-2-Impfstoffen genannt. Dazu gehört, dass offenbar nur in wenigen Studien auf das Erreichen einer sterilen Immunität getestet wird (vgl. 13, 14). Dies wäre jedoch essenziell: Bei einer Infektion, die bei 2.000 jungen Menschen in weniger als einem Fall zum Tode führt, wird nicht nur ein sehr sicherer Impfstoff benötigt, sondern auch einer, der die Infektionskette unterbrechen kann. Doshi kritisiert auch, dass alle zurzeit laufenden Impfstudien mit jungen Erwachsenen durchgeführt werden und die Ergebnisse nicht auf Personen übertragbar sein werden, die ein höheres Risiko für schwere Verläufe haben – also Menschen > 70 Jahre (13).
Diskussion: Bei beiden aktuellen Impfstoff-Favoriten fällt eine signifikante Häufung von Nebenwirkungen auf, die bei AZD1222 infolge von Symptomen einer transversen Myelitis bei zwei Probanden besonderer Beachtung bedürfen. Zu BNT162b2 liegen entsprechende Auswertungen der fortgeschrittenen Phase II und der Phase III noch nicht vor. Generell bestätigen die bisherigen Daten, dass genetische Impfstoffe eine höhere Reaktogenität hervorrufen können in Form von u.a. Schmerz, Schwellung und Rötung an der Injektionsstelle, Fieber, Krankheitsgefühl, Appetitlosigkeit, aber auch überschießender Immunreaktionen. Deshalb sind bereits vor COVID-19 insbesondere nukleinsäurebasierte Impfstoffkandidaten nie über die präklinische Testung hinausgekommen (25, 26).
Da sich unerwünschte Autoimmunreaktionen und seltene Nebenwirkungen auch zeitlich verzögert zeigen können (15) und die weitere Abklärung von Wechselwirkungen mit z.B. anderen Wirkstoffen bzw. Arzneimitteln, anderen Impfstoffen und Grunderkrankungen im beschleunigten Verfahren nicht mit der erforderlichen Sorgfalt bzw. wissenschaftlichen Gründlichkeit erfolgen kann, ergeben sich aus den bisherigen Daten zur Sicherheit der SARS-CoV-2-Impfstoffe auch weitreichende Probleme hinsichtlich der gesundheitspolitischen Verantwortung bei der Vorsorge.
Mittlerweile kündigt auch das Tübinger Unternehmen CureVac für seinen mRNA-Impfstoff CVnCoV eine Zulassung im Januar oder Februar 2021 an, und dessen Mehrheitseigentümer, Dietmar Hopp, möchte „das Rennen um den besten Impfstoff gewinnen“ (27). Die zuvor genannten Bedenken gelten grundsätzlich auch für weitere genetische Impfstoffe, zu denen noch keine klinischen Ergebnisse vorliegen.
Hinsichtlich viraler Vektorimpfstoffe, die wie AZD1222 auf DNA-Viren beruhen, äußern einige Experten zusätzlich Bedenken wegen der derzeit gänzlich nicht auszuschließenden Möglichkeit, dass DNA ins Genom der Zielzellen eingeschleust werden könnte (28). Dasselbe potenzielle Risiko wurde in jüngerer Vergangenheit vielfach für DNA-Impfstoffe geäußert, da auch die hierbei eingebrachten Plasmide über zellkernumfassende Integrationsmechanismen die Translation in mRNA induzieren, wobei durch mögliche Aktivierung von Onkogenen oder Deaktivierung antikarzinogener Abschnitte das Tumorrisiko im Zielgewebe steigen könnte (sog. Insertionsmutagenese; vgl. 29-32). Ein derartiges Risiko würde möglicherweise erst nach Jahren klinisch auffallen, weshalb Verkürzungen der Testphasen bei diesen Impfstoffen besonders problematisch erscheinen. Vor der COVID-19-Pandemie gab es noch keine klinischen Testungen von DNA-Impfstoffen an Menschen. Vier DNA-Impfstoffe befinden sich derzeit in der klinischen Phase II (2).
Nach unserer Auffassung ist ein breiter wissenschaftlicher und gesellschaftlicher Diskurs über die Probleme der beschleunigten Prüfung hinsichtlich der Impfstoffsicherheit sowie eine Harmonisierung unverzichtbarer Studienendpunkte mit öffentlicher Anhörung kritischer Experten notwendig (vgl. 33). Ärztinnen und Ärzte und die Menschen, die sich impfen lassen wollen, müssen über Wirksamkeit und Risiken genetischer Impfstoffe, die nach verkürzten Zulassungsverfahren auf den Markt kommen, umfassend aufgeklärt werden. Es sollten dieselben Standards gelten, wie sie auch bei anderen Impfungen gefordert werden. Hierzu gehören die Antworten auf folgende Fragen für die Praxis (vgl. 34):
-
Für welche Zielgruppe ist der Impfstoff zugelassen bzw. welche Zielgruppe könnte durch die Impfung profitieren und welche wissenschaftliche Evidenz gibt es hierfür?
-
Mit welchen Nebenwirkungen muss gerechnet werden?
-
Wie lange hält die durch den Impfstoff induzierte Immunität an, und wann muss gegebenenfalls erneut geimpft werden?
-
Wie wird der Impfstoff nach seiner Zulassung auf seine Sicherheit überprüft?
-
Wer haftet bei Impfschäden?
Für weitere technische Details in der Entwicklung verschiedener Impfstoffe gegen SARS-CoV-2 empfehlen wir ein gerade in Nature erschienenes Review (37).
Literatur
- Wang, H., et al.: Eur. J. Clin. Microbiol. Infect. Dis. 2020, 39, 1629. Link zur Quelle
- WHO: Draft landscape of COVID-19 candidate vaccines 2020. WHO International, Stand 2.10.2020. (wird im Abstand von etwa 14 Tagen aktualisiert). Link zur Quelle
- AMB 2020, 54, 62. Link zur Quelle
- Schmidt, C.: Scientific American, 29.4.2020. Link zur Quelle
- Callaway, E.: Spektrum, 2.9.2020. Link zur Quelle
- ÄrzteZeitung, 1.10.2020: Link zur Quelle
- https://www.ema.europa.eu/en/news/ema- starts-second-rolling-review-covid-19-vaccine Link zur Quelle
- DNA India, 18.10.2020. Link zur Quelle
- Kurier: 16.10.2020. Link zur Quelle
- https://www.leopoldina.org/uploads/ tx_leopublication/2020_COVID-19_Joint _statement_Final.pdf Link zur Quelle
- Röcker, A.: Spektrum, 8.6.2020. Link zur Quelle
- Gates, B.: Gates Notes, 30.4.2020. Link zur Quelle
- Doshi, P.: BMJ 2020, 371, m4037. Link zur Quelle
- Dutta, A., et al.: Sci. Rep. 2016, 6, 32973. Link zur Quelle
- Haseltine, W.A.: Scientific American, 22.6.2020. Link zur Quelle
- Ioannidis, J.P.A.: Link zur Quelle
- Folegatti, P., et al.: Lancet 2020, 396, 467. Link zur Quelle
- Phillips, N., et al.: Nature, 9.9.2020. Link zur Quelle
- NIH – National Institute of Neurological Disorders and Stroke: Transverse myelitis fact sheet: Link zur Quelle
- Mallapaty, S., und Ledford, H.: Nature 2020, 586, 16. Link zur Quelle
- Cyranoski, D., und Mallapaty, S.: Nature 2020, 585, 331. Link zur Quelle
- van Doremalen, N., et al.: Nature 2020, 586, 578. Link zur Quelle
- Haseltine, W.A.: Link zur Quelle
- Mulligan, M.J., et al.: Nature 2020, 586, 589. Link zur Quelle
- Jiang, S.: Nature, 16.3.2020. Link zur Quelle
- Lurie, N., et al.: N. Engl. J. Med. 2020, 382, 1969. Link zur Quelle
- Brors, P., und Hofmann, S.: Handelsblatt, 4.9.2020. Link zur Quelle
- Vogel, P.U.B.: COVID-19: Suche nach einem Impfstoff. Springer Spektrum 2020, Wiesbaden, S. 24. Link zur Quelle
- Hasson, S., et al.: Asian Pac. J. Trop. Biomed. 2015, 5, 344. Link zur Quelle
- Medjitna, T., et al.: Dev. Biol. (Basel) 2006, 126, 261. Link zur Quelle
- Stenler, S., et al.: Hum. Vaccin. Immunother. 2014, 10, 1306. Link zur Quelle
- https://www.pharmazeutische-zeitung.de/ vektorviren-als-plattform-118262/seite/2/ Link zur Quelle
- Mehrotra, D.V., et al.: Ann. Intern. Med. 2020. Link zur Quelle
- Laine, C., et al.: Ann. Intern. Med. 2020. Link zur Quelle
- Golla, M.: Coronavirus: Pflege Professionell. Link zur Quelle
- Heaton, P.M.: N. Engl. J. Med. 2020. Link zur Quelle
- Krammer, F.: Nature 2020, 586, 516. Link zur Quelle