Viele Patienten, die operiert werden müssen, haben kardiovaskuläre Krankheiten und erhalten deswegen Hemmer der Thrombozytenfunktion. Speziell Patienten, bei denen Gefäßoperationen geplant sind, und Diabetiker haben häufig eine Koronare Herzkrankheit (KHK; Prävalenz 30-50%; 1). Die meisten erhalten Azetylsalizylsäure (ASS) zur Sekundärprophylaxe, einige auch eine duale Hemmung der Thrombozytenfunktion mit ASS plus Clopidogrel (Iscover®, Plavix®), so z.B. die Mehrzahl der Patienten mit koronaren Stents. Es wird hier nur Clopidogrel genannt. Die Aussagen sind aber auf den zweiten zugelassenen ADP-Blocker Prasugrel (Efient®) übertragbar. Etwa 5% der Stent-Patienten werden innerhalb eines Jahres nach der Implantation operiert (nicht am Herzen; 2). Bei ihnen stellt sich jeweils die Frage, ob die bestehende Hemmung der Thrombozytenfunktion ohne zu große kardiale Risiken pausiert werden kann, um das perioperative Blutungsrisiko zu minimieren.
Die Diskussion um dieses Thema offenbart Konflikte zwischen Chirurgen, Internisten und Neurologen wegen ihrer sehr unterschiedlichen Sichtweise auf die Problematik.
Operationen unter ASS erhöhen den Blutverlust um etwa 20-30% und unter dualer Hemmung der Thrombozytenfunktion (ASS plus Clopidogrel) um 50% (3). Letzteres führt auch zu einem erhöhten Transfusionbedarf. Die meisten Chirurgen fürchten die intra- und postoperativen Blutungen und ihre Folgen und wünschen sich daher eine rechtzeitige ASS- bzw. Clopidogrel-Pause. Die Einbestellung zur Operation ist daher in aller Regel mit dem Hinweis verbunden, alle Gerinnungshemmer bzw. ASS und Clopidogrel abzusetzen.
Dieses automatisierte Vorgehen ist jedoch in bestimmten Konstellationen gefährlich und manchmal sogar fahrlässig. Einerseits, weil das Absetzen der Plättchenhemmer zu einer verstärkten Aktivierung der Thrombozyten im Sinne eines Rebounds führen kann (4), andererseits, weil Patienten schwerwiegende Komplikationen erleiden können, wenn ihr kardiovaskuläres Grundrisiko perioperativ unterschätzt wird.
Um zu entscheiden, ob bei kardiovaskulär kranken Patienten perioperativ die medikamentöse Hemmung der Thrombozytenfunktion pausiert werden darf, müssen drei Fragen beantwortet werden:
1. Wie dringlich ist die geplante Operation?
2. Wie wichtig ist die Hemmung der Thrombozytenfunktion für den Patienten?
3. Wie groß ist das Blutungsrisiko bei der geplanten Operation?
Diese Fragen können in der Regel nicht von einer Disziplin allein beantwortet und entschieden werden. Die Kommunikation zwischen Chirurgen, Internisten, Neurologen und Anästhesisten ist unabdingbar.
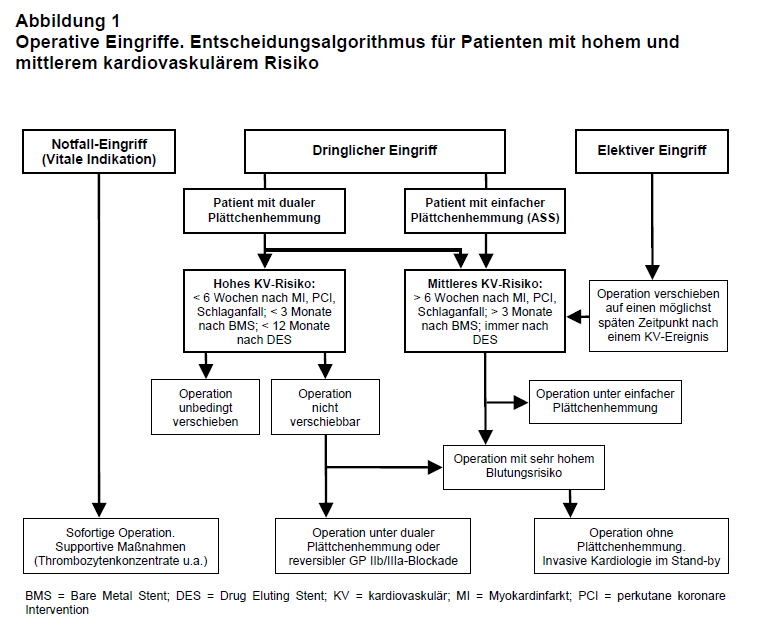
Zu Frage 1 (Dringlichkeit): Bei geplanten, nicht-kardialen Operationen sind drei Dringlichkeitsstufen zu unterscheiden: Notfalleingriffe, dringliche Eingriffe und elektive Eingriffe (s. Abb. 1). Bei Notfalleingriffen (vitale Indikation) erübrigt sich die Frage nach dem Absetzen der Plättchenhemmung. In der Regel dauert es fünf Tage bis sich der Thrombozytenpool zur Hälfte mit funktionstüchtigen Plättchen erneuert hat. Da es keine Möglichkeit zur Antagonisierung gibt, muss bei diesen Patienten bei Blutungskomplikationen auf Thrombozytenkonzentrate zurückgegriffen werden.
Elektive Eingriffe sind bei Patienten mit hohem kardiovaskulärem Risiko innerhalb bestimmter kritischer Zeitintervalle nach Stent-Implantation oder Myokardinfarkt (s.u.) unbedingt zu vermeiden. Sie müssen auf einen späteren Zeitpunkt verschoben werden. Nur bei niedrigem kardiovaskulärem Risiko darf elektiv operiert und die Hemmung der Thrombozytenfunktion pausiert werden.
Bei dringlichen Eingriffen ist naturgemäß der Diskussionsbedarf am größten. Dabei handelt es sich meistens um unvorhergesehene Eingriffe, wie Resektion neu entdeckter Tumore, operative Versorgung von Frakturen, Polypektomien, größere Zahneingriffe u.ä. Diese Operationen sollten so spät wie möglich nach dem kardiovaskulären Ereignis (Schlaganfall, Myokardinfarkt, Stent-Implantation) und zumindest unter ASS-Schutz erfolgen. Bei einzelnen Patienten kann sogar eine überbrückende Behandlung („Bridging”) mit reversiblen GP-IIb/IIIa-Blockern (Tirofiban = Aggrastat®, Eptifibatid = Integrilin®) versucht werden. Solche Eingriffe sollten generell nur in der Nähe eines Katheterzentrums mit 24-h Bereitschaft vorgenommen werden.
Heparine sind kein Ersatz für Thrombozytenfunktionshemmer! Ein „Bridging” mit niedermolekularem Heparin nach dem Absetzen von ASS und/oder Clopidogrel ist zwar vielerorts üblich, jedoch als Ersatz wirkungslos und daher riskant (4, 5).
Zu Frage 2 (individuelle Wichtigkeit der Thrombozytenhemmung): Die zweite Frage ist nach dem jeweiligen individuellen kardiovaskulären Grundrisiko zu stellen, weil sich hieraus die Notwendigkeit zur Hemmung der Thrombozytenfunktion ableitet.
OP-Kandidaten mit niedrigem kardiovaskulärem Grundrisiko sind solche, die noch nie ein kardiales oder neurologisches Ereignis hatten (Primärprävention) oder die nach einem kardialen Ereignis längere Zeit (mindestens ein Jahr, besser noch länger) klinisch stabil waren. Bei dieser Konstellation können Thrombozytenfunktionshemmer mit vertretbarem Risiko pausiert werden. Eine Ausnahme sind Patienten mit einem Medikamenten-beschichteten Stent (Drug Eluting Stent = DES), da sich dieser auch noch nach Jahren thrombotisch verschließen kann. Diese Patienten sollten immer unter ASS-Schutz operiert werden.
OP-Kandidaten mit hohem kardiovaskulärem Grundrisiko sind solche, die innerhalb des zurückliegenden Jahres ein Akutes Koronarsyndrom (ACS) erlitten oder einen koronaren Stent erhalten haben. Dabei gilt: je näher das Ereignis zurückliegt, desto höher das Risiko. Wenn z.B. Patienten innerhalb der ersten vier Wochen nach Stent-Implantation operiert (nicht am Herzen) werden müssen, ist die kardiale Komplikationsrate (Myokardinfarkt, Re-PTCA, Stent-Thrombose, Tod) enorm hoch (30-50%), selbst wenn die OP unter dualer Hemmung der Thrombozytenfunktion erfolgt (3). In dieser Zeit sind daher nur Notfalleingriffe mit vitaler Indikation zulässig. Das kardiale Risiko sinkt bei unbeschichteten Stents (Bare metal Stents = BMS) nach drei Monaten auf < 5%; bei DES bleibt es mindestens ein Jahr lang bei > 10%. In dieser Zeit dürfen dringliche Operationen nach strenger Indikationsstellung durchgeführt werden, aber nur unter fortlaufender Hemmung der Thrombozytenfunktion (mindestens ASS). Einzige Ausnahmen sind OP mit sehr hohem Blutungsrisiko (s.u.).
Die am meisten gefürchtete Komplikation einer ASS/Clopidogrel-Pause ist die Stent-Thrombose. Diese ist mit einer Letalität von 20-45% und sehr hoher Morbidität (Herzinsuffizienz, ventrikuläre Arrhythmien) verbunden (1, 2). Risikofaktoren für eine Stent-Thrombose sind komplexe Koronarinterventionen und komplexe anatomische Gefäßverhältnisse, hohes Alter, Diabetes, Niereninsuffizienz, niedrige linksventrikuläre Ejektionsfraktion (LVEF), Blutdruckabfall bei der Operation und – weitaus am bedeutsamsten – das frühzeitige Beenden der Thrombozytenhemmung (90-fache Erhöhung des Risikos; 6). Daher gilt: hat ein Patient weniger als drei Monate zuvor einen BMS oder weniger als 12 Monate zuvor einen DES erhalten, sollte er, wenn irgendwie vertretbar, nicht operiert werden. Dies gilt auch für Patienten, die weniger als sechs Wochen zuvor einen Myokardinfarkt, eine koronare Intervention (PCI) ohne Stent oder einen Schlaganfall hatten.
Die Konsequenzen einer Blutung im Operationsgebiet sind klinisch als weniger bedeutsam einzustufen als eine Stent-Thrombose oder ein Reinfarkt. Jenseits der genannten Zeiten (also > sechs Wochen nach Myokardinfarkt, > drei Monate nach BMS oder > zwölf Monate nach DES) sollte die Operation unbedingt unter ASS-Schutz erfolgen.
Nach perioperativer ASS- und/oder Clopidogrel-Pause ist diese Therapie zum frühest möglichen Zeitpunkt wieder aufzunehmen (je nach Wundverhältnissen). Wahrscheinlich ist es sogar vorteilhaft, mit einer „loading dose” zu beginnen.
Zu Frage 3 (Blutungsrisiko): Dieses hängt von verschiedenen Faktoren ab, nicht nur von der Begleitmedikation (Thrombozytenfunktionshemmer, SSRI, Gingko-Präparate u.a.). Operationsfeld, Operationstaktik und -geschick, Übersichtlichkeit und Komprimierbarkeit im Blutungsbereich sind ebenso bedeutsame Faktoren. Daher sollten bei Risikopatienten (s.o.) nur erfahrene Operateure und schonende Techniken eingesetzt werden. Auf konsequente Blutstillung ist zu achten. Thrombozytenkonzentrate und Gerinnungsfaktoren können bei starken Blutungen indiziert sein.
Es gibt keine Übereinkunft darüber, welche Operationen als besonders blutungsriskant anzusehen sind und welche weniger. In vielen Publikationen wird folgende Einteilung vorgenommen:
Ein geringes Blutungsrisiko bzw. gut komprimierbare Blutungen mit sehr seltenem Transfusionsbedarf haben kleinere orthopädische, HNO-, dermatologische, plastische, Gefäß- und allgemeinchirurgische Operationen sowie Endoskopien mit Biopsie, OP der vorderen Augenkammer (Katarakt) und zahnchirurgische Eingriffe. Diese Eingriffe können recht sicher unter Thrombozytenfunktionshemmern erfolgen.
Ein mittleres Blutungsrisko (gelegentlicher bis regelmäßiger Transfusionsbedarf; in aller Regel stillbare Blutungen) findet sich bei Eingriffen in der Viszeralchirurgie (Schilddrüse, Leber, Pankreas), der Herzchirurgie, der großen orthopädischen Chirurgie, bei HNO- und rekonstruktiven Eingriffen, der endoskopischen Urologie und bei endoskopischer Polypektomie. Bei diesen Operationen ist eine duale Plättchenhemmung sehr riskant und sollten deshalb verschoben werden bis sie nicht mehr erforderlich ist.
Ein sehr hohes Blutungsrisiko findet sich bei Eingriffen der intrakraniellen Neurochirurgie, der Spinalkanal-Chirurgie und bei Operationen an den Sinnesorganen, besonders der hinteren Augenkammer (Glaukom). Diese Eingriffe sollten wegen der hohen Gefahr bleibender Schäden durch eine Blutung generell ohne Plättchenhemmer durchgeführt werden. Solche „ungeschützten” Eingriffe sollten jedoch nur an Zentren mit 24-Stunden-Katheterbereitschaft vorgenommen werden, um bei einem postoperativen akuten Koronarsyndrom sofort intervenieren zu können.
Ein Entscheidungsalgorithmus für Patienten mit hohem und mittlerem kardiovaskulärem Risiko wird in Abb. 1 vorgeschlagen.
Literatur
- ACC/AHA 2007 Guidelines on Perioperative Cardiovascular Evaluation and Care for Noncardiac Surgery: Circulation 2007, 116, e418. Link zur Quelle Erratum: Circulation 2008, 117, e154 und 2008,118, e143.
- Vicenzi, M.N., et al.: Br. J. Anaesth. 2006, 96, 686. Link zur Quelle
- van Kuijk, J.P., et al.: Am. J. Cardiol. 2009, 104, 1229. Link zur Quelle
- Möllmann, H., et al.: Clin. Res. Cardiol. 2009, 98, 8. Link zur Quelle
- Chou, S., et al.: Rev. Cardiovasc. Med. 2009, 10, 209. Link zur Quelle
- Iakovou, I., et al.: JAMA 2005, 293, 2126. Link zur Quelle