Eine Auswertung der Gesundheitsdaten von über 32 Mio. Engländern unter Federführung der Universität Oxford liefert wichtige Informationen zur Häufigkeit von neurologischen Komplikationen im Zusammenhang mit einer SARS-CoV-2-Infektion bzw. mit Impfungen gegen diesen Erreger (1). Die 19 Autoren aus verschiedenen Fachdisziplinen führten die individuellen Gesundheitsdaten aus 2 nationalen Datenbanken zusammen: aus der „National Immunisation Management Service“ (NIMS), in der alle Impfungen erfasst werden, und Informationen aus dem National Health Service (NHS) zu Mortalität, Krankenhausbehandlungen und Nachweis von SARS-CoV-2-Infektionen.
Im Zeitraum zwischen 1.12.2020 und 31.5.2021 wurden alle Todes- und stationären Behandlungsfälle mit den Diagnosen akute demyelinisierende Erkrankung, Enzephalitis/Meningitis/Myelitis, Guillain-Barré-Syndrom (GBS), idiopathische Facialisparese, Myasthenie, hämorrhagischer Schlaganfall und Subarachnoidalblutung identifiziert und untersucht, ob diese in einem zeitlichen Zusammenhang mit einer SARS-CoV-2-Infektion oder mit der 1. Impfung gegen SARS-CoV-2 standen.
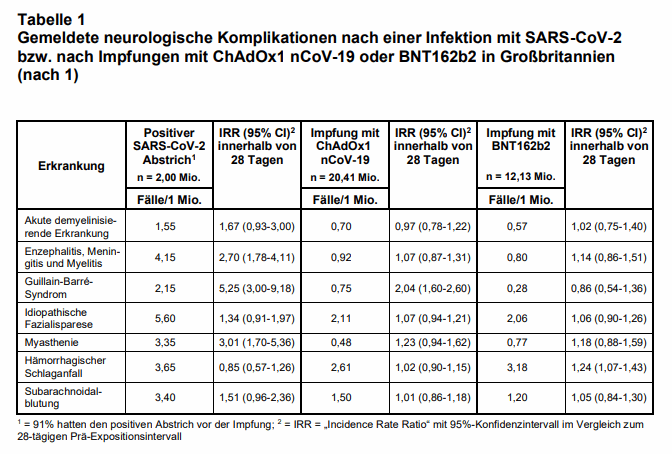
Die SARS-CoV-2-Infektion war definiert über ein nicht genauer beschriebenes „positives Testresultat“ (n = 2.005.280). Die Impfung gegen SARS-CoV-2 erfolgte in dem analysierten Zeitraum entweder mit ChAdOx1 nCoV-19 von Astra Zeneca (n = 20.417.752) oder mit BNT162b2 von BioNTech (n = 12.134.782). Der positive Test bzw. die Erstimpfung galt als Indexereignis. Die unmittelbare Zeit davor (28 Tage) diente für jede Person als eigene Kontrolle, die Zeit danach (28 Tage) als untersuchtes Risikointervall. Es handelt sich um ein sog. „self-controlled case series“ Design.
Die Ergebnisse der Analyse sind in Tab. 1 dargestellt. Bis auf die hämorrhagischen Insulte fand sich innerhalb eines Monats nach einem positiven SARS-CoV-2-Test ein signifikanter Anstieg bei allen untersuchten neurologischen Erkrankungen, um den Faktor 1,2-5,2. Das größte Risiko besteht für GBS, Myasthenie und Enzephalitis/Meningitis/Myelitis. Zwischen symptomatischen und asymptomatischen SARS-CoV-2-Infektionen wurde nicht differenziert.
Nach einer Impfung mit ChAdOx1 nCoV-19 wurde innerhalb von 28 Tagen nur ein zweifach erhöhtes Risiko für eine Krankenhausbehandlung wegen GBS errechnet und nach einer Impfung mit BNT162b2 ein um ein Viertel höheres Risiko für einen hämorrhagischen Schlaganfall.
Die Autoren schätzen, dass nach einer Impfung mit ChAdOx1 nCoV-19 mit 38 zusätzlichen GBS-Erkrankungen pro 10 Mio. Exponierten zu rechnen ist (75% der Betroffenen waren im Alter zwischen 50-79 Jahren). Da auch ein weiterer Vektorimpfstoff dieses Risiko aufweist (s.u.) und nach Impfung mit mRNA-Vakzinen nicht vermehrt GBS beobachtet wurde, liegt ein kausaler Zusammenhang mit der verwendeten Impftechnologie nahe. Da aber auch bei einer natürlichen SARS-CoV-2-Infektion mit deutlich mehr zusätzlichen GBS-Fällen zu rechnen ist (145 pro 10 Mio. Exponierten), kann die Impfung mit den untersuchten Vektorimpfstoffen trotzdem als sicherer hinsichtlich GBS angesehen werden.
Eine Impfung mit BNT162b2 führt nach Berechnungen der Autoren zu 60 zusätzlichen hämorrhagischen Schlaganfällen pro 10 Mio. Exponierte. Betroffen sind v.a. Personen > 60 Jahre (92%) und etwas häufiger Frauen (55%). Der Pathomechanismus ist noch unklar. Die natürliche SARS-CoV2-Infektion führt nicht zu einer signifikanten Zunahme von hämorrhagischen Schlaganfällen (vgl. 9).
Über die Auslösung eines GBS durch Impfungen wird seit Jahren immer wieder diskutiert. Dabei standen in der Vergangenheit besonders die Influenza-Impfungen im Verdacht (vgl. 2). Eine Metaanalyse von Daten aus 6 Überwachungssystemen ergab, dass beispielsweise der H1N1-Influenza-A-Impfstoff aus der Saison 2009 mit einem leicht erhöhten Risiko für GBS verbunden war. Die geschätzte Zahl der zusätzlichen GBS-Fälle betrug nach einer Metaanalyse 16 pro 10 Mio. Geimpfte (3). Auch über mögliche Zusammenhänge zwischen GBS und Impfungen mit einem quadrivalenten Meningokokken-Konjugatimpfstoff, rekombinanter Zoster- und der HPV-Vakzine wurde wiederholt hingewiesen. Insgesamt sind die zusätzlichen Fälle von GBS jedoch sehr gering und die Nutzen-Risiko-Relation wird als positiv bewertet (vgl. 2).
Beim Paul-Ehrlich-Institut (PEI) in Deutschland gingen in den ersten 9 Monaten seit Beginn der SARS-CoV-2-Impfkampagne insgesamt 255 Meldungen eines GBS oder seiner bulbären Variante, dem Miller-Fisher-Syndrom (MFS) ein (4). Das entspricht bei insgesamt 108 Mio. Impfdosen einer Häufigkeit von 0,23 auf 100.000 Impfungen. Die meisten Betroffenen waren im mittleren Lebensalter, nur 6,2% < 30 Jahre alt. Insgesamt 17 Patienten (6,6%) mussten intensivmedizinisch behandelt werden, 6 (2,3%) starben an dieser Komplikation. Über ihre Komorbiditäten werden in dem Bericht keine Angaben gemacht.
Bei den Daten des PEI fällt auf, dass ein GBS/MFS v.a. bei Personen auftritt, die mit Vektorimpfstoffen geimpft wurden (ChAdOx1 nCoV-19 bzw. Ad26.COV2.S von Johnson & Johnson): 0,84 bzw. 1,1 Meldungen pro 100.000 Impfungen). Zu den mRNA-Vakzinen (Comirnaty® = BNT162b2 bzw. Spikevax®, Moderna) gab es deutlich weniger Meldungen: 0,13 bzw. 0,11 Meldungen pro 100.000 Impfungen). Diese Zahlen liegen etwa im Bereich der Hintergrundinzidenz (5). Eine „Observed-versus-Expected“-Analyse ergab ein deutliches Risikosignal für beide Vektorimpfstoffe: standardisiertes Morbiditätsrisiko (SMR) nach 40 Tagen 3,26 für ChAdOx1 nCoV-19 und 3,96 für COVID-19 Vaccine Janssen®.
Auch aktuelle Daten aus dem US-amerikanischen „Vaccine Adverse Event Reporting System“ (VAERS, Spontanmeldesystem) weisen auf ein erhöhtes Risiko für GBS nach einer Impfung mit Vektorimpfstoffen hin (6). In den USA ist ja bislang von den Vektorimpfstoffen nur die COVID-19 Vaccine Janssen (Ad26.COV2.S) zugelassen. Bis Juli 2021 wurden VAERS insgesamt 130 mutmaßliche GBS-Fälle nach Impfung mit Ad26.COV2.S gemeldet, d.h. gemeldete Verdachtsfälle, die durch Spezialisten gesichtet und als wahrscheinlich bewertet wurden – „presumptive cases“). Die Betroffenen waren im Median 56 Jahre alt, 46 Personen (32%) bleiben voraussichtlich dauerhaft behindert, eine Person (0,8%) ist gestorben. Bis zum Zeitpunkt der Analyse waren über 13,2 Mio. Impfdosen verabreicht worden. Dies entspricht etwa einem GBS pro 100.000 Impfungen und ist mehr als viermal so viel wie erwartet (Hintergrundinzidenz). Die Autoren schätzen 6,3 zusätzliche Fälle von GBS pro 100.000 Personenjahre nach Impfung mit Ad26.COV2.S (oder 63 pro 10 Mio.), was den o.g. Schätzungen sehr ähnelt.
Dem ARZNEIMITTELBRIEF sind periphere Nervenläsionen nach Impfung mit SARS-CoV-2-Vakzinen bekannt geworden (Fingerparästhesie, Ulnarisparese). Es ist nach wie vor wichtig, alle UAW den zuständigen Behörden zu melden.
Fazit: Eine Infektion mit SARS-CoV-2 kann zu unterschiedlichen schwerwiegenden neurologischen Komplikationen führen. Nach einer aktuellen Analyse aus dem britischen Gesundheitssystem sind dies in erster Linie das Guillain-Barré-Syndrom sowie Myasthenie, Enzephalitis, Meningitis oder Myelitis. Auch eine Impfung gegen SARS-CoV-2 birgt geringe neurologische Risiken. Vektorimpfstoffe haben ein Risiko für ein Guillain-Barré-Syndrom, das allerdings deutlich geringer ist als bei einer Infektion mit SARS-CoV-2 (38 vs. 145 zusätzliche Fälle pro 10 Mio. Exponierte). mRNA-Impfstoffe scheinen das Risiko für entzündliche Erkrankungen des Nervensystems nicht zu erhöhen, jedoch ist zumindest die Impfung mit BNT162b2 mit leicht vermehrten hämorrhagischen Insulten assoziiert: 60 zusätzliche Fälle pro 10 Mio. Exponierte. Diese Risiken sollten bekannt sein und in die Impfberatung einfließen.
Zusatzinformation: Unter der Entität Guillain-Barré-Syndrom (GBS) werden inflammatorische Polyneuropathien zusammengefasst, die sich pathogenetisch ähneln, jedoch klinisch, prognostisch und therapeutisch unterschiedlich sind. Die in Europa dominierende Form ist die „akute inflammatorische demyelinisierende Polyneuropathie“ (AIDP). Sie ist durch rasch aufsteigende, motorische und sensible Ausfälle gekennzeichnet. Alle myelinisierten Nerven (motorische, sensorische, kraniale, sympathische) können von der Entzündung betroffen sein. Das Ausmaß der Entzündung bestimmt die Symptome. Als Landry-Paralyse wird eine sehr schnell fortschreitende Variante des GBS bezeichnet, bei der es innerhalb weniger Stunden zur Ateminsuffizienz mit der Notwendigkeit einer künstlichen Beatmung kommt. Es gibt auch akute Formen mit primärem Befall der Hirnnerven, wie das Miller-Fisher-Syndrom (MFS: Augenmuskellähmungen, Areflexie, Ataxie) oder Fazialisparesen.
Die Diagnose GBS wird z.B. an Hand der Kriterien der Brighton Collaboration gestellt und basiert auf Symptomen, elektrophysiologischen und laborchemischen Befunden (Liquor, Antikörper gegen Ganglioside und paranodale Proteine). Die Langzeitprognose ist bei den meisten Patienten relativ günstig: > 50% erholen sich innerhalb eines Jahres vollständig, etwa 80% können wieder selbständig gehen (7). Bei etwa 10% bleiben jedoch motorische Beeinträchtigungen, und ein Teil der Patienten entwickelt ein Fatigue-Syndrom oder eine autonome Dysfunktion. Bei 5-10% der Patienten ist der Verlauf kompliziert und langwierig. Wenn Patienten beatmungspflichtig werden, beträgt die Sterblichkeit ca. 20%.
Für die Entstehung eines GBS gibt es verschiedene Erklärungsmodelle. Am häufigsten wird eine Fehlfunktion des Immunsystems genannt. Im Rahmen einer Infektionsabwehr reagiert das Immunsystem auf ein Epitop des Erregers, welches einer molekularen Struktur im Körper ähnelt (molekulares Mimikry). Im Falle des ADIP wären die fälschlicherweise attackierten Strukturen die Myelinscheiden. Nach der International Guillain Barré Syndrome Outcome Study (IGOS; 8) berichten 76% der Betroffenen über ein potenziell auslösendes Ereignis in den 4 Wochen vor der Erkrankung. Meist ist dies eine Infektion der oberen Atemwege (35%) oder eine Gastroenteritis (27%). Häufige, mit einem GB in Zusammenhang stehende Erreger sind Campylobacter jejuni, das Zika-Virus, Haemophilus influenzae, Mycoplasma pneumoniae, Cytomegalie-Viren sowie die Erreger von „influenza-like illnesses“. Ein kleiner Teil der Betroffenen hatte zuvor eine Operation oder ein Trauma. Außerdem gibt es Assoziationen von GBS mit Knochenmarktransplantation, Hodgkin-Lymphom, systemischem Lupus erythematodes oder Sarkoidose. Auch bei einigen Medikamenten wird ein ursächlicher Zusammenhang vermutet, darunter TNF-Alpha-Antagonisten, Tacrolimus und Suramin, Isotretinoin und Immun-Checkpoint-Inhibitoren.
Literatur
- Patone, M., et al.: Nat. Med. 2021, Oct 25. Online ahead of print. Link zur Quelle
- AMB 1999, 33, 15b. Link zur Quelle
- Salmon, D.A., et al.: Lancet 2013, 381, 1461. Link zur Quelle
- PEI Sicherheitsbericht: Verdachtsfälle von Nebenwirkungen und Impfkomplikationen nach Impfung zum Schutz vor COVID-19 seit Beginn der Impfkampagne. Vom 20.9.2021. Link zur Quelle . Zugriff am 31.10.2021.
- Yuki, N., und Hartung, H.-P.: N. Engl. J. Med. 2012, 366, 2294. Link zur Quelle
- Woo, E.J., et al.: JAMA 2021, 326, 1606. Link zur Quelle
- Rajabally, Y.A., und Uncini, A.: J. Neurol. Neurosurg. Psychiatry 2012, 83, 711. Link zur Quelle
- Doets, A.Y., et al. (IGOS = International Guillain Barré syndrome Outcome Study): Brain 2018, 141, 2866. Link zur Quelle
- https://www.pei.de/SharedDocs/Downloads/ DE/newsroom/dossiers/sicherheitsberichte/sicherheitsbericht- 27-12-20-bis-30-09-21.pdf?__blob= publicationFile&v=8 Link zur Quelle