Es ist bekannt, dass in der Pathogenese der Atherosklerose eine inflammatorische Komponente eine wesentliche Rolle spielt. Ein Hinweis hierauf ist die Korrelation kardiovaskulärer Ereignisse mit hochnormalen oder geringfügig erhöhten Serumspiegeln des C-reaktiven Proteins (CRP). Hoch sensitives CRP (hs-CRP) kann mittels spezieller Tests gemessen werden und wird als unabhängiger kardiovaskulärer Risikofaktor (kontrovers) diskutiert (1, 2). Die medikamentöse Hemmung der Atheroskleroseprogression konzentriert sich bisher auf die Behandlung klassischer Risikofaktoren – insbesondere die Senkung des LDL-Cholesterins – aber nicht auf antiinflammatorische Ansätze. Nichtsteroidale Antiphlogistika sind sogar mit einem erhöhten kardiovaskulären Risiko assoziiert. Die Ergebnisse der aktuell publizierten CANTOS-Studie deuten nun erstmals auf einen positiven Effekt einer spezifischen antiinflammatorischen Therapie mit Canakinumab (Ilaris®) bei Hochrisikopatienten mit Koronarer Herzerkrankung (KHK) hin (3).
Methodik: Die vom pharmazeutischen Unternehmer Novartis gesponserte Doppelblindstudie untersuchte die Wirkungen des monoklonalen Antikörpers Canakinumab, eines Interleukin-1β-Antagonisten, an 10.061 Patienten aus 1.132 Zentren (mittleres Alter 61 Jahre, 25,7% Frauen, 40% Diabetiker, 91% unter Statin-Behandlung) mit vorangegangenem (< 30 Tage) Myokardinfarkt und persistierend erhöhtem hs-CRP (≥ 2 mg/l). Von den Patienten wurden zuvor 67% koronarinterventionell und 14% koronarchirurgisch behandelt. Canakinumab wurde in drei Dosierungen (50 mg, 150 mg, 300 mg) randomisiert mit Plazebo verglichen (jeweils s.c. Injektion alle 3 Monate). Der kombinierte primäre Endpunkt umfasste Myokardinfarkt, nicht-tödlichen Schlaganfall und kardiovaskulären Tod.
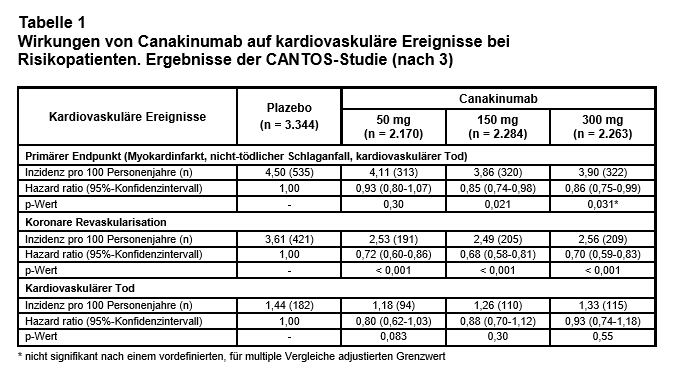
Ergebnisse: Sie sind für den primären Endpunkt und ausgewählte einzelne Endpunkte nach einer mittleren Nachbeobachtungszeit von 3,7 Jahren in Tab. 1 dargestellt. Statistische Signifikanz (nach einem vordefinierten, für multiple Vergleiche adjustierten Signifikanzwert) erreichte für den primären Endpunkt lediglich die 150-mg-Dosis. Koronare Revaskularisierungen wurden in allen Dosierungsgruppen im Vergleich zu Plazebo signifikant reduziert (relative Risikoreduktion etwa 30%). Die Effekte auf die kardiovaskuläre und die Gesamtletalität waren jedoch nicht signifikant unterschiedlich. Diese Ergebnisse zeigten sich konsistent in allen Subgruppen. Unter Canakinumab kam es signifikant häufiger zu tödlichen Infektionen oder Sepsen (Inzidenzrate 0,31 vs. 0,18 pro 100 Personenjahre; p = 0,02 für kombinierte Verumgruppen vs. Plazebo). Arthritische Symptome (inkl. Arthrose und Gicht) wurden hingegen signifikant positiv beeinflusst (2,26 vs. 3,32; p < 0,001). Dies traf überraschenderweise auch auf tödliche Krebserkrankungen zu (0,45 vs. 0,64; p = 0,02), insbesondere auf Lungenkarzinome.
Diskussion: Es ist bemerkenswert, dass in der CANTOS-Studie günstige Effekte auf kardiovaskuläre Endpunkte durch einen antiinflammatorisch wirkenden Antikörper nachgewiesen wurden – und dies ohne Änderung der Serumlipidspiegel. Allerdings waren die absoluten Effekte klein, und sie senkten nicht die Letalität. Auch das höhere Infektionsrisiko, von dem insbesondere ältere Patienten und Diabetiker betroffen waren, gibt Anlass zur Besorgnis. Die vom Hersteller erhoffte Indikationsausweitung wird es wahrscheinlich nicht geben. Canakinumab ist in Europa seit 2009 zur Behandlung einer Gruppe seltener Autoimmunerkrankungen und seit 2013 zur Behandlung der Gicht (bei Kontraindikation für nichtsteroidale Antiphlogistika und Colchicin) zugelassen. Eine Einzeldosis von 150 mg kostet ca. 15.000 €. Die unerwarteten Auswirkungen von Canakinumab auf die Inzidenz von Lungenkarzinomen und -letalität werden als „exploratorische Ergebnisse“ in einer separaten Publikation besprochen (4). Eine abschließende Beurteilung ist nicht möglich. Dazu sind adäquate onkologische Studien erforderlich.
Die Studienautoren haben die Vision eines „personalisierten“, am hs-CRP orientierten KHK-Managements (5) – wie bereits (wenig überzeugend) nach ihrer JUPITER-Studie zur Statin-Medikation im Rahmen der Primärprävention (6, 7). In der vom US-amerikanischen National Heart, Lung und Blood Institute finanzierten CIRT-Studie soll nun auch der Einfluss niedriger Dosen des als Generikum erhältlichen Folsäure-Antagonisten Methotrexat auf kardiovaskuläre Ereignisse untersucht werden; erste Ergebnisse werden in 2-3 Jahren erwartet.
Bemerkenswert ist ein potenzieller Interessenkonflikt des Autors Ridker, P.M.: Er ist Patentinhaber eines hs-CRP-Labortests (8). Ob einzelne antiinflammatorische bzw. zytostatische Wirkstoffe mit entsprechenden Nebenwirkungsprofilen geeignet sind, eine multifaktorielle, sehr häufig durch Lebensstilfaktoren mitverursachte Erkrankung wie die Atherosklerose zu behandeln, ist aus unserer Sicht ebenso fraglich wie die Sinnhaftigkeit einer Therapiesteuerung durch einen so unspezifischen Biomarker wie hs-CRP.
Fazit: Der monoklonale Interleukin-Antikörper Canakinumab reduzierte in einer großen Multicenterstudie kardiovaskuläre Endpunkte bei Hochrisikopatienten mit koronarer Herzkrankheit. Die absoluten Effekte waren jedoch gering, die Letalität wurde nicht gesenkt und Infektionen nahmen zu. Die Behandlungskosten sind exorbitant hoch. Wir halten das Therapiekonzept, ebenso wie der Autor eines begleitenden Editorials (9) grundsätzlich für fragwürdig.
Literatur
-
AMB 2005, 39, 29a. Link zur Quelle
-
AMB 2010, 44, 14. Link zur Quelle
-
Ridker, P.M., et al. (CANTOS = Canakinumab ANtiinflammatory Thrombosis Outcome Study): N. Engl. J. Med. 2017, 377, 1119. Link zur Quelle
-
Ridker, P.M., et al. (CANTOS = Canakinumab ANtiinflammatory Thrombosis Outcome Study): Lancet. Link zur Quelle
-
http://www.medscape.com/viewarticle/884745 Link zur Quelle
-
Ridker, P.M., et al. (JUPITER = Justification for the Use of statins in Prevention: an Intervention Trial Evaluating Rosuvastatin): N. Engl. J. Med. 2008, 359, 2195. Link zur Quelle
-
AMB 2009, 43, 04. Link zur Quelle
-
Supplementary Appendix der CANTOS-Originalpublikation.
-
Harrington, R.A.: N. Engl. J. Med. 2017, 377, 1197. Link zur Quelle