Zusammenfassung: Für die ersten beiden in der EU am 21.12.2020 (BNT162b2) und am 6.1.2021 (mRNA-1273) bedingt zugelassenen mRNA Impfstoffe gegen SARS-CoV-2 ist nachgewiesen, dass sie bei den untersuchten Personengruppen und den im letzten Quartal 2020 prävalenten Virusvarianten über einen Zeitraum von mindestens 2-3 Monaten symptomatische COVID-19-Infektionen und schwere Verläufe verhindern können. Erfreulicherweise wirken sie auch bei den am meisten durch COVID-19 Bedrohten, den älteren Menschen. Einige wichtige Personengruppen wurden in den Studien jedoch nicht oder nur unzureichend untersucht: Immunsupprimierte, Schwangere, Kinder und Jugendliche sowie ältere Menschen ≥ 80 Jahre. Die Ergebnisse dürfen also nicht ohne weiteres auf diese übertragen werden. Auch sollten die genannten relativen Zahlen zur Wirksamkeit (95% bzw. 94,1%) mit großer Vorsicht bewertet werden, denn sie sind an relativ wenigen Infizierten erhoben worden. Da der Impfschutz nicht vollständig ist, die Nachbeobachtungszeit erst wenige Wochen beträgt und die Antikörperspiegel mit der Zeit sinken, kann die Dauer der protektiven Immunität nicht sicher beurteilt werden. Weitere offene Fragen zur Wirksamkeit betreffen die Prävention asymptomatischer Infektionen und v.a. die für die Eindämmung der Pandemie sehr wesentliche Erzeugung einer sterilen Immunität, d.h. die Verhinderung einer Übertragung des SARS-CoV-2 durch Geimpfte. Die Verträglichkeit beider Impfstoffe ist – verglichen mit anderen Impfungen – eher mäßig. Mehr als drei Viertel der Geimpften hat in der Woche nach der Impfung lokale und mehr als die Hälfte systemische unerwünschte Arzneimittelereignisse (UAE). Sie sind nach der 2. Impfung häufiger als nach der 1. und bei Jüngeren häufiger als bei Älteren. Unklar sind noch die Häufigkeit und Bedeutung später auftretender UAE. Weil die Pharmakovigilanz in der jetzt begonnenen Impfkampagne besonders wichtig ist, soll bereits der Verdacht von UAE im Zusammenhang mit der Impfung an die zuständigen Institutionen gemeldet werden. Außerdem sollte die Bevölkerung gründlich und evidenzbasiert über Nutzen und Risiken der Impfstoffe aufgeklärt werden. Hierzu gehört auch, dass die Ergebnisse der klinischen Studien allgemeinverständlich dargestellt und Erfahrungen aus den bereits angelaufenen Impfprogrammen zeitnahe kommuniziert werden.
Impfstoff BNT162b2 (= Tozinameran; Comirnaty®; BioNTech/Pfizer)
Zulassung: Auf die weltweit erste Notfallzulassung (EUA = „Emergency Use Authorization“) in Großbritannien durch die britische Arzneimittelbehörde („Medicines and Healthcare products Regulatory Agency“ = MHRA) am 2.12.2020 folgten nur wenige Tage später Notfallzulassungen der kanadischen Arzneimittelbehörde (Health Canada) am 9.12.2020 und der US-amerikanischen Arzneimittelbehörde („Food and Drug Administration“ = FDA) am 11.12.2020. An der Praxis der Notfallzulassungen von Impfstoffen und Arzneimitteln gegen SARS-CoV-2 durch die FDA wurde kürzlich in einem Bericht des „US Government Accountability Office“ deutliche Kritik geübt und mehr Transparenz hinsichtlich der Daten zu Wirksamkeit und Sicherheit gefordert (1).
Am 21.12.2020 empfahl dann der Ausschuss für Humanarzneimittel („Committee for Medicinal Products for Human Use“ = CHMP) der Europäischen Arzneimittel-Agentur (EMA) eine bedingte Zulassung für BNT162b2, die noch am selben Tag von der Europäischen Kommission (EC) erteilt wurde.
Notfallzulassungen sind im Recht der Europäischen Union (EU) nicht eindeutig geregelt; es handelt sich hierbei nicht um die Zulassung eines Impfstoffs, sondern nur um die Ausnahme von der Zulassungspflicht in einer bestimmten Notsituation (z.B. COVID-19). Zudem bedeutet dies in Europa für den Mitgliedsstaat, der eine Notfallzulassung ausgesprochen hat, dass er den pharmazeutischen Hersteller – anders als bei der bedingten Zulassung – aus der administrativen und zivilrechtlichen Haftung ausschließt. Aus Sicht von Experten im europäischen Pharmarecht dürften biotechnologisch hergestellte Arzneimittel, wie beispielsweise der Impfstoff BNT162b2, ausschließlich durch die EC zugelassen werden. Demgegenüber wird eine bedingte Zulassung entsprechend der Verordnung EG Nr. 507/2006 erteilt für Arzneimittel/Impfstoffe mit noch unvollständigen klinischen Daten, die beispielsweise in Krisensituationen gegen die Bedrohung der öffentlichen Gesundheit eingesetzt werden sollen (2). Voraussetzung ist u.a., dass ein positives Nutzen-Risiko-Verhältnis nachgewiesen wurde und umfangreiche Daten zu Wirksamkeit und Sicherheit später nach der Zulassung eingereicht werden. Bedingte Zulassungen sind verbunden mit spezifischen Auflagen für Zulassungsinhaber, zunächst ein Jahr gültig und dann jährlich verlängerbar. Bei Vorliegen umfangreicher Daten zum Nutzen-Risiko-Verhältnis kann eine Umstellung auf eine Standardzulassung erfolgen (3).
BNT162b2 ist bereits (Stand 31.12.2020) in mehr als 45 Ländern zumindest eingeschränkt zugelassen worden. Vorgeschlagener internationaler Freiname für BNT162b2 ist Tozinameran und der Handelsname in den Staaten des Europäischen Wirtschaftsraums sowie in der Schweiz Comirnaty® (4).
Beschreibung: BNT162b2 wird vertrieben in einer Mehrfachdosis-Durchstechflasche, deren Inhalt vor der Anwendung verdünnt werden muss. Das Mehrdosenbehältnis (0,45 ml) enthält 6 Dosen à 0,3 ml, wobei nach dem Verdünnen mit 1,8 ml Natriumchlorid-Injektionslösung eine Dosis 30 µg BNT162b2-RNA (eingebettet in Lipid-Nanopartikel = LNP) enthält. Die hoch aufgereinigte einzelsträngige “5′-capped messenger-RNA“ (mRNA) wurde durch zellfreie in-vitro-Transkription von den entsprechenden DNA-Matrizen hergestellt und codiert für das virale Spike-Glykoprotein von SARS-CoV-2.
Der Inhalt der tiefgefrorenen Durchstechflaschen wird nach dem Auftauen auf 2°C bis 8°C intramuskulär in den Deltamuskel des Oberarms in zwei Dosen mit jeweils 0,3 ml im Abstand von mindestens 21 Tagen injiziert. Personen, die eine Dosis des Impfstoffs BNT162b2 erhalten haben, sollen auch eine zweite gleiche Dosis – nicht später als 42 Tage nach der ersten Dosis – erhalten, um die Impfserie mit dem gleichen Produkt abzuschließen. Der Impfstoff darf nicht intravaskulär, subkutan oder intradermal injiziert werden (5, 6).
Als Zusatzstoffe enthält BNT162b2 u.a. [ALC-0315 (4-Hydroxybutyl)azandiyl]bis(hexan-6,1-diyl)bis(2-hexyldecanoat), ALC-0159 (2-[(Polyethylenglykol)-2000]-N,N-ditetradecylacetamid), Colfoscerilstearat (DSPC) und Cholesterin. Um die Rückverfolgbarkeit von Impfstoffen als biologische Arzneimittel zu verbessern, sollten der Name und die Chargennummer des verabreichten BNT162b2 unbedingt dokumentiert werden. Etwa 7 Tage nach der 2. Impfung ist ein ausreichender Impfschutz vorhanden. BNT162b2 kann im Ultra-Tieftemperatur-Gefrierschrank maximal 6 Monate, im Thermoversandbehälter maximal 15 Tage und im Kühlschrank (2-8°C) maximal 120 Stunden gelagert werden (7).
Studienübersicht: Die folgenden Aussagen zur Wirksamkeit und Sicherheit von BNT162b2 basieren auf Zwischenanalysen der für die Zulassung des Impfstoffs relevanten („pivotal“) klinischen Studie der Phase II/III mit 2 primären Endpunkten hinsichtlich Sicherheit und Wirksamkeit der Impfung (8). Verglichen wurden Wirksamkeit und Sicherheit von zwei Impfungen (jeweils 30 µg BNT162b2 im Abstand von 21 Tagen) mit Plazebo (Kochsalzlösung). Das Design dieser klinischen Studie war nicht ausgerichtet auf die Bewertung der Wirksamkeit einer nur einmaligen Impfung mit BNT162b2. Über die Ergebnisse zur Immunität nach zweimaliger Impfung wurde in einer separaten Publikation (s. unten) berichtet.
Für die Zwischenanalyse zur Sicherheit von BNT162b2 wurden alle Teilnehmer(innen) der Studie berücksichtigt, die wenigstens eine Dosis des Impfstoffs oder Plazebos erhalten hatten. Für die Zwischenanalyse des primären Wirksamkeitsendpunkts war erforderlich, dass keine Hinweise für eine Infektion mit SARS-CoV-2 innerhalb von 7 Tagen nach der 2. Impfung und keine wesentlichen Abweichungen vom Studienprotokoll vorlagen.
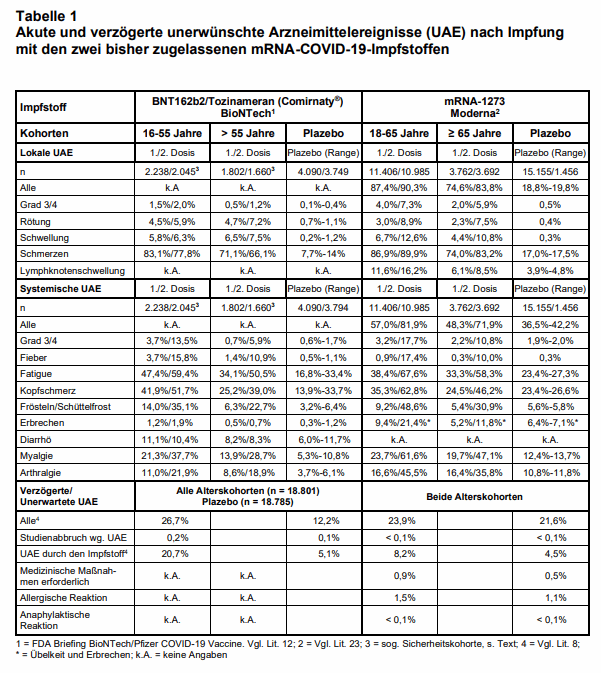
Sicherheit: Als erste primäre Sicherheitsendpunkte galten: spezifische lokale oder systemische UAE und/oder die Einnahme von antipyretisch oder analgetisch wirkenden Arzneimitteln innerhalb von 7 Tagen nach Injektion der 1. oder 2. Dosis oder Plazebo. Eine Subgruppe der Teilnehmer(innen) wurde aufgefordert, die „Unexpected Adverse Events“ (UAE) in einem elektronischen Tagebuch („Reaktogenität-Subgruppe“) zu notieren. Sowohl die nach Aufforderung in einem elektronischen Tagebuch notierten als auch andere UAE sollten bis zu einem Monat nach der 2. Dosis und weitere schwere unerwünschte Ereignisse bis zu 6 Monate nach der 2. Impfung erfasst werden. Insgesamt wurden zwischen 27. Juli 2020 und 14. November 2020 43.548 Personen im Alter von 16 Jahren oder älter an insgesamt 152 Orten weltweit randomisiert, darunter 130 Orte in den USA und 6 in Deutschland. Injektionen des Impfstoffs oder Plazebos erhielten insgesamt 43.448.
Am Stichtag der Auswertung (9. Oktober 2020) hatten 37.706 Studienteilnehmer(innen) den Median von wenigstens 2 Monaten nach der 2. Impfung erreicht und konnten hinsichtlich der Sicherheit ausgewertet werden. Von diesen waren 35% adipös (Body-Mass-Index = BMI von wenigstens 30,0 kg/m2), und 21% hatten eine Komorbidität, z.B. eine chronische Lungenerkrankung, Diabetes mellitus oder Krebs. Das mittlere Alter der Studienteilnehmer(innen) betrug 52 Jahre, und 42% waren älter als 55 Jahre. Die „Reaktogenität-Subgruppe“ umfasste 8.183 Studienteilnehmer(innen). Genaue Angaben zur lokalen und systemischen Reaktogenität sowie weiteren unerwünschten Ereignissen finden sich in Tab. 1.
In der Gruppe der mit BNT162b2 geimpften Studienteilnehmer(innen) traten 4 schwere UAE auf: Verletzung an der geimpften Schulter, axilläre Lymphadenopathie rechts, paroxysmale ventrikuläre Tachyarrhythmie und Parästhesien am rechten Bein. Zwei der mit BNT162b2 Geimpften und 4 in der Plazebogruppe starben, wobei nach Einschätzung der Prüfärzte kein Zusammenhang mit der Impfung bzw. Plazebo gesehen wurde. Todesfälle infolge von COVID-19 traten im beobachteten Zeitraum nicht auf. Eine Nachbeobachtung der Sicherheit soll für 2 Jahre nach der 2. Impfung mit BNT162b2 erfolgen.
Wirksamkeit: Der erste primäre Wirksamkeitsendpunkt war die Wirksamkeit von BNT162b2 gegen eine bestätigte Erkrankung nach SARS-CoV-2-Infektion (COVID-19), die wenigstens 7 Tage nach der 2. Impfung begonnen hatte. Der zweite primäre Endpunkt war die Wirksamkeit der Impfung bei Probanden mit oder ohne Hinweis für eine vorausgegangene Infektion mit SARS-CoV-2. Die Bestätigung von COVID-19 basierte auf den Kriterien der FDA mit Nachweis von mindestens einem der folgenden Symptome: Fieber sowie neu aufgetretene oder Zunahme folgender Symptome: Husten, Atemnot, Muskelschmerzen, neu aufgetretener Verlust des Geschmacks- oder Geruchssinns, Diarrhö oder Erbrechen, Halsschmerzen. Bei einem oder mehreren dieser Symptome musste gleichzeitig (oder 4 Tage zuvor bzw. 4 Tage danach) in einer Probe aus dem Atemwegstrakt mittels Polymerase-Kettenreaktion (PCR) SARS-CoV-2 nachgewiesen worden sein. Wichtige sekundäre Endpunkte waren u.a. die Wirksamkeit von BNT162b2 hinsichtlich der Vermeidung eines schweren Verlaufs von COVID-19 (entsprechend der Kriterien der FDA; 9).
Unter den 36.523 Studienteilnehmer(inne)n ohne Hinweis für eine existierende oder vorausgegangene Infektion mit SARS-CoV-2 wurde COVID-19 bei 8 Personen nach Impfung mit BNT162b2 innerhalb von wenigsten 7 Tagen nach der 2. Impfung diagnostiziert und bei 162 Personen nach Injektion von Plazebo. Dies entspricht einer Wirksamkeit des Impfstoffs von 95%.
Die statistische Aussagekraft von Subgruppenanalysen – z.B. entsprechend Alter, Geschlecht, Rasse, Ethnie, Vorhandensein von Adipositas und bestehenden Komorbiditäten – war aufgrund der Fallzahlen begrenzt, ergab jedoch bisher keinen Anhalt für relevante Unterschiede in der Wirksamkeit der Impfung (10). Auch bei separat ausgewerteten Personen mit arterieller Hypertonie fanden sich keine Unterschiede in der Wirksamkeit. Zwischen der 1. und 2. Impfung wurden 39 COVID-19-Erkrankungen oder schwere COVID-19-Erkrankungen in der geimpften Gruppe und 82 in der Plazebogruppe beobachtet. Dies entspricht einer Wirksamkeit der Impfung von 52% während dieses Zeitintervalls und deutet darauf hin, dass ein gewisser Impfschutz bereits 12 Tage nach der ersten Dosis besteht.
In der Diskussion weisen die Autoren auf die eingeschränkte Aussagekraft dieser Zwischenanalysen hin (8). Hierzu zählen – basierend auf der Auswertung von jeweils etwa 19.000 Studienteilnehmer(inne)n in jeder Gruppe und einer medianen Nachbeobachtung von 2 Monaten nach der 2. Impfung – eine geringe Wahrscheinlichkeit, UAE zu entdecken, die mit einer Inzidenz von weniger als 0,01% oder später als 2-3,5 Monate nach der 2. Impfung auftreten. Aufgrund der Unterschiede in der Wirksamkeit der Impfung mit BNT162b2 halten es die Autoren vor allem aus ethischer Sicht und praktischen Gründen für unwahrscheinlich, dass die Teilnehmer(innen) in der Plazebogruppe für 2 Jahre nachverfolgt werden können. Sie werden deshalb vermutlich nicht als Kontrollgruppe zur Beurteilung der Sicherheit der Impfung mit BNT162b2 herangezogen werden können. Weitere Fragen, die anhand dieser Zwischenanalysen nicht beantwortet werden können, betreffen die Verhinderung einer asymptomatischen Infektion durch die Impfung, die Wirksamkeit des Impfstoffs bei nicht eingeschlossenen bzw. explizit ausgeschlossenen Personengruppen wie Kinder/Jugendliche < 16 Jahre, Schwangere sowie immunsupprimierte bzw. mit Immunsuppressiva behandelte Personen.
Bei der Interpretation der Ergebnisse der Phase-III-Studie zur Wirksamkeit von BNT162b2 muss zusätzlich ein potenzieller Detektionsbias (vgl. 11) berücksichtigt werden. Dem Mitherausgeber des BMJ, Peter Doshi, ist im FDA-Bericht (12) zu BNT162b2 aufgefallen, dass es insgesamt 3.410 vermutete, aber unbestätigte COVID-19-Erkrankte gab, und zwar 1.594 in der BNT162b2-Gruppe und 1.816 in der Plazebogruppe. Aus seiner (und auch unserer) Sicht könnte es sein, dass die mit BNT162b2 Geimpften Fieber und/oder Muskelschmerzen seltener gemeldet haben, weil sie von ihnen als UAE der Impfung und nicht als Symptome von COVID-19 erachtet wurden. Für diese Vermutung spricht auch, dass sie häufiger Antipyretika eingenommen haben (13).
Immunogenität: Detaillierte Ergebnisse zur Immunogenität von BNT162b2 hinsichtlich Bildung von neutralisierenden Antikörpern wurden zunächst aus einer Phase-I/II-Studie mit BNT162b1 bei 45 gesunden Erwachsenen im Alter von 18-55 Jahren mitgeteilt (14, 15). In dieser plazebokontrollierten, verblindeten Studie wurden drei unterschiedliche Dosierungen von BNT162b1 verglichen (10 µg, 30 µg und 100 µg), die laut Protokoll jeweils an Tag 1 und Tag 21 verabreicht werden sollten. Gezeigt werden konnte, dass die Konzentrationen des gegen die Rezeptor-Bindungsdomäne des Spike-Glykoproteins gerichteten Immunglobulins G (IgG) ebenso wie die Titer der neutralisierenden Antikörper in Abhängigkeit von der Dosierung von BNT162b1 sowie auch nach der 2. Impfung anstiegen. Sie lagen deutlich über den Konzentrationen des IgG in Seren von rekonvaleszenten Personen nach COVID-19. Wegen deutlich erhöhter Reaktogenität und nicht stärkerer Immunogenität wurde jedoch die 2. Dosis mit 100 µg nicht verabreicht.
In einer weiteren Phase-I/II-Studie zur Immunogenität von BNT162b1, deren Ergebnisse auch in Nature publiziert wurden, fanden sich bei gesunden Erwachsenen im Alter von 18-55 Jahren (medianes Alter: 37 Jahre) ebenfalls deutlich erhöhte Titer neutralisierender Antikörper nach unterschiedlichen Dosierungen (1-50 µg) von BNT162b1 (16). Die Konzentrationen neutralisierender IgG-Antikörper gegen das Spike-Glykoprotein lagen an Tag 43 nach Impfung dosisabhängig um 0,7-fach (1 µg) bis zu 3,5-fach (50 µg) über denjenigen von COVID-19-rekonvaleszenten Personen. Gleichzeitig wurde nachgewiesen, dass die Immunseren auch diverse Pseudoviren mit Varianten des SARS-CoV-2-Spike-Glykoproteins neutralisierten. Außerdem konnten gegen das Spike-Glykoprotein gerichtete, spezifische, expandierte CD8+ und T-Helfer-Typ 1 (TH1) CD4+ Lymphozyten mit einem hohen Anteil an Interferon-gamma produzierenden Zellen nachgewiesen werden. Die Autoren gehen deshalb davon aus, dass der BNT162b1-Impfstoff über unterschiedliche Mechanismen – sowohl humorale als auch zelluläre Immunantwort – gegen COVID-19 schützt (15). Gleichzeitig betonen die Autoren jedoch die begrenzte Aussagekraft dieser klinischen Studie, vor allem wegen der geringen Fallzahl mit überwiegend jüngeren Personen, aber auch der noch unbekannten Dauer der protektiven Immunität und der nicht durchgeführten detaillierten T-Zell-Analysen, z.B. hinsichtlich Induktion von T-Gedächtniszellen (16).
Eine weitere, plazebokontrollierte und verblindete Phase-I-Studie in den USA untersuchte Immunogenität und Sicherheit der beiden mRNA Impfstoffe (BNT162b1 und BNT 162b2) bei insgesamt 195 gesunden Erwachsenen im Alter von 18-55 Jahren bzw. 65-85 Jahren (17). In insgesamt 13 Gruppen erhielten 12 Teilnehmer(innen) jeweils den Impfstoff und 3 Plazebo. Auch diese Studie ergab sowohl bei jüngeren als auch bei älteren Personen dosisabhängige SARS-CoV-2 neutralisierende Antikörpertiter, die höher waren als in den Seren nach SARS-CoV-2-Infektion. Aufgrund der kleinen Fallzahl erlaubte diese Studie jedoch keine statistisch aussagekräftigen Vergleiche.
Impfstoff mRNA-1273 (Moderna Covid-19 Vaccine®)
Zulassung: Seit 18.12.2020 existiert in den USA und seit 23.12.20 in Kanada eine Notfallzulassung, und am 6.1.2021 hat das CHMP der EMA (s.o.) die Zulassung des Impfstoffs zur Prävention einer SARS-COV2-Erkrankung bei Menschen > 18 Jahre empfohlen (18).
Beschreibung: Laut „European Public Assessment Report“ (EPAR) der EMA (19) handelt es sich bei mRNA-1273 um eine konservierungsstofffreie, gefrorene Suspension zur intramuskulären Injektion. Der Impfstoff beinhaltet mRNA, die das geringfügig modifizierte SARS-CoV-2-Spike-Glykoprotein in voller Länge kodiert und die sich ebenfalls in einer LNP-Kapsel mit u.a. folgenden Bestandteilen befindet: SM-102, 1,2-Dimyristoyl-rac-glycero3-methoxypolyethylenglycol-2000 (PEG2000-DMG), Cholesterin, 1,2-Distearoyl-Sn-glycero-3-Phosphocholin (DSPC). Der Impfstoff wird als gefrorene Suspension in Mehrfachdosis-Durchstechflaschen mit 10 Dosen à 0,5 ml ausgeliefert. Die Lagerungstemperatur beträgt -25 bis -15°C. Unter diesen Bedingungen ist die ungeöffnete Flasche 7 Monate haltbar. Der Impfstoff muss vor der Impfung aufgetaut werden. Danach können die Flaschen bei 2-8°C bis zu 30 Tage vor der Anwendung gelagert werden, eine im Vergleich zu BNT162b2 deutlich geringere Anforderung an die Impflogistik. Ungeöffnete Flaschen können bis zu 12 Stunden bei Raumtemperatur gelagert werden, geöffnete Flaschen müssen nach 6 Stunden entsorgt werden. mRNA-1273 wird in zwei Dosen à 100 μg (je 0,5 ml) im Abstand von 28 Tagen intramuskulär verabreicht, bevorzugt wie BNT162b2 in den Deltamuskel. Es besteht eine Kontraindikation bei bekannten Allergien gegen die Inhaltsstoffe des Impfstoffpräparats. Chargennummer und Name des Geimpften müssen auch bei diesem Impfstoff nachvollziehbar dokumentiert werden.
Studienübersicht: Das Impfprogramm mit mRNA-1273 umfasst nach den Angaben auf clinicaltrials.gov bislang 4 Studien mit dem Akronym COVE (Stand 8.1.2021; 20). Die Ergebnisse von zwei dieser Studien wurden im N. Engl. J. Med. publiziert: eine offene Phase-I-Studie mit 120 Teilnehmer(inne)n zur Dosisfindung und Ermittlung der Reaktogenität und Immunogenität (21, 22) und eine randomisierte plazebokontrollierte Phase-III-Studie (23). Von Interesse ist außerdem eine laufende Phase-II/III-Studie mit 3.000 Heranwachsenden (12-18 Jahre; 24). In die Phase-III-Studie (23) wurden 30.420 Erwachsene ≥ 18 Jahre eingeschlossen. Das mittlere Alter betrug 51,4 Jahre (Spanne 18-95 Jahre), 24,8% waren bei der Erstimpfung ≥ 65 Jahre alt, 47,3% Frauen, 25,4% Mitarbeiter aus dem Gesundheitswesen. Bei 22,3% (n = 6.191) bestand mindestens eine, bei 4,2% mehrere Risiko-Komorbiditäten. Dazu zählten chronische Lungen- (n = 1.454) oder Herzerkrankungen (n = 1.496), Adipositas Grad 3 (BMI ≥ 40 kg/m2; n = 2.046), Diabetes mellitus (n = 2.875), chronische Lebererkrankung (n = 196), HIV-Infektion (n = 179).
Zu den Ausschlusskriterien zählten u.a. Personen mit akuten Erkrankungen, einer durchgemachten SARS-CoV-2-Infektion, Schwangere oder Stillende, bekannte oder vermutete Allergien gegen Bestandteile des Impfstoffs sowie eine Vorerkrankung mit Immundefizienz oder die Einnahme von Immunsuppressiva. Das COVE-Programm wird vom Hersteller ModernaTX Inc. sowie durch öffentliche Gelder aus den USA finanziert („Biomedical Advanced Research and Development Authority“ und „National Institute of Allergy and Infectious Diseases“; 25). Übrigens erhält auch der Hersteller von BNT162b2 BioNTech eine Förderung aus öffentlichen Mitteln, und zwar vom Bundesministerium für Bildung und Forschung (BMBF) für beschleunigte Impfstoffentwicklung und Ausbau der Produktionskapazitäten in Höhe von bis zu 375 Mio. €. (43).
Sicherheit: In die Phase-III-Studie wurden in den USA zwischen Juli und Oktober 2020 insgesamt 30.420 Teilnehmer(innen) eingeschlossen (23). Insgesamt 30.351 erhielten mindestens eine Dosis mit 100 μg mRNA-1273 oder Plazebo und bilden die Grundlage der Sicherheitsanalyse. Die Sicherheitsbewertungen basierten auf den berichteten lokalen und systemischen UAE innerhalb von 7 und 28 Tagen nach jeder Impfung. Die Symptome wurden mittels elektronischer Tagebücher erfasst. Zudem werden alle weiteren UAE bis zum Tag 759 registriert. Die Bewertung aller UAE erfolgte durch ein „Data Safety Monitoring Board“, dessen genaue Zusammensetzung wir nicht recherchieren konnten.
Lokale UAE an der Injektionsstelle traten nach mRNA-1273 bei 4 von 5 Geimpften auf und waren etwa viermal häufiger als nach Plazebo. Die Dauer der lokalen UAE betrug im Mittel 3,4 bzw. 4,3 Tage. Auffallend war, dass die Reaktogenität bei den älteren Geimpften etwas geringer war (s. Tab. 1).
Systemische UAE wurden nach der 1. Impfung mit mRNA-1273 von 55% und nach Plazebo von 42% berichtet; nach der 2. Impfung waren es 79% bzw. 36%. Die 2. Impfung war also reaktogener. Dabei handelte es sich in erster Linie um Fatigue, Kopfschmerzen, Myalgien, Arthralgien und Frösteln/Schüttelfrost. Schwere systemische UAE (Grad 3/4) traten nach der 1. Impfung mit mRNA-1273 bei 2,9% und nach der 2. bei 15,8% auf. Die Dauer der systemischen UAE betrug im Mittel 3,7 bzw. 4,6 Tage. Auffallend war auch hier, dass sie bei den älteren Geimpften etwas seltener auftraten (s. Tab. 1). UAE, die systematisch erfasst wurden und innerhalb von 28 Tagen (verzögerte Reaktionen) im Zusammenhang mit der Impfung auftraten, wurden bei 686 Personen nach Plazebo (4,5%) und bei 1.242 nach mRNA-1273 (8,2%) registriert. Es waren überwiegend Kopfschmerzen, Fatigue, Arthralgien und Myalgien. Nur bei wenigen Geimpften (< 0,1%) führten diese UAE zum Studienabbruch. Hypersensitivitätsreaktionen wurden von 166 Personen nach Plazebo (1,1%) und von 233 Personen nach mRNA-1273 (1,5%) berichtet. Bronchospasmen, Augen-, Lippen-, Zungen- oder Gesichtsschwellungen sowie Angioödeme waren selten: 16 Personen nach mRNA-1273, 7 nach Plazebo. In jeder Gruppe kam es zu einer anaphylaktischen Reaktion (23). Unklar bleibt, wieso die Injektion einer Salzlösung zu solch starken allergischen Reaktion führte.
Wirksamkeit: Der primäre Wirksamkeitsendpunkt war die Verhinderung einer erstmaligen symptomatischen COVID19-Erkrankung in der Kohorte der Per-Protokoll (PP)-Analyse, beginnend ab 14 Tagen nach der 2. Impfung (23). Die PP-Kohorte umfasste alle korrekt zweimal Geimpften, die bei Studienbeginn einen negativen PCR-Test hatten (n = 28.207; zum Zeitpunkt der Zwischenanalyse am 25.11.2020). Von der PP-Analyse wurden 2.144 der Erstgeimpften (7,3%) ausgeschlossen, entweder weil sie bei einem routinemäßigen PCR-Abstrich bei der 1. Impfung positiv waren (4,1%; 572 mit Plazebo und 631 mit Verum), weil sie die Studie nach der 1. Impfung abbrachen (1,3%; 231 mit Plazebo und 168 mit Verum) oder wegen einer Protokollverletzung (1,8%; 294 mit Plazebo und 248 mit Verum; meist wurden die Impfintervalle nicht eingehalten). Diese Unterschiede können vor dem Hintergrund von 196 primären Endpunktereignissen (s.u.) durchaus bedeutsam sein, werden aber von den Autoren nicht kommentiert. Alle Studienteilnehmer(innen) teilten ihre Symptome über ein elektronisches Tagebuch mit. Wenn vordefinierte Symptome einer COVID-19 Infektion auftraten (FDA-Kriterien, s.o.), erfolgte eine Visite mit PCR-Abstrich. Als COVID-19 wurde gezählt, wenn neben den Symptomen auch der PCR-Abstrich positiv war. Die Befunde wurden von einem unabhängigen, verblindeten „adjudication committee“ bewertet, dessen Zusammensetzung nicht recherchiert werden konnte.
In die primäre PP-Analyse gingen 196 Patienten mit COVID-19 ein: 11 aus der Verum- und 185 aus der Plazebogruppe. Hieraus wurde eine Impfeffektivität von 94,1% berechnet (95%-Konfidenzintervall: 89,3%-96,8%; p < 0,001). Die mediane Nachbeobachtungszeit betrug 64 Tage. Somit ergibt sich über 2 Monate und nach 2 korrekten Impfungen eine absolute Risikoreduktion von 1,23% (0,077% vs. 1,314%). Als schwer bewertet wurden 30 Erkrankungen, wovon eine tödlich endete. Die schweren Verläufe traten alle in der Plazebogruppe auf. Die Subgruppenanalyse ergab in allen untersuchten Subgruppen eine Impfeffektivität > 85%. Sie scheint jedoch mit dem Alter etwas abzunehmen: Der Wert liegt in der Altersgruppe 18-65 Jahre bei 95,6% und bei den ≥ 65-Jährigen bei 86,4%. Nach der „Intention-to-treat“-Analyse errechnete sich bei denen, die zum Zeitpunkt der Zwischenanalyse erst eine Impfdosis erhalten hatten, nach einer medianen Nachbeobachtungszeit von 28 Tagen eine Impfeffektivität von 80,2%.
Ein routinemäßig durchgeführter Abstrich aus dem Nasenrachenraum zum Zeitpunkt der 2. Impfung ergab, dass in der Plazebogruppe 39 und in der Verumgruppe 15 Personen PCR-positiv waren für SARS-CoV-2 (0,3 vs. 0,1%). Ob dies ein Hinweis darauf ist, dass die Impfung auch einen gewissen Schutz vor der Transmission bietet, muss weiter untersucht werden.
Immunogenität (21, 22): In der Phase-I-Studie wurde die Bildung von Antikörpern von drei mRNA-Dosierungen geprüft (25, 200 und 250 μg). Mittels „Enzyme-linked Immunosorbent Assay“ (ELISA) wurden nach 29 und 57 Tagen – in Abhängigkeit von der Dosis – steigende bindende Antikörper (bAK) gegen das Spike-Glykoprotein nachgewiesen. Die AK-Titer nach 100 und 250 μg lagen im Bereich wie die in Rekonvaleszenten-Seren. Neutralisierende Antikörper (nAK) wurden nach der 1. Impfung bei < 50% der Geimpften nachgewiesen, nach der 2. Impfung bei 100%, mit einer Dosis-Titer-Beziehung. Eine zelluläre Antwort (CD4-T-Zellen) war nach 1. Impfung mit der 100 μg-Dosis nachweisbar: Nach Stimulation durch das Spike-Glykoprotein kam es zu einer starken Expression von Th1-Zytokinen (Tumornekrosefaktor alpha > Interleukin 2 > Interferon gamma). Nach der 2. Impfung kam es auch zu einer CD8-T-Zell-Antwort auf niedrigem Niveau. Aufgrund dieser Ergebnisse wurde die zweimalige Gabe der 100 μg-Dosis für die Phase-III-Studie ausgewählt.
Drei Monate nach der 2. Impfung wurden bei 34 Teilnehmer(inne)n erneut Antikörpertiter bestimmt. Dabei zeigte sich, dass diese zwar gesunken waren, aber weiter über denen in Seren von Rekonvaleszenten lagen. Dies interpretieren die Autoren als Hinweis auf eine länger anhaltende humorale Immunität (22). Eine separate Studie zur Immunogenität mit 40 Älteren, 20 davon ≥ 71 Jahre, zeigte zeit- und dosisabhängig steigende Titer von bAK und nAK, die im Bereich derer von jüngeren Geimpften lagen (26).
Beurteilung der beiden mRNA-Impfstoffe: Für beide mRNA-Impfstoffe konnte nachgewiesen werden, dass sie bei den untersuchten Personengruppen über einen Zeitraum von 2-3 Monaten symptomatische SARS-CoV-2-Infektionen (COVID-19) und schwere Verläufe dieser Erkrankung verhindern können. Das gilt auch für ältere Menschen, obwohl ihre Immunantwort zellulär und humoral schwächer ist (Immunoseneszenz; 15, 27). Allerdings ist die Zahl der Personen in der Altersgruppe ≥ 75 Jahre in den o.g. für die Zulassung relevanten Phase-III-Studien mit 1.559 Teilnehmer(innen) in der Studie zu BNT 162b2 bzw. 1.318 in der Studie zu mRNA-1273 deutlich kleiner als in den Altersgruppen 18 bis < 75 Jahre. Deshalb ist auch die Aussagekraft hinsichtlich Verhinderung von COVID-19 schwächer. Interessant wird sein, ob der Impfschutz gegen das SARS-CoV-2 ähnlich lange anhält, wie bei den Jüngeren, ob andere zur Impfstoffentwicklung genutzte Technologien eine ähnlich starke und anhaltende Immunität erzeugen wie die mRNA-Technologie oder ob für ältere Menschen doch eine individualisierte SARS-CoV-2-Impfstrategie erforderlich ist (28).
Einige wichtige Personengruppen wurden in den Studien nicht oder nur unzureichend untersucht, z.B. Immunsupprimierte, Schwangere und Jugendliche. Die Ergebnisse dürfen also nicht ohne weiteres auf diese übertragen werden. Diese Gruppen sollten nach Möglichkeit künftig in kontrollierten Studien oder zumindest mittels Registerstudien gründlich untersucht werden. Auch sollten die genannten relativen Zahlen zur Wirksamkeit der Impfstoffe (95% bzw. 94,1%) als vorläufig betrachtet werden. Da der Impfschutz nicht vollständig ist, die Nachbeobachtungszeit erst wenige Wochen beträgt und die Antikörperspiegel mit der Zeit sinken, dürfte die Wirksamkeit mit der Zeit sinken. Außerdem basieren diese Berechnungen auf wenigen COVID-19-Fällen, und das Erkennen von Erkrankten nach SARS-CoV-2-Infektion in den Studien erscheint störanfällig. Zudem wurden ungleich viele Personen in der Verum- und Plazebogruppe von der PP-Analyse ausgeschlossen (Studie zu mRNA-1273).
Wichtige unbeantwortete Fragen hinsichtlich der Impfeffektivität sind derzeit: Werden auch asymptomatische Infektionen verhindert? Wird eine sterile Immunität erreicht, d.h. wird verhindert, dass Geimpfte SARS-CoV-2 übertragen können? Wenn ja wäre dies ein sehr wichtiger Beitrag zur Eindämmung der Pandemie, d.h. zur Unterbrechung der Infektionsketten. Wie gut schützen die Impfstoffe bei neuen Virusvarianten?
Die Verträglichkeit beider Impfstoffe kann im Vergleich zu anderen Impfstoffen insgesamt als mäßig eingestuft werden. Bei bis zu zwei Dritteln der Geimpften traten in der Woche nach der kompletten Impfung systemische UAE (Fatigue, Kopfschmerzen, Gliederschmerzen) auf – nach der 2. Impfung häufiger als nach der 1. und bei Jüngeren häufiger als bei Älteren. Allerdings gaben auch bis zu 42% in der Plazebogruppe solche UAE an (23). Diese UAE sind also nicht immer Ausdruck einer starken Immunantwort. Besondere Aufmerksamkeit sollten schwere UAE bei älteren (≥ 80 Jahre) gebrechlichen Personen („Frailty-Syndrom“) mit relevanten Begleiterkrankungen erhalten und Todesfälle nach der Impfung gründlich analysiert werden (vgl. 44) – auch um die Priorisierung von Personengruppen in Impfempfehlungen rasch zu ändern.
Noch weitgehend unklar ist die Häufigkeit und Bedeutung der verzögert auftretenden und späten UAE. Daher sollten derzeit pauschale und nicht evidenzbasierte Aussagen, die Impfstoffe seien ausreichend geprüft und sicher, unterbleiben. Bislang (15.1.2021) wurden bei den CDC nach knapp 12 Millionen Impfungen insgesamt 6.740 Einzelfallberichte über späte UAE (5.660 zu BNT162b2 und 1.080 zu mRNA-1273) gemeldet, darunter 63 anaphylaktische Reaktionen (29).
Zum Problem Allergien (30, 31): Die Inzidenz einer anaphylaktischen Reaktion nach einer Impfung wird mit 1 auf 1 Million Impfungen angegeben. Derzeit wird davon ausgegangen, dass die beiden mRNA-Impfstoffe gegen COVID-19 10mal häufiger Allergien auslösen als etablierte Impfstoffe (32). Es wird vermutet, dass dies durch LNP und/oder PEG in der Hülle der mRNA verursacht wird. PEG wird in unterschiedlichen Mengen in der Kosmetik und Pharmazie als Wirkstoffträger verwendet (Gelatinekapseln, Suppositorien, Salbengrundlage, Deodorants etc.). Allergische Reaktionen auf PEG werden nach Einschätzung mehrerer allergologischer Fachgesellschaften zu selten diagnostiziert (33). Sie empfehlen deshalb u.a., bekannte allergische Reaktionen auf Zusatzstoffe, insbesondere PEG, vor der Impfung mit einem der beiden Impfstoffe systematisch abzufragen und in Verdachtsfällen zunächst allergologisch abzuklären (Haut-Pricktest, Labordiagnostik; 33).
In den klinischen Studien mit den mRNA-Vakzinen wurden Personen mit bekannten Allergien gegen einen der Inhaltsstoffe ausgeschlossen. BioNTech/Pfizer schloss zudem alle Personen mit bekannten schweren allergischen Reaktionen nach irgendeiner Impfung aus. In der Phase-III-Studie mit BNT162b2 findet sich keine Angabe zu anaphylaktischen Schocks, und in der Studie mit mRNA-1273 jeweils ein Fall in beiden Gruppen, also auch nach Plazebo. Näheres wird nicht mitgeteilt. Am 6.1.2021 berichteten die CDC über insgesamt 21 gemeldete Fälle von Anaphylaxie nach der 1. Impfung von 1,9 Millionen Personen mit BNT162b2 (30). Interessanterweise waren 90% Frauen. Die Anaphylaxie-Inzidenz wird mit 11 pro 1 Million Impfungen angegeben. Innerhalb von 30 Minuten nach der Impfung traten 86% dieser Reaktionen auf. Eine Allergie in der Vorgeschichte (Wespen-/Bienenstiche, Katzen-/Hundehaare, Lebens-/Arzneimittel) hatten 17 Betroffene. Mit Adrenalin behandelt wurden 19 der 21 Personen, 17 wurden in eine Notaufnahme überwiesen, und keiner ist gestorben.
Das Paul-Ehrlich-Institut (PEI) sieht nach derzeitiger Datenlage (Stand 29.12.2020) bei Personen mit vorbekannten allergischen Erkrankungen kein generell erhöhtes Risiko für schwerwiegende UAE bei einer Impfung mit BNT162b2 (31). Bei bekannter Allergie oder Anaphylaxie müssen nach der Impfung Überwachung (mindestens 15 Minuten) und Notfallbehandlung gewährleistet sein. Ist nach der 1. Impfung eine anaphylaktische Reaktion aufgetreten, soll keine 2. Impfung erfolgen (7).
Pharmakovigilanz: Grundsätzlich sind klinische Studien der Phasen I-III nur begrenzt geeignet, um sehr seltene UAE, Langzeitrisiken, Risiken in gefährdeten Bevölkerungsgruppen oder Wechselwirkungen mit anderen Arzneimitteln/Impfstoffen zu erkennen. Zudem sind BNT162b2 und mRNA-1273 Produkte neuartiger Impfstoffplattformen mit limitierter Erfahrung gegenüber bereits zugelassenen vergleichbaren Impfstoffen. Aufgrund der kurzen Nachbeobachtung beider Impfstoffe in den o.g. klinischen Studien und deshalb weitgehend fehlender Erkenntnisse zu verzögert auftretenden UAE bzw. Langzeitsicherheit ist deshalb die Überwachung der Sicherheit nach Zulassung von besonderer Bedeutung.
Zu den im Rahmen der Pharmakovigilanz durchgeführten Routineaktivitäten für Impfstoffe gegen SARS-CoV-2 zählen die Meldung von UAE nach Impfungen durch Gesundheitsberufe sowie der Bevölkerung (betroffene Personen), die durch Arzneimittelgesetz und Infektionsschutzgesetz (IfSG) geregelt sind. Auch Verdachtsfälle von UAE im Zusammenhang mit den Impfstoffen sollen an die zuständigen Institutionen gemeldet werden. Dabei sind Meldungen besonders wichtig zu solchen UAE, die nicht in der Produktinformation aufgeführt sind (insbesondere schwerwiegende) sowie UAE, die schwerwiegend sind, auch wenn sie in der Produktinformation aufgeführt sind. Alle derartigen UAE sollten gemeldet werden, auch wenn „nur“ der Verdacht eines Zusammenhangs zwischen aufgetretenem Symptom und der Impfung besteht. Nicht gemeldet werden sollten Erkrankungen/Symptome, denen offensichtlich eine andere Ursache als die Impfung zugrunde liegt.
Gemäß der ärztlichen Berufsordnung sind Ärzte in Deutschland bzw. Österreich verpflichtet, unerwünschte Wirkungen von Arzneimitteln (inkl. Impfstoffen) der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) bzw. dem österreichischen Bundesamt für Sicherheit im Gesundheitswesen (BASG) zu melden (34). Die AkdÄ in Deutschland leitet diese – bei Impfstoffen pseudonymisiert – an das Paul-Ehrlich-Institut (PEI) weiter. Alle nationalen Meldungen werden dann an Pharmakovigilanz-Datenbanken der EMA (EudraVigilance) und der Weltgesundheitsorganisation gesendet.
Neben dieser berufsrechtlichen Meldeverpflichtung besteht eine gesetzliche Meldeverpflichtung nach dem IfSG an das Gesundheitsamt für über das übliche Maß hinausgehende Reaktionen nach einer Impfung. Weitere detaillierte Informationen zur Sicherheit von Impfstoffen gegen SARS-CoV-2 finden sich auf der Homepage des PEI (35), der AkdÄ (36) und dem BASG (45), beim PEI und der AkdÄ jeweils mit externen Links zum Robert Koch-Institut (RKI) und zur EMA. Das PEI informiert auch regelmäßig und detailliert in Sicherheitsberichten über Nebenwirkungen und Impfkomplikationen nach Impfung zum Schutz vor COVID-19, zuletzt für den Zeitraum vom 27.12.2020 bis zum 10.1.2021 (37). Vom PEI sind auch Protokolle und Studien zur aktiven Überwachung der Impfstoffsicherheit geplant, u.a. eine Kohortenstudie, für die seit Ende 2020 eine Smartphone-App („SafeVac“) verfügbar ist, sowie retrospektive Studien auf Basis elektronischer Gesundheitsdaten der Gesetzlichen Krankenversicherung (35).
Kommunikation über die Impfung (34): Die sorgfältige Nachbeobachtung der UAE von Impfstoffen gegen SARS-CoV-2 sowie zeitnahe Informationen der Öffentlichkeit über neu aufgetretene UAE sind eine wesentliche Voraussetzung für das Vertrauen der Bevölkerung in die derzeit angelaufenen Impfprogramme. Daneben ist jedoch unverzichtbar, auch um die Impfmotivation und -bereitschaft zu steigern, dass eine gründliche, wissens- und evidenzbasierte Aufklärung über Nutzen und Risiken der derzeit verfügbaren Impfstoffe erfolgt und die Bevölkerung verständlich über Zweck und realistische Ziele dieser Impfung informiert wird. Dabei sollte auch größere Transparenz hinsichtlich derzeit noch offener Fragen zu den Impfstoffen hergestellt werden.
Verschiedene Publikationen haben sich in den letzten Wochen mit sinnvollen Kommunikationsstrategien beschäftigt, die das Ziel verfolgen, Merkmale der Impfstoffe (z.B. Wirksamkeit, UAE, Dauer der protektiven Immunität) und Zulassungsverfahren allgemeinverständlich mitzuteilen und dabei auch Unsicherheiten im Kenntnisstand nicht zu verschweigen (38, 39, 40). Dabei wurde deutlich, dass die Bevölkerung mit Unsicherheiten und einem sich rasch wandelnden Kenntnisstand durchaus umgehen kann. Transparenz hinsichtlich der noch offenen Fragen stärkt eher das Vertrauen in die Impfstoffe und kann dadurch die Impfbereitschaft fördern. Die vom Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen herausgegebenen Gesundheitsinformationen, aktuell zu den Impfstoffen von BioNTech/Pfizer bzw. Moderna, können diese Kommunikationsstrategie unterstützen (41, 42).
Literatur
- Rubin, R.: JAMA 2020, 324, 2475. Link zur Quelle
- Dtsch. Arztebl.: Link zur Quelle
- Ludwig, W.-D.: In: Schwabe, U., Ludwig, W.-D., Klauber, J. (Hrsg.): Arzneiverordnungs-Report 2019. Springer-Verlag Berlin, 2019. S. 31.
- https://de.wikipedia.org/wiki/BNT162b2 Link zur Quelle
- https://www.ema.europa.eu/en/documents/product-information/ comirnaty-epar-product-information_de.pdf Link zur Quelle
- https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2021/ Ausgaben/02_21.pdf?__blob=publicationFile Link zur Quelle
- https://www.ema.europa.eu/en/documents/product- information/comirnaty-epar-product- information_de.pdf Link zur Quelle
- Polack, F.P., et al.: N. Engl. J. Med. 2020, 383, 2603. Link zur Quelle
- https://www.fda.gov/media/139638/download Link zur Quelle
- Rubin, E.J., und Longo, D.L.: N. Engl. J. Med. 2020, 383, 2677. Link zur Quelle
- AMB 2017, 51, 64DB01. Link zur Quelle
- https://www.fda.gov/media/144245/download#page=42 Link zur Quelle
- Doshi, P.: Link zur Quelle
- Mulligan, M.J., et al.: Nature 2020, 586, 589. Link zur Quelle https://www.nature.com/articles/s41586-020-2639-4. Vgl. AMB 2020, 54, 85. Link zur Quelle
- Poland, G.A., et al.: Lancet 2020, 396, 1595. Link zur Quelle
- Sahin, U., et al.: Nature 2020, 586, 594. Link zur Quelle
- Walsh, E.E., et al.: N. Engl. J. Med. 2020, 383, 2439. Link zur Quelle
- https://www.ema.europa.eu/en/news/ ema-recommends-covid-19-vaccine-moderna- authorisation-eu Link zur Quelle
- https://www.ema.europa.eu/en/documents/product-information/ covid-19-vaccine-moderna-product- information_en.pdf Link zur Quelle
- Search of: mRNA-1273 – List Results – ClinicalTrials.gov
- Jackson, L.A., et al.: N. Engl. J. Med. 2020, 383, 1920. Link zur Quelle
- Widge, A.T., et al.: N. Engl. J. Med. 2020, 384, 80. Link zur Quelle
- Baden, L.R., et al. (COVE = COronaVirus Efficacy): N. Engl. J. Med. 2020, Dec. Link zur Quelle
- TEENCOVE = TEENCOronaVirus Efficacy: Link zur Quelle
- https://clinicaltrials.gov/ … Link zur Quelle
- Anderson, E.J., et al. (mRNA Study Group): N. Engl. J. Med. 2020, 383, 2427. Link zur Quelle
- Soiza, R.L., et al.: Age Ageing 2020, afaa274. Link zur Quelle
- Ciabattini, A., et al.: Semin. Immunopathol. 2020, 42, 619. Link zur Quelle
- https://wonder.cdc.gov/controller/datarequest/ … Link zur Quelle
- MMWR 2021, 70, 46. Link zur Quelle
- https://www.pei.de/DE/newsroom/positionen/ covid-19-impfstoffe/stellungnahme-allergiker.html Link zur Quelle
- Castells, M.C., und Phillips, E.: N. Engl. J. Med. 2020, Dec 30. Link zur Quelle
- Klimek, L., et al.: Link zur Quelle
- Dtsch. Arztebl 2020, 117, A2510. Link zur Quelle Vgl. auch AMB 2021, 55, 12DB01. Link zur Quelle
- https://www.pei.de/DE/service/faq/ faq-coronavirus-inhalt.html; jsessionid=1BC6E525512C6FEF3E76C091EE491D30 .intranet222 Link zur Quelle
- https://www.akdae.de/Arzneimittelsicherheit/ Weitere/Archiv/2020/20201223.html Link zur Quelle
- https://www.pei.de/SharedDocs/Downloads/ DE/newsroom/dossiers/sicherheitsberichte/sicherheitsbericht -27-12-bis-10-01-21.pdf?__blob=publicationFile&v=3 Link zur Quelle
- Bloom, B.R., et al.: N. Engl. J. Med. 2020, 383, 2202. Link zur Quelle
- Kreps, S., et al.: JAMA Netw. Open 2020, 3, e2025594. Link zur Quelle
- Wegwarth, O., et al.: JAMA Netw. Open 2020, 3, e2032335. Link zur Quelle
- https://www.gesundheitsinformation.de/ der-impfstoff-comirnaty-bnt162b2-biontech-pfizer-zur- impfung-gegen-corona.html Link zur Quelle
- https://www.gesundheitsinformation.de/ der-impfstoff-moderna-mrna-1273-moderna- biotech-zur-impfung-gegen-corona.html Link zur Quelle
- https://investors.biontech.de/de/ news-releases/news-release-details/ biontech-erhaelt-bmbf- foerderung-von-bis-zu-375-millionen-euro Link zur Quelle
- https://www.berliner-zeitung.de/ politik-gesellschaft/warnung-aus- norwegen-moegliche- nebenwirkungen-des-impfstoffs-li.133073 Link zur Quelle
- https://www.basg.gv.at/marktbeobachtung/ meldewesen/nebenwirkungen Link zur Quelle