Alle Leitlinien empfehlen übereinstimmend Statine als Mittel erster Wahl zur Senkung des Serumcholesterins, da für diese Substanzklasse, insbesondere in der kardiovaskulären Sekundärprävention, aus mehreren großen randomisierten kontrollierten Studien (RCT) eine hohe Wirksamkeit auf klinische Endpunkte nachgewiesen ist. Diese beruht neben der direkten Wirkung auf den Cholesterinspiegel auf verschiedenen anderen, „pleiotropen“ Effekten, wie z.B. antiproliferativen, antithrombotischen, immunmodulierenden und antioxidativen Eigenschaften. Sie sind dadurch zu erklären, dass die Hemmung der HMG-CoA-Reduktase durch Statine in einen „frühen“ Schritt in der Cholesterinsynthese eingreift und somit auch andere Synthesewege (Terpene) beeinflusst werden.
Demgegenüber senken Nicht-Statine (Ezetimib, PCSK9-Inhbitoren, Inclisiran, Bempedoinsäure; Fibrate; Niacin; Ionenaustauscher) zusätzlich oder als Alternative zu Statinen zwar teilweise sehr effizient den Cholesterinspiegel, ihre Wirksamkeit auf klinische Endpunkte ist jedoch wesentlich weniger überzeugend belegt [1]; sie gelten deshalb als Reservesubstanzen. Zwei viel diskutierte sowie von Leitlinien und Zulassungsbehörden uneinheitlich gewichtete Faktoren spielen eine zentrale Rolle in der Indikationsstellung für diese teils hochpreisigen Arzneimittel, nämlich 1. Serumcholesterin-Zielwerte („the lower the better“, „treat to target“) und 2. Statin-Intoleranz (SI). Sie ist im klinischen Alltag ein häufiges Phänomen und oft mit Therapieabbrüchen assoziiert, allerdings ist sie schwierig zu diagnostizieren und überlagert, z.B. durch Nozebo-Effekte, Komorbiditäten und Multimedikation. Wir haben zu dieser Thematik wiederholt berichtet ([2], [3]).
Eine einheitliche Definition der SI existiert nicht. Am häufigsten sind sogenannte „Statin-assoziierte Muskelsymptome“ (SAMS). Diese umfassen ein breites Spektrum von (häufigen) milden muskelkaterartigen Myalgien der Extremitäten über Myopathien (mit CK-Erhöhung) bis hin zu (sehr seltenen) Rhabdomyolysen. Außerdem gibt es eine Reihe seltenerer Nebenwirkungen, wie Bauchschmerzen, Übelkeit, Obstipation, Diarrhöe, Pruritus, Alopezie, Kopfschmerzen u.a., die ebenfalls zu einem Therapieabbruch führen können. Zur SI finden sich in der Literatur je nach angewandten Kriterien und je nach Studienpopulation und -design sehr unterschiedliche Angaben zur Häufigkeit (5-30% für SAMS; 1:10.000 für Rhabdomyolyse [4].
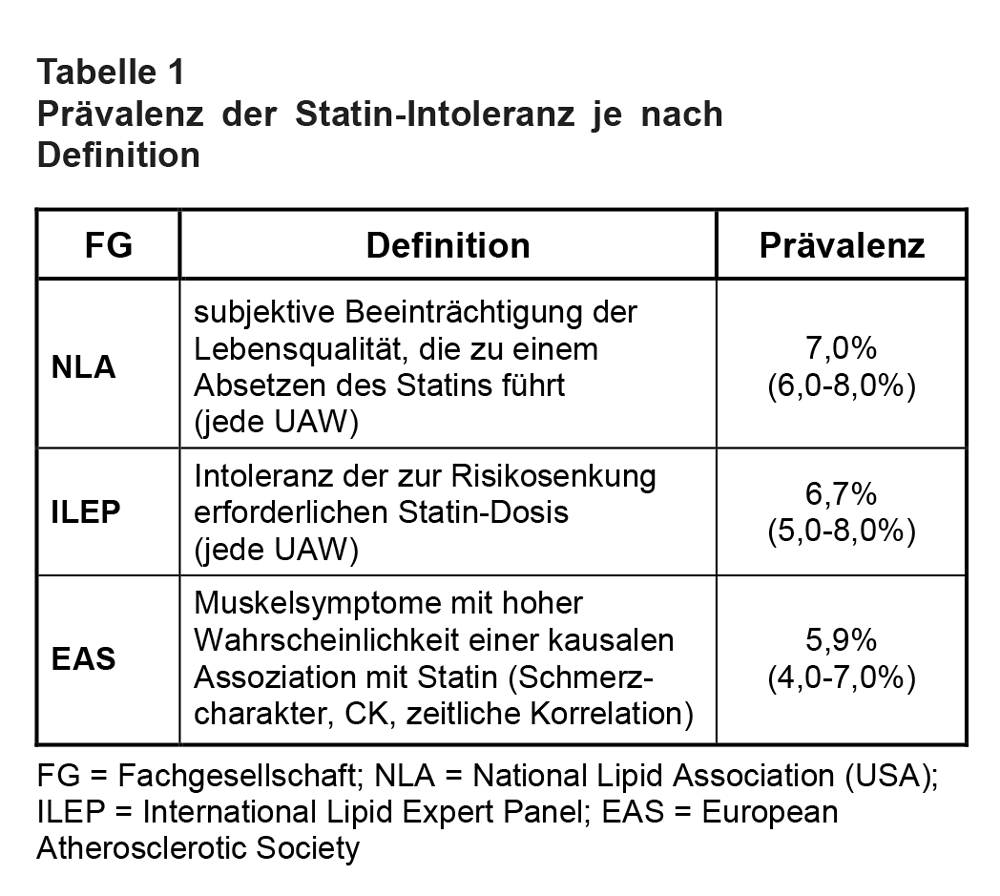
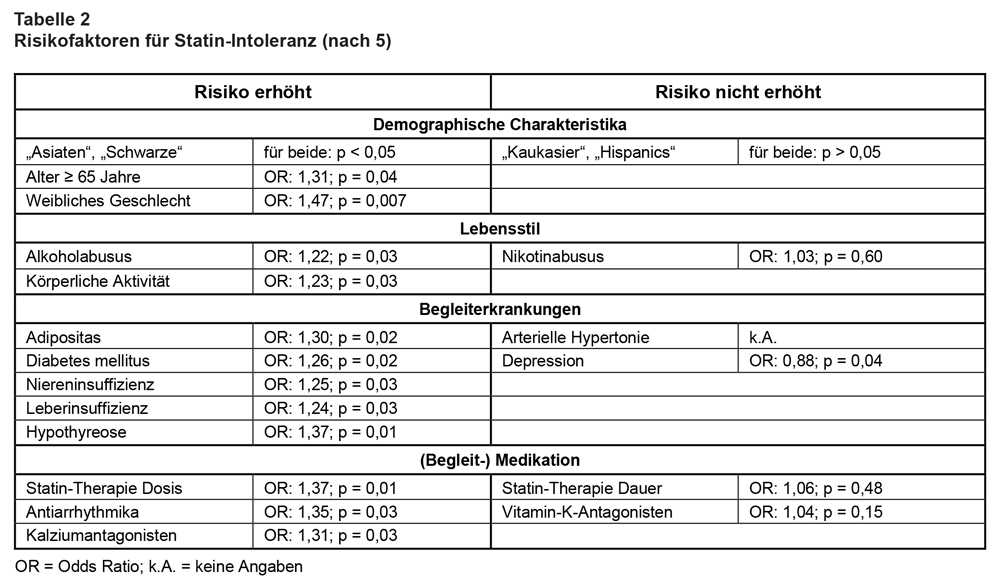
Im European Heart Journal ist aktuell eine große Metaanalyse zur Prävalenz der SI erschienen [5]. Sie schloss Studien aus den Bereichen Primär- und/oder Sekundärprävention ein, in denen eine SI-Prävalenz angegeben war (= primärer Endpunkt); die SI-Prävalenz wurde in Assoziation mit verschiedenen Patientencharakteristika und Risikofaktoren untersucht (= sekundärer Endpunkt). Es wurden letztlich 176 Studien (112 RCT und 64 Kohortenstudien) mit insgesamt 4.143.517 Probanden unter Statin-Therapie analysiert (mittlere Nachbeobachtung 19 ± 7,3 Monate). Die Metaanalyse ergab eine „weltweite“ SI-Gesamtprävalenz von 9,1% (95%-Konfidenzintervall: 8,0-10%). SI-Definitionen nach den Kriterien dreier unterschiedlicher Fachgesellschaften ergaben etwas geringere Prävalenzwerte ohne signifikante Unterschiede (s. Tab. 1). Lipophile Statine (Atorvastatin, Simvastatin, Lovastatin, Fluvastatin) unterschieden sich nicht von hydrophilen Statinen (Prava-statin, Rosuvastatin): SI-Prävalenz 4% vs. 5%; p = 0,33. In den Populationen von Kohortenstudien war die SI-Prävalenz signifikant höher als in RCT (17% vs. 4,9%), was die Autoren in der Diskussion auf weniger strenge Selektionskriterien bzw. Studiendesigns (z.B. „cross over“) außerhalb von RCT zurückführen; dies spiegle auch die Schwierigkeiten bei der Identifizierung von SI in der klinischen Praxis wider. Möglicherweise aus ähnlichen Gründen war die SI-Prävalenz deutlich höher in Studien, in denen sowohl die Primär- als auch die Sekundärprävention untersucht wurde (18%), als in Studien, die entweder nur die Primär- oder nur die Sekundärprävention behandelten (8,2% bzw. 9,1%). Eine Reihe von Risikofaktoren für SI wurde identifiziert (s. Tab. 2).
Als Einschränkung der Ergebnisse ihrer Metaanalyse führen die Autoren an, dass die untersuchten Studien recht heterogen sind und nicht alle Komorbiditäten und Risikofaktoren in gleicher Weise aufgeführt werden. Ein relevanter Nozebo-Effekt in den eingeschlossenen Studien könne nicht ausgeschlossen werden, sei aber wahrscheinlich gering.
Statine sind nach wie vor der Goldstandard zur Behandlung von Dyslipidämien und kardiovaskulären Krankheiten bzw. erhöhten kardiovaskulären Risiken. Unzureichende Adhärenz und Absetzen einer Statin-Therapie ist mit erhöhten kardiovaskulären Ereignisraten assoziiert, wie aus mehreren Studien bekannt ist (einschließlich Metaanalysen und Systematischen Reviews; z.B. [6]). Ausnahmen sind allenfalls sehr alte multimorbide Patienten, insbesondere in der Primärprävention [7]. Die Ergebnisse der vorliegenden großen Metaanalyse bestätigen einmal mehr, dass die SI-Prävalenz verhältnismäßig niedrig ist und im klinischen Alltag wohl häufig überschätzt wird. Da aber doch mit einer Häufigkeit von ca. 5-10% innerhalb von 1,5 Jahren unter Statin-Therapie damit zu rechnen ist, sollten alle Patienten bei Beginn einer Statin-Therapie darüber informiert werden, und Patienten mit vermuteter SI sollten kritisch und sorgfältig begutachtet werden (vgl. [3]). Letzteres gilt auch für die Publikationen zur SI-Prävalenz in der Fach- und Laienpresse, die in auffällig großer Zahl nach dem Markteintritt der neueren Nicht-Statin-Lipidsenker erschienen sind.