Zusammenfassung: Drei aktuelle große Studien (ARRIVE, ASCEND, ASPREE) belegen, dass Azetylsalizylsäure (ASS) in niedriger Dosierung (100 mg/d) zur Primärprävention kardiovaskulärer Erkrankungen bei gesunden älteren Menschen (> 70 Jahre) und Menschen mit moderat erhöhtem kardiovaskulärem Risiko nicht wirksamer ist als Plazebo. Auch in der Hochrisikogruppe der Diabetiker ist niedrig dosierte ASS nur gering wirksam (Number Needed to Treat = 90 bei > 7 Jahren Anwendung). Diesem fehlenden bzw. geringen Nutzen von ASS steht ein zwar insgesamt geringes, aber im Vergleich zu Plazebo signifikant höheres Blutungsrisiko gegenüber und bei älteren Menschen sogar ein höheres Sterberisiko. Deshalb ist ein regelhafter Einsatz von ASS zur Primärprävention bei den genannten Populationen abzulehnen. Ein protektiver Effekt von ASS auf die Entstehung von Darmkrebs war in diesen Studien nicht nachweisbar, wird allerdings auch nur für die längerfristige Einnahme diskutiert. Die Einnahme von Omega-3-Fettsäuren (1 g/d) ergab nach 7,4 Jahren hinsichtlich der kardiovaskulären Prävention keine größere Wirksamkeit als Plazebo.
Anders als zur Sekundärprävention kardiovaskulärer Erkrankungen (CVD) wird ASS in den Leitlinien der europäischen kardiologischen Gesellschaft (ESC) zur Primärprävention nicht allgemein empfohlen, auch nicht bei Diabetikern, die ein 2-3fach höheres Risiko für CVD haben (1). Trotzdem ist zu beobachten, dass bei Patienten mit Diabetes, Hypertonie oder mit metabolischem Syndrom ohne vorausgegangenes kardiovaskuläres Ereignis ASS verordnet und auch von anderen Fachgesellschaften (z.B. der U.S. Preventive Services Task Force) zur Primärprävention empfohlen wird (2). Nun werden die nicht ausgesprochenen Empfehlungen der ESC für ASS durch drei randomisierte kontrollierte Studien bestätigt. Die Ergebnisse der ARRIVE- und die ASCEND-Studien wurden Ende August auf der Jahrestagung der ESC vorgestellt und zeitgleich im Lancet sowie dem N. Engl. J. Med. veröffentlicht (3, 4) und die Ergebnisse der ASPREE-Studie am 16. September ebenfalls im N. Engl. J. Med. publiziert – kurioserweise in drei getrennten Mitteilungen mit den gleichen Erst- und Letztautoren zu Letalität, kardiovaskulären und Blutungsereignissen sowie behinderungsfreiem Überleben (5, 6). Alle drei Studien liefern nicht nur wichtige Informationen zu Nutzen und Risiken von ASS in der Primärprävention bei verschiedenen Populationen, sondern auch zur Validität der etablierten Risiko-Kalkulatoren oder zur Frage, ob ASS Dickdarmkarzinome verhindert (vgl. 7).
ARRIVE-Studie: In diese von Bayer finanzierte Studie (3) wurden zwischen 2007-2016 insgesamt 12.546 Patienten mit moderatem kardiovaskulärem Risiko an 501 Hausarztpraxen in Europa und den USA eingeschlossen. Einschlusskriterien waren: Männer ≥ 55 Jahre mit 2-4 Risikofaktoren und Frauen ≥ 60 Jahre mit ≥ 3 Risikofaktoren. Als Risikofaktoren galten: Gesamt-Cholesterin (Gesamt-C) > 200 mg/dl (Männer) bzw. > 240 mg/dl (Frauen); LDL-C > 130 mg/dl (Männer) bzw. > 160 mg/dl (Frauen); HDL-C < 40 mg/dl (jeweils mit oder ohne Cholesterinsenker); Rauchen innerhalb der letzten 12 Monate; systolischer Blutdruck (RR) > 140 mm Hg sowie darüber hinaus die Einnahme eines Antihypertensivums und eine positive Familienanamnese für CVD.
Das 10-Jahres-Risiko für das Auftreten eines kardiovaskulären Ereignisses (CVE) sollte zwischen 10-20% liegen. Die Berechnung erfolgte mit zwei etablierten Risikorechnern (Framingham- und ASCVD-Risk Score; 8, 9). Nach dem Framingham-Rechner hat beispielsweise ein 60-jähriger nicht rauchender Mann mit medikamentös ausreichend behandelter Hypertonie, einem Gesamt-C von 280 mg/dl und einem HDL-C von 60 mg/dl ein 10-Jahresrisiko für Tod oder Herzinfarkt von 14,7%. Raucht der beschriebene Mann, dann steigt sein Risiko auf 22,1% (hohes Risiko); damit wäre er nicht in ARRIVE eingeschlossen worden.
Ausgeschlossen wurden u.a. Patienten mit einer manifesten CVD (Z.n. Schlaganfall, Myokardinfarkt etc.), Diabetes oder mit hohem Blutungsrisiko. Eine klinisch stumme Atherosklerose (z.B. ein Nachweis von Karotisplaques; nach der ESC ein sog. „Risk-Modifier“, der die Patienten in die Hochrisikogruppe bringt) war kein explizites Ausschlusskriterium, es sei denn, die behandelnden Ärzte sahen eine „definitive Indikation“ für eine Hemmung der Thrombozytenfunktion.
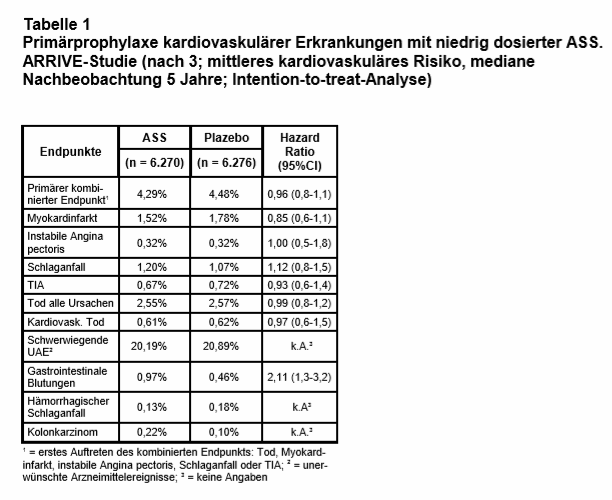
Die Patienten erhielten randomisiert und doppelblind 100 mg/d magensaftresistente ASS (n = 6.270) oder Plazebo (n = 6.276). Primärer Studienendpunkt war das erste Auftreten eines CVE: Tod, Myokardinfarkt, instabile Angina, Schlaganfall oder TIA. Sicherheits-Endpunkte waren Blutungen und andere unerwünschte Ereignisse (UAE). Die mediane Nachbeobachtungszeit betrug 60 Monate.
Ergebnisse: Von 15.823 gescreenten Patienten wurden 12.546 eingeschlossen (79%). Das mittlere Alter betrug 63,9 Jahre, 70,5% waren Männer, 28,6% aktive Raucher, 58,2% hatten erhöhte Cholesterinwerte, 62,6% einen erhöhten systolischen RR (Median 145 mm Hg), Antihypertensiva nahmen 65% ein und 49% einen Cholesterinsenker. 3.718 Patienten (29,6%) beendeten die Studie vorzeitig (29,4% in der ASS- und 29,9% in der Plazebogruppe). Die häufigsten Gründe hierfür waren: Rücknahme der Einwilligung (13,4%), unvollständige Nachbeobachtung oder „andere Gründe“ (10,7%), Tod oder „Lost to Follow-Up“ (4,6%).
Der primäre Endpunkt trat mit 4,38% wesentlich seltener auf als erwartet (kalkuliert war > 13%), sodass das Studienprotokoll nachträglich mehrfach verändert wurde, um auf eine ausreichende Fallzahl zu kommen, z.B. Erweiterung des kombinierten primären Endpunkts um instabile Angina und TIA, Verlängerung der Nachbeobachtungsphase u.a. Die Ergebnisse hinsichtlich der Wirksamkeit unterschieden sich nicht signifikant zwischen ASS und Plazebo nach „intention to treat“ (s. Tab. 1). Auch bei den Subgruppen fand sich keine, die von ASS profitiert hätte (Männer/Frauen, Ältere/Jüngere, Raucher/Nichtraucher, hoher/niedriger BMI, adhärente Patienten, mit/ohne Statin-Einnahme usw.).
Auch in einer vordefinierten Per-Protokoll-Analyse mit 7.702 Patienten, die während der gesamten Studiendauer „on treatment“ waren (61,3%), zeigte sich kein signifikanter Vorteil von ASS (3,4% vs. 4,19%; Hazard Ratio = HR: 0,81; 95%-Konfidenzintervall = CI: 0,64-1,02; p = 0,07). Allein beim sekundären Endpunkt „Myokardinfarkt“ konnte per Protokoll ein Vorteil von ASS errechnet werden (0,98% vs. 1,84%; HR: 0,53; CI: 0,36-0,79; p = 0,001).
Diesem nicht nachweisbaren Nutzen von ASS stand eine mehr als doppelt so hohe Blutungsrate gegenüber, besonders gastrointestinale Blutungen (vgl. Tab. 1). Insgesamt war das Blutungsrisiko mit knapp 0,2% pro Jahr jedoch niedrig, und die gefürchteten Hirnblutungen traten nicht häufiger ein als mit Plazebo. Es sei aber daran erinnert, dass Patienten mit erhöhtem Blutungsrisiko von der Studie ausgeschlossen waren.
Schwerwiegende UAE wurden in beiden Gruppen gleich häufig gemeldet: 20,1% vs. 20,8%. Es gab keine Hinweise darauf, dass eine bestimmte UAE unter ASS wesentlich häufiger auftrat, auch nicht gastrointestinale UAE (Dyspepsie 3,6% vs. 3,1%; gastroösophagealer Reflux 1,1% vs. 0,9%, Oberbauchschmerz 1,0% vs. 0,9%). Auch Dickdarmkarzinome waren unter ASS nicht seltener, sondern tendenziell sogar etwas häufiger als unter Plazebo (0,22% vs. 0,10%). Diese Ergebnisse sollen zu einem späteren Zeitpunkt noch detailliert publiziert werden.
ASCEND-Studie: Die zweite Studie zur Primärprävention mit ASS (4) wurde von der britischen Herzgesellschaft finanziert. ASCEND schloss in britischen Hausarztpraxen Diabetiker ≥ 40 Jahre (94% Typ-2-DM) ohne klinisch manifeste CVD ein. Diabetiker gelten als Hochrisikopatienten für ein CVE und waren in ARRIVE ausgeschlossen. Die Lipid- und Blutdruckwerte spielten bei der Auswahl der Patienten keine Rolle.
Es wurden insgesamt 423.000 Diabetiker angeschrieben, wovon 121.000 (29%) Interesse an der Studienteilnahme bekundeten. Letztlich wurden 15.480 Patienten (12,8%) eingeschlossen. Diese wurden zweifach randomisiert (factorial design), einmal zu 100 mg/d magensaftresistentes ASS-Präparat (n = 7.740) oder Plazebo (n = 7.740) und einmal zu 1 g/d Omega-3-Fettsäuren oder Plazebo. Primärer Studienendpunkt war für beide Behandlungen das erste Auftreten eines schwerwiegenden CVE (nicht tödlicher Myokardinfarkt, Schlaganfall, TIA, kardiovaskulärer Tod). Primärer Sicherheits-Endpunkt war das erste Auftreten einer Major-Blutung (bestätigte intrakranielle Blutung, Augenblutung mit Beeinträchtigung des Visus, sowie jede andere schwerwiegende Blutung, die zu einem Krankenhausaufenthalt, einer Bluttransfusion oder zum Tode führte). Auch die Inzidenz von Krebserkrankungen, besonders gastrointestinaler Tumore, zählte zu den sekundären Endpunkten. Die mittlere Nachbeobachtungszeit betrug 7,4 Jahre. Eine vollständige Nachbeobachtung lag bei 99% der Patienten vor. Die Adhärenz zur Studienmedikation wurde anhand eines Fragebogens mit 70% in beiden Armen geschätzt.
Ergebnisse: Die Patienten waren im Mittel 63,2 Jahre alt, 62,5% waren Männer. Die mediane Diabetesdauer betrug 7 Jahre. Es wurden 16% diätetisch, 58% mit oralen Antidiabetika und 25% mit Insulin behandelt. Schon vor der Studie nahmen 35% ASS ein (ersetzt durch die Studienmedikation) und 75% ein Statin, 8,3% waren aktive Raucher, 46% hatten einen Body-Mass-Index (BMI) ≥ 30. Das 5-Jahresrsiko für ein CVE wurde zu Studienbeginn bei 40% der Patienten als niedrig, bei 42% als moderat und bei 17% als hoch eingeschätzt. Für diese Kategorisierung wurde ein eigenes Rechenmodell (Poisson Regression) verwendet, welches Alter, Geschlecht, Raucherstatus, systolischen RR, BMI, Diabetesdauer und HbA1c-Wert beinhaltete.
Der primäre Endpunkt in Bezug auf die Wirksamkeit trat in der erwarteten Größenordnung bei 8,5% mit ASS und bei 9,6% mit Plazebo auf. Die Rate Ratio (RR) zu Gunsten von ASS betrug 0,88 (CI: 0,79-0,97; p = 0,01). Hieraus leitet sich eine „Number needed to treat“ (NNT) von 90 über 7,4 Jahre ab. Keine der drei Komponenten des kombinierten Endpunkts erreichte für sich allein statistische Signifikanz. Nach den Kaplan-Meier-Kurven entstanden die Vorteile von ASS gegen Plazebo in den ersten fünf Jahren, danach liefen die Kurven parallel. Subgruppen, die möglicherweise von ASS profitieren, waren: Männer (RR: 0,86), Diabetiker < 60 Jahre (RR: 0,79), Diabetesdauer < 9 Jahre (RR: 0,85) oder solche mit einem BMI ≥ 30 (RR: 0,76). Bemerkenswerterweise hatten Patienten mit einem hohen CV-Risiko-Score (RR: 0,94) und Patienten mit geringem Körpergewicht (RR: 1,17) den geringsten Nutzen von ASS.
Dem insgesamt geringen Nutzen stehen signifikant mehr sog. „Major-Blutungen“ unter ASS gegenüber: 4,1% vs. 3,2% (RR: 1,29; CI: 1,09-1,52; p = 0,003). Dies entspricht einer „Number Needed to Harm“ (NNH) von 111 über 7,4 Jahre. Die jährliche Blutungsrate unter ASS lag mit 0,5% mehr als doppelt so hoch wie in der ARRIVE-Studie. Es wurden insbesondere vermehrt gastrointestinale (1,8% vs. 1,3%) und „andere“ Major-Blutungen (1,0% vs. 0,6%) registriert, während Augenblutungen (0,7% vs. 0,8%) und intrakranielle Blutungen (0,7% vs. 0,6%) etwa gleich häufig auftraten. Günstige Effekte von ASS auf die Entstehung von Dickdarm- oder anderen Krebsarten waren auch in ASCEND nicht nachweisbar (2% in beiden Armen).
Die Ergebnisse zur präventiven kardiovaskulären Wirksamkeit von Omega-3-Fettsäuren (n-3; 1 g/d) bei Diabetikern ohne kardiovaskuläre Erkrankungen wurden zeitgleich veröffentlicht (10). Auch hier zeigten sich nach 7,4 Jahren keine Unterschiede zwischen Verum und Plazebo (primärer Endpunkt 8,9% vs. 9,2%; RR: 0,97).
ASPREE-Studie: Diese Studie (5, 6) schloss 19.114 gesunde ältere Menschen ohne kardiovaskuläre Vorerkrankungen in Australien (87%) und den USA ein (> 70 Jahre, bzw. ≥ 65 Jahre bei „Hispanics“ und Afroamerikanern; 56% Frauen). Ausgeschlossen wurden u.a. Menschen mit Demenz (modified Mini Mental State < 78/100), bedeutsamen körperlichen Behinderungen, Vorhofflimmern oder einer Vorbehandlung mit Gerinnungshemmern oder erhöhtem Blutungsrisiko. Von den Studienteilnehmern waren 58% im Alter von 65-74 Jahren, 38% im Alter von 75-84 Jahren und 4% > 84 Jahre alt. Sie erhielten entweder 100 mg/d ASS als magensaftresistentes Präparat oder Plazebo. Der primäre Endpunkt war zusammengesetzt aus Tod, neu diagnostizierter Demenz oder persistierender körperlicher Behinderung. Wichtigster sekundärer Endpunkt waren die Todesursachen (Krebs, CVD, Blutungen, andere Ursachen). Die Studie wurde vom Sponsor – dem australischen National Institute on Aging – nach einer Zwischenanalyse vorzeitig abgebrochen, da es sehr unwahrscheinlich war, dass die Interventionen mit ASS noch einen Nutzen hätten zeigen können.
Ergebnisse: Die Adhärenz zur Studienmedikation betrug am Studienende 62% (ASS) bzw. 64% (Plazebo). Die klinische Nachuntersuchung war bei > 98% komplett. Insgesamt starben während der medianen Nachbeobachtungszeit von 4,7 Jahren 5,5% der Studienteilnehmer. In der ASS-Gruppe war die Gesamtsterblichkeit knapp signifikant sogar höher (5,9% vs. 5,2%; HR: 1,14; CI: 1,01-1,29). Insbesondere die Krebs-Sterblichkeit war mit ASS relevant höher (3,1% vs. 2,3%; HR: 1,31; CI: 1,10-1,56), auch die am Dickdarmkarzinom (0,8 vs. 0,5/1.000 Personenjahre; HR: 1,7; CI: 1,02-3,06). Der erhoffte Schutz vor kardiovaskulären Ereignissen traf nicht ein. Die Wahrscheinlichkeit für die Erstmanifestation einer kardiovaskulären Erkrankung wurde durch ASS nicht vermindert (10,7 vs. 11,3/1.000 Personenjahre; HR: 0,95). Dagegen waren Blutungen – überwiegend Blutungen aus dem Gastrointestinaltrakt – signifikant häufiger: z.B. Major-Blutungen (8,6 vs. 6,2/1.000 Personenjahre; HR: 1,38; p < 0,001) und intrakranielle Blutungen (2,5 vs. 1,7/1.000 Personenjahre; HR: 1,5). Auch hinsichtlich der Entstehung einer Demenz (6,4 vs. 6,4/1.000 Personenjahre) oder einer anhaltenden Behinderung (3,9 vs. 4,8/1.000 Patientenjahre) ergab sich kein signifikanter Vorteil von ASS.
Wie in der ARRIVE-Studie wich auch in der ASPREE-Studie die tatsächliche Letalität erheblich von der erwarteten ab. In einem Simulationsmodell mit einer gematchten Population wurden 34,9 Todesfälle pro 1.000 Personenjahre berechnet, tatsächlich traten aber weniger als ein Drittel ein, nämlich 11,1.
Diese Beobachtung wird auch in einem Kommentar zur ARRIVE-Studie (11) thematisiert. Die überraschend niedrigen Ereignisraten sprächen dafür, dass sich das Management kardiovaskulärer Risiken in der Primärversorgung in den letzten Jahren erheblich verbessert haben muss. Zugleich sei die Validität der verwendeten Risikorechner stark in Frage zu stellen. Sie basieren auf älteren epidemiologischen Daten und scheinen das Gesamtrisiko, zumindest bei Nicht-Diabetikern und älteren Menschen, deutlich zu überschätzen. Der nicht nachweisbare Nutzen von ASS könnte auch in einem Adhärenzproblem begründet sein (knapp 30% Abbrechrate in ARRIVE und 35% in ASPREE) oder einer unangemessenen ASS-Dosis. Die Patienten in ARRIVE wogen zwischen 43 und 177 kg, erhielten aber alle gleichermaßen 100 mg/d ASS. Es sei pharmakologisch nicht plausibel, dass diese Dosis bei allen Patienten gleich wirksam ist, schreiben die Kommentatoren. Die Diskussion um die richtige ASS-Dosis flammt also wieder auf und wird durch eine aktuelle Metaanalyse befeuert, die 11 RCT mit 116.000 Patienten einschloss (9 zur Primär- und 4 zur Sekundärprävention mit ASS). Demnach soll eine Wirksamkeit von niedrigen ASS-Dosen (75-100 mg/d) in der Primärprävention nur bei Patienten < 70 kg nachweisbar sein, nicht aber bei den Probanden mit einem Gewicht ≥ 70 kg (80% der Männer und knapp die Hälfte aller Frauen; 12). Dem widersprechen allerdings die Subgruppenanalysen von ARRIVE und ASPREE; hiernach hatten weder Norm- noch Untergewichtige einen größeren Nutzen von ASS als Übergewichtige.
Während die Unwirksamkeit von Omega-3-Fettsäuren-Supplementen zur Prävention von CVE jetzt wohl endgültig feststehen dürfte, müsse man hinsichtlich der Beurteilung einer (fehlenden) präventiven Wirkung von ASS für die Entstehung von Dickdarmkrebs noch zurückhaltend sein und eine längere Nachbeobachtung abwarten. Wir bleiben daher bei unserer Empfehlung von 2010 und 2011. Demnach kann ASS bei Patienten mit sehr hohem Risiko für Kolonkarzinom als Ergänzung zu den üblichen Überwachungsmaßnahmen eingesetzt werden (vgl. 13). Dabei muss ASS (mindestens 75 mg/d) langjährig (> 5 Jahre) eingenommen werden, um die Inzidenz und Letalität des Kolonkarzinoms zu senken (vgl. 14). Ob Menschen mit niedrigem oder moderat erhöhtem Risiko für Kolonkarzinom überhaupt von ASS profitieren, ist sehr fraglich.
Literatur
- Piepoli, M.F., et al.: Eur. Heart J. 2016, 37, 2315. Link zur Quelle
- Bibbins-Domingo, K., et al.: Ann. Intern. Med. 2017, 166, 565. Link zur Quelle
- Gaziano, J.M., et al. (ARRIVE = Aspirin to Reduce Risk of Initial Vascular Events): Lancet 2018, first online 26.8.2018. Link zur Quelle
- The ASCEND Study Collaborative Group (A Study of Cardiovascular Events iN Diabetes): N. Engl. J. Med. 2018, first online 26.8.2018. Link zur Quelle
- McNeil, J.J., et al. (ASPREE = ASPirin in Reducing Events in the Elderly): N. Engl. J. Med. 2018, Sep. 16. Link zur Quelle . Link zur Quelle . Link zur Quelle
- McNeil, J.J., et al. (ASPREE = ASPirin in Reducing Events in the Elderly): J. Gerontol. A Biol. Sci. Med. Sci. 2017, 72, 1586. Link zur Quelle
- AMB 2010, 44, 93. Link zur Quelle
- https://www.mdcalc.com/framingham-coronary-heart-disease-risk-score Link zur Quelle
- http://www.cvriskcalculator.com/ Link zur Quelle
- The ASCEND Study Collaborative Group (A Study of Cardiovascular Events iN Diabetes): N. Engl. J. Med 2018, first online 26.8.2018. Link zur Quelle
- Capodanno, D., und Angiolillo, D.J.: Lancet 2018, August 26. Link zur Quelle
- Rothwell, P.M., et al.: Lancet 2018, 392, 387. Link zur Quelle
- AMB 2011, 45, 92b. Link zur Quelle
- AMB 2010, 44, 93. Link zur Quelle