Zusammenfassung: Ein unselektiertes Screening auf Vorhofflimmern in der gesunden Bevölkerung ist aus unserer Sicht abzulehnen, denn es führt zu vielen falsch positiven Befunden, die unnötige Untersuchungen zur Abklärung und Ängste nach sich ziehen. Es ist jedoch davon auszugehen, dass durch die zunehmende Anwendung implantierter oder tragbarer elektronischer Geräte die Inzidenz erkannter asymptomatischer Episoden von Vorhofflimmern künftig rasch steigen wird (sog. „device detected atrial fibrillation“). Die klinische Relevanz so erhobener Befunde ist noch unklar. Beobachtungsstudien weisen darauf hin, dass die optimale Schwelle für den Beginn einer Antikoagulation zur Prävention von Thromboembolien möglicherweise deutlich höher liegt (z.B. Episodendauer über 24 Std.) als bei symptomatischem Vorhofflimmern. Bis laufende prospektive Studien dazu mehr Klarheit bringen, muss auch bei einem relevanten CHAD2DS2-VASc-Score individuell über eine Antikoagulation entschieden werden.
Die Apple Heart Study (AHS) fand vor und nach ihrer Präsentation beim diesjährigen Jahreskongress des American College of Cardiology (ACC) ein sehr großes Medienecho. Wir haben bereits im Vorfeld das Ziel dieser Studie erwähnt (1). Sie untersuchte, mit welcher Spezifität eine Smartwatch (Fa. Apple) mittels Photoplethysmographie und zusammen mit einer speziellen Softwareapplikation („AHS-App“) in der Lage ist, Vorhofflimmern (Vofli) zu erkennen (2). Insgesamt folgten 419.297 US-amerikanische Erwachsene (Alter > 22 Jahre; mittleres Alter 40 Jahre; ca. 25.000 > 65 Jahre) der Einladung des Herstellers, an dieser als „Proof-of-Concept“ angelegten, reinen Beobachtungsstudie ohne Kontrollgruppe teilzunehmen. Es ergab sich ein positiv-prädiktiver Wert von 84% für das korrekte Erkennen von Vofli durch die Smartwatch (= primärer Endpunkt). Dies traf allerdings nur zu für eine sehr selektierte Gruppe von 450 Teilnehmern, die – wie im Studiendesign vorgesehen – gleichzeitig mit der Smartwatch ein Langzeit-EKG-Gerät als Referenz für eine Woche trugen. Zwar erhielten während der initialen 8-monatigen Screeningphase 0,5% der gesamten Teilnehmer (n = 2.162) Meldungen der Smartwatch über potenzielle Arrhythmien (bei den ca. 200.000 Teilnehmern < 40 Jahre waren es 0,16%; bei den ca. 25.000 Teilnehmern ≥ 65 Jahre 3,2%), aber nur etwa die Hälfte von diesen nahm Kontakt mit einem Studienarzt (Telemediziner) auf. Nach zusätzlicher Prüfung wurden Langzeit-EKG-Geräte an 658 Teilnehmer versandt; diese wurden nach der vorgesehenen einwöchigen Tragezeit aber nur von 450 Teilnehmern zurückgeschickt. Die ab 2019 geplante randomisierte Studie HEARTLINE soll nun harte klinische Endpunkte eines Vofli-Screenings mit Hilfe der Apple-Smartwatch bei Menschen ≥ 65 Jahre untersuchen.
Der oben erwähnte positiv prädiktive Wert von 84% wird zwar in Fach- und Laienmedien ausgiebig kolportiert, jedoch wird die allgemeine praktische Bedeutung dieses Befundes in der Prävention von Schlaganfällen sehr kontrovers gesehen. Die Prävalenz und Inzidenz von Vofli ist bei den eher jungen und gesunden Smartwatch-Trägern nämlich gering. Deshalb sind diese grundsätzlich keine geeignete Zielgruppe für ein solches Screening. Der positiv-prädiktive Wert der initialen 2.162 Arrhythmie-Meldungen der Smartwatches in der gesamten Studienpopulation bleibt unklar. Bei einem unselektierten Screening der gesunden Bevölkerung ist jedenfalls mit einer großen absoluten Zahl falsch-positiver Befunde zu rechnen. Kritiker weisen darauf hin, dass unklare und falsche Alarme zusätzliche Maßnahmen nach sich ziehen. Dadurch werden die ohnehin schon knappen Ressourcen öffentlicher Gesundheitssysteme, die in anderen Bereichen viel dringender benötigt werden, unnötig verbraucht (3). Überdiagnostik kann zu Übertherapie mit unnötigen Risiken führen: Etwa ein Drittel aller AHS-Teilnehmer, die initial Meldungen über potenzielle Arrhythmien erhielten, hatten einen CHAD2DS2-VASc-Score ≥ 2. Bei diesem Wert ist „paroxysmales Vofli“ grundsätzlich eine Indikation zur dauerhaften oralen Antikoagulation (OAK; mit Vitamin-K-Antagonisten = VKA oder direkten oralen Antikoagulanzien = DOAK). Die aktuelle Empfehlung für eine OAK bei Vofli ist: CHAD2DS2-VASc-Score bei Männern ≥ 2; bei Frauen ≥ 3 (vgl. 4).
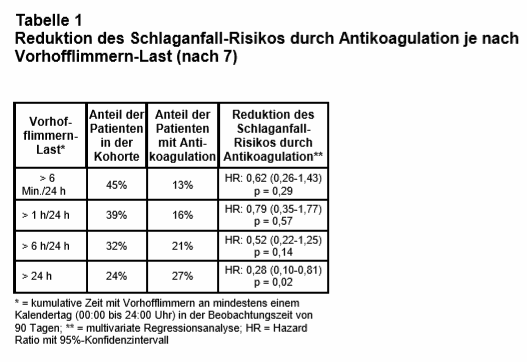
Von den AHS-Teilnehmern, bei denen Vofli erkannt wurde, hatten 89% Episoden, die länger als eine Stunde anhielten. Ab welcher „Vofli-Last“ (Dauer und Häufigkeit der Vofli-Paroxysmen) eine OAK aber tatsächlich eine positive Nutzen-Risiko-Relation hat, ist ebenfalls noch völlig unklar (5). Die European Heart Rhythm Association empfiehlt in einem aktuellen Konsensusdokument – auf Basis von Beobachtungsstudien – bei einem durch ein Gerät erkannten, subklinischen, also asymptomatischem Vofli („device detected atrial fibrillation“) einen Grenzwert von 5,5 Stunden Vofli-Dauer pro Tag, ab dem bei einem CHAD2DS2-VASc-Score ≥ 2 bei Männern bzw. ≥ 3 bei Frauen eine OAK eingeleitet werden sollte (6). Einer aktuell in Circulation erschienenen Studie von Perino et al. (7) zufolge könnte dieser Grenzwert aber auch deutlich höher liegen. In diese bevölkerungsbasierte retrospektive Kohortenstudie auf Basis der Veterans Affairs (VA) Datenbanken wurden 10.212 Patienten mit elektronischen kardialen Implantaten (Schrittmacher, Defibrillatoren) und folgenden Befunden eingeschlossen: erkannte Vofli-Last von > 6 Min./24 Std. im Telemonitoring von 2011 bis 2014, CHAD2DS2-VASc-Score ≥ 2, keine Schlaganfallanamnese und ohne Antikoagulation während der vergangenen 2 Jahre. Es wurde analysiert, wie viele Patienten nach einem „Device-erkannten“ neuen Vofli innerhalb von 90 Tagen eine Antikoagulation erhalten hatten (primärer Endpunkt); außerdem wurden die Assoziationen von OAK-Verschreibung, Schlaganfall und Vofli-Last untersucht. Der Anteil von Patienten, bei denen Vofli erkannt wurde, war hoch: So fand sich bei knapp der Hälfte der Patienten an mindestens einem Tag eine kumulative Vofli-Last von > 6 Min. innerhalb von 24 Std. und bei etwa einem Viertel mindestens ein Tag mit durchgehendem Vofli (s. Tab. 1). Der Anteil der Patienten, die von ihren behandelnden Kardiologen deshalb antikoaguliert wurden, war hingegen verhältnismäßig niedrig und lag – abhängig von der Vofli-Last – lediglich zwischen 13% und 27%. Die Ergebnisse der multivariaten Regressionsanalyse rechtfertigen vermutlich das in der Praxis zurückhaltende Vorgehen bei einem Großteil der Patienten: Sie zeigen eine statistisch signifikante Reduktion des Schlaganfallrisikos durch eine OAK nur in der Subgruppe von Patienten, die mindestens einen Tag mit durchgehendem Vofli hatten (Hazard Ratio: 0,28; 95%-Konfidenzintervall: 0,10-0,81; p = 0,02).
Die Populationen dieser beiden Studien sind nur eingeschränkt vergleichbar. In der Studie von Perino et al. handelt es sich um kardiologische Patienten, in der AHS-Studie wurden dagegen kaum selektierte, weitgehend gesunde Teilnehmer untersucht. Möglicherweise kann bei letzteren die Indikation zur OAK noch zurückhaltender gestellt werden. Es sei auch daran erinnert, dass Allgemeinmaßnahmen, z.B. das Management der klassischen kardiovaskulären Risikofaktoren, sich auch bei Vofli positiv auswirken (8).
Ein Vofli-Screening bei asymptomatischen Menschen oder unselektierten Patienten ist aus unserer Sicht nicht sinnvoll. Da sich durch ubiquitär verfügbare, persönliche elektronische Geräte die Grenzen zwischen Lifestyle und Medizin zunehmend verwischen werden, stellt sich aber leider nicht die Frage ob, sondern wann und in welchem Ausmaß Hausärzte, Kardiologen und Rhythmologen mit einem solchen „Screening“ konfrontiert werden – und wie darauf rational und im Sinne der Patienten reagiert werden kann.
Literatur
- Turakhia, M.P., et al. (AHS = Apple Heart Study): Am. Heart J. 2019, 207, 66. Link zur Quelle AMB 2018, 52, 39. Link zur Quelle
- Turakhia, M.P., et al. American College of Cardiology 68th Annual Scientific Session & Expo; March 16-18, 2019; New Orleans, Louisiana. Abstract 401-07.
- https://www.medscape.com/viewarticle/910509 Link zur Quelle
- AMB 2019, 53, 17. Link zur Quelle
- AMB 2017, 51, 85. Link zur Quelle
- Gorenek, B., et al.: Europace 2017, 19, 1556. Link zur Quelle
- Perino, A.C., et al.: Circulation 2019, Epub ahead of print. Link zur Quelle
- AMB 2014, 48, 55. Link zur Quelle