Unter „Orphan Medicinal Products” (OMP) bzw. ”Orphan drugs” versteht man Arzneimittel, die zur Behandlung seltener Krankheiten eingesetzt werden. Als selten gilt innerhalb der EU eine Krankheit, wenn sie nicht mehr als fünf pro 10 000 EU-Einwohner betrifft. Durch Anwendung der Definition auf Bürger der EU können auch weltweit häufige Erkrankungen, wie z.B. Tropenkrankheiten, für die EU-Behörden als selten gelten.
Nach Schätzungen der europäischen Arzneimittel-Agentur (EMEA) sind 5 000-8 000 aller bekannten Krankheiten als selten anzusehen (1). Wöchentlich kommen fünf neue hinzu, wobei eine immer weitere Unterteilung bereits bekannter Krankheiten auch zu diesem Zuwachs führt. Ein Beispiel hierfür sind viele Tumorerkrankungen.
80% der seltenen Krankheiten sind genetisch bedingt. Sehr häufig sind Kinder betroffen. 25% der Patienten müssen mehrere Jahre auf eine genaue Diagnose warten, und sehr häufig besteht hinsichtlich der Krankheit regional keine medizinische Erfahrung. Eine Übersicht über die als selten deklarierten Krankheiten erhält man auf der sehr lesenswerten Website: www.orpha.net. Auf dieser Internetseite kann man sich auch über Krankheitsdetails, Diagnoseverfahren, Spezialeinrichtungen und die weltweit laufenden Studien zu den einzelnen Krankheiten informieren.
Klassischerweise reicht das Spektrum seltener Krankheiten von
· Krankheiten mit geringer Inzidenz und kurzem Überleben (z.B. schweres kombiniertes Immundefizit-Syndrom).
· Krankheiten mit geringer Inzidenz und langem Überleben (Zystische Fibrose, Duchenne-Muskeldystrophie).
· Krankheiten mit relativ hoher Inzidenz und sehr kurzem Überleben (Pankreaskarzinom, Glioblastom).
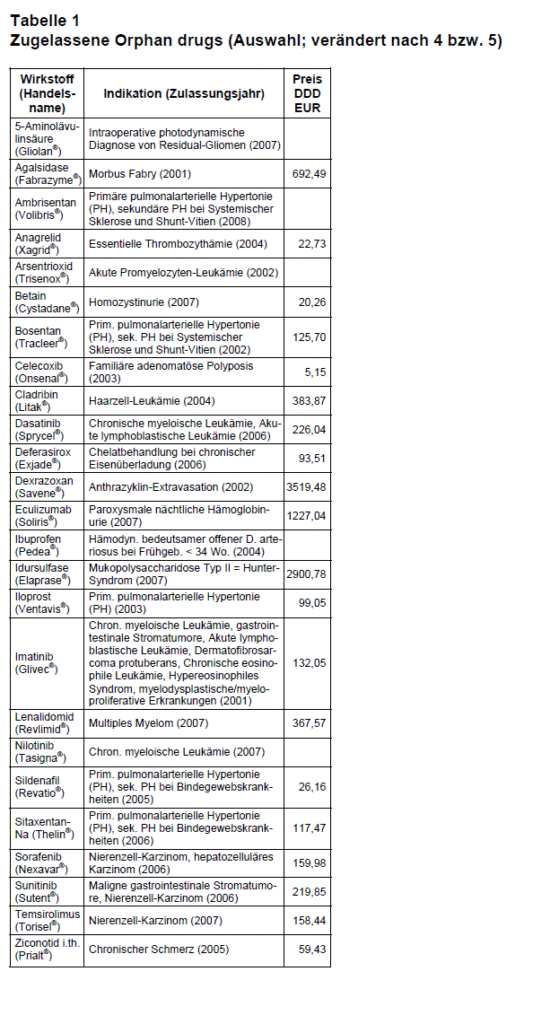
Medikamente gegen seltene Krankheiten wurden in der Vergangenheit gar nicht oder nur sehr selten zur Marktreife entwickelt. Einerseits, weil wegen geringer Patientenzahlen klinische Studien kaum realisiert werden konnten und andererseits, weil der Markt so klein ist, dass sich die Entwicklungskosten für Arzneimittelhersteller nicht lohnen. Um die notwendige Entwicklung solcher Arzneimittel für die Hersteller interessanter zu machen, kann einem Wirkstoff von der EMEA oder der amerikanischen Arzneimittelbehörde (FDA) der „Orphan-Drug-Status” erteilt werden. Dies garantiert dem Unternehmen ein zehnjähriges Markt-Exklusivrecht innerhalb der EU ab Marktzulassung, die Befreiung oder Ermäßigung von Gebühren beim Zulassungsverfahren und eine beschleunigte Bearbeitung des Zulassungsantrags. Die Bedingungen hierfür wurden 1999 in der EU geregelt (Verordnung 141/2000). Bei der EMEA wurde ein Ausschuss für Arzneimittel für seltene Erkrankungen gegründet (COMP; 2). Die Arzneimittelhersteller sollen ihre Pläne diesem Ausschuss vorlegen. Alle bislang eingereichten und ganz überwiegend positiv bewerteten Anträge (über 450) sind auf der Website der EMEA einzusehen (3). COMP kann die Hersteller auch dabei unterstützen, einen Prüfplan zu erstellen und EU-Gelder für die Entwicklung beisteuern. Der Antrag auf Zulassung der Substanz wird dann bei der CHMP (Committee for Medicinal Products for Human Use) eingereicht, wo innerhalb von 90 Tagen mit 2/3-Mehrheit darüber entschieden werden soll. Der endgültige Entscheid erfolgt dann nach einer weiteren Stellungnahme durch die EMEA innerhalb von 30 Tagen von der Europäischen Kommission. Mit Stand vom April 2008 wurden in Europa 46 Arzneimittel über diesen Weg als Orphan drugs zugelassen (Auswahl in Tab.1). Aus der Liste wird ersichtlich, dass die Mehrzahl der unter erleichterten Bedingungen zugelassenen Orphan drugs in der onkologischen Therapie eingesetzt werden.
Die Preise für diese Arzneimittel sind teilweise exorbitant. Obwohl Arzneispezialitäten in Österreich – anders als in Deutschland – einer gesetzlichen Preisregelung unterliegen, werden die Preise von Orphan drugs von den Pharmaunternehmen bestimmt. Eine Dauertherapie von Morbus Fabry mit Fabrazyme® kostet in Deutschland und Österreich ca. 200 000 EUR pro Patient (70 kg) und Jahr. Anhand von Zahlen der österreichischen Apothekerkammer lässt sich feststellen, dass im Jahr 2006 nur sieben Personen in Österreich mit Fabrazyme® behandelt wurden (nach 4). Trotzdem kann ein Arzneimittel durch seinen hohen Preis für den Hersteller europaweit durchaus rentabel sein. So wurde Imatinib (Glivec®) zunächst für eine sehr begrenzte Indikation (chronische myeloische Leukämie, CML) zugelassen („Nische”). Heute ist Imatinib gleich für mehrere seltene Indikationen zugelassen (Philadelphia-Chromosom-positive akute lymphatische Leukämie, Erwachsene mit myelodysplastischen oder myeloproliferativen Erkrankungen und speziellen molekulargenetischen Veränderungen, Erwachsene mit malignen gastrointestinalen Stromatumoren oder nicht resezierbarem Dermatofibrosarcoma protuberans). Es hat sich mittlerweile zu einem „Orphan blockbuster” entwickelt. In Deutschland steht Glivec® an 8. Stelle der umsatzstärksten Medikamente (203 Mio. EUR 2007; 5). Ähnlich wie Glivec® sind ca. 10% aller Orphan drugs zu Blockbustern (Definition: > 1 Mrd. US$ Jahresumsatz) geworden. Würde man die seltenen Indikationen in einer Gruppe zusammenfassen, fielen möglicherweise die Kriterien für ein Orphan drug und damit die Marktexklusivrechte weg. Warum geschieht das nicht? Orphan drugs werden nicht nur bei der zugelassenen Indikation eingesetzt, sondern häufig auch Off label. Das ist sicher lukrativ für die Hersteller, sollte aber von den Krankenkassen kontrolliert werden. Orphan drugs sind mittlerweile nicht nur eine Chance für kleine Arzneimittelhersteller. Da die großen Hersteller in den letzten Jahren enorme Schwierigkeiten hatten, neue Wirkstoffe zu entwickeln und zugelassen zu bekommen, konzentrieren sie sich ebenfalls immer mehr auf den Markt mit teuren Nischenprodukten (6).
Ein weiteres Beispiel für Orphan drugs, die eine Ausweitung der Indikation und des Marktes erfahren haben, sind Arzneimittel gegen pulmonale Hypertonie. Für die seltene Indikation des primären Lungenhochdrucks gibt es bislang vier Orphan drugs (Bosentan = Tracleer®, Iloprost = Ventavis®, Sildenafil = Revatio®, Sitaxentan = Thelin®), die aber mittlerweile auch für alle anderen Formen der pulmonalen Hypertonie eingesetzt werden (Off label). Man sieht an diesem Beispiel, dass ein Exklusivitätsrecht auf dem Markt nicht vor Konkurrenz schützt.
Fazit: Orphan drugs sind Medikamente gegen sehr seltene Krankheiten mit einem vereinfachten Zulassungsverfahren. Mit dieser Regelung wollen die Zulassungsbehörden die Entwicklung solcher Arzneimittel fördern, die wegen geringer Patientenzahlen und dadurch zu geringer Nachfrage niemals in den Handel kämen. Mittlerweile hat sich der Markt mit Orphan drugs aber stark entwickelt, und es gibt unter ihnen nicht wenige Blockbuster. Durch zugelassene oder nicht zugelassene (Off label) Ausweitung der Indikationen ist der Markt mit Orphan drugs mittlerweile auch für die großen Arzneimittelhersteller lukrativ geworden, weil es – zumindest in Deutschland – keine Möglichkeit gibt, überprüfend und regulierend in die Preisgestaltung einzugreifen (ähnlich wie bei Finanzprodukten in den USA).
Literatur
- http://www.emea.europa.eu/pdfs/human/comp/29007207en.pdf Link zur Quelle
- http://ec.europa.eu/health/ph_threats/non_com/rare_6_de.print.htm Link zur Quelle
- http://www.emea.europa.eu/htms/human/orphans/opinions.htm Link zur Quelle
- Zenz, S.: Diplomarbeit IMC Fachhochschule Krems, 2008.
- Schwabe, U., und Paffrath, D.: Arzneiverordnungs-Report 2008. Springer, Berlin, Heidelberg, New York.
- Owens, J.: Nat. Rev. Drug Discov. 2007, 6, 99 Link zur Quelle. Erratum: Nat. Rev. Drug Discov. 2007, 6, 249.