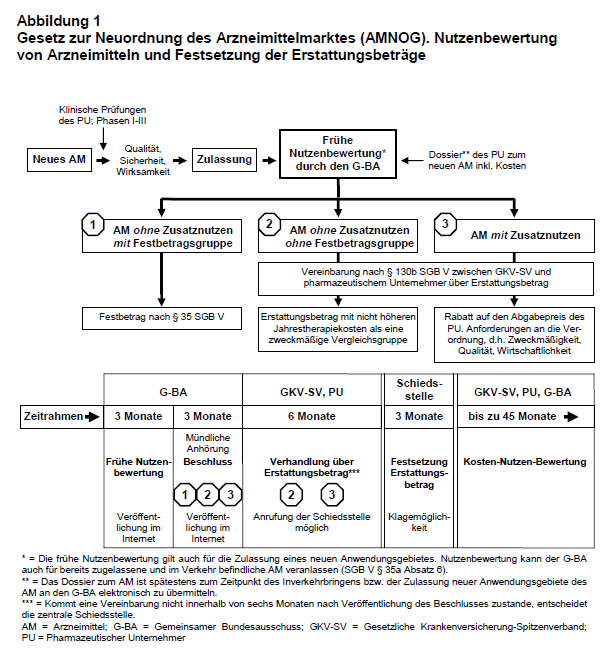
Die Arzneimittelausgaben der gesetzlichen Krankenversicherung (GKV) sind in den letzten Jahren in Deutschland weiter stark gestiegen und liegen seit dem Jahr 2001 über den Ausgaben für ärztliche Behandlung (1). Verursacht wird der Anstieg in erster Linie durch höhere Ausgaben für Arzneimittel ohne Festbetrag (Anstieg 2009 um 8,9%) sowie kostenintensive Spezialpräparate mit jährlich zweistelligen Wachstumsraten (1, 2, 23). Aus Sicht des Bundesministeriums für Gesundheit (BMG) besteht nun – auch unter dem zunehmenden Kostendruck im Gesundheitswesen – kurzfristiger Handlungsbedarf, dem die Fraktionen der CDU/CSU und FDP mit dem Gesetz zur Neuordnung des Arzneimittelmarktes in der GKV (AMNOG) nachgekommen sind (3). Laut einer Pressemitteilung des BMG beinhaltet das am 11. November 2010 verabschiedete AMNOG einen „Dreiklang aus strukturellen Veränderungen, dem Abbau von Überregulierung und kurzfristigen Einsparungen“ (4). Während fast alle anderen Länder in der Europäischen Union (EU) bereits seit einigen Jahren rasch nach der Zulassung in Verhandlungen mit dem pharmazeutischen Unternehmer (PU) einen am Nutzen orientierten Preis festsetzen, besteht in Deutschland bis heute die Möglichkeit der freien Preisbildung für patentgeschützte Arzneimittel und gleichzeitig dient Deutschland als Referenzland für Arzneimittelpreise in mehreren europäischen Staaten (1, 5, 24).
- Schwabe, U., und Paffrath, D.: Arzneiverordnungs-Report 2010. Springer-Verlag Berlin Heidelberg New York, 2010.
- AMB 2010, 44, 25. Link zur Quelle
- http://www.bundesgesundheitsministerium.de/Hintergrundpapier Link zur Quelle
- http://www.bundesgesundheitsministerium.de/Presse/ Link zur Quelle
- http://www.akdae.de/Stellungnahmen/BMG/20100609.pdf Link zur Quelle
- http://ec.europa.eu/health/ Link zur Quelle
- Eichler, H.-G., et al.: Nat. Rev. Drug Discov. 2010, 9, 277. Link zur Quelle
- Garattini, S., und Bertele, V.: BMJ 2007, 335, 803. Link zur Quelle
- Garattini, S., und Chalmers, I.: BMJ 2009, 338, b1025. Link zur Quelle
- Rothwell, P.M.: Lancet 2005, 365, 82. Link zur Quelle
- Garattini, S., und Bertele, V.: J. Hepatol. 2009, 51, 792. Link zur Quelle
- Wettermark, B., et al.: GGW 2010, 10, 24.
- Strohmeyer, T., et al.: Dtsch. Arztebl. 2009, 106, A-286; Link zur Quelle
- Francke, R., und Hart, D: MedR 2008, 26, 2.
- Roters, D.: NZS 2010, 19, 593.
- Windeler, J., et al.: Dtsch. Arztebl 2010, 107, A-2034; Link zur Quelle
- Garattini, L., et al.: Health Policy 2007, 85, 305. Link zur Quelle
- Wettermark, B., et al.: Appl. Health Econ. Health Policy 2009, 7, 137. Link zur Quelle
- Garattini, S., und Bertele, V.: BMJ 2010, 340, c1578. Link zur Quelle
- Rising, K., et al.: PLoS Medicine 2008, 5, e217. Link zur Quelle
- Schott, G., et al.: Z. Evid. Fortbild. Qual. Gesundhwes. 2010, 104, 314. Link zur Quelle
- McGauran, N., et al.: Trials 2010, 11, 37. Link zur Quelle
- AMB 2008, 42, 73. Link zur Quelle
- AMB 2008, 42, 25 Link zur Quelle und AMB 2008, 42, 65. Link zur Quelle