Zusammenfassung: ROCKET-AF- bzw. ARISTOTLE-Studie zeigen Rivaroxaban (Xarelto®) bzw. Apixaban (Eliquis®) als mögliche Alternativen zu Vitamin-K-Antagonisten zur Thromboembolie-Prophylaxe bei Vorhofflimmern. Eine große therapeutische Überlegenheit gegenüber Vitamin-K-Antagonisten ist nach unserer Einschätzung aufgrund dieser Studien nicht belegt. Langzeitdaten zur Wirksamkeit und Sicherheit fehlen, vor allem aber der Vergleich untereinander, auch der mit Dabigatran. Die beiden Substanzen sind ca. 30mal teurer als Warfarin oder Phenprocoumon. Sie kommen unseres Erachtens (nach ihrer zu erwartenden Zulassung bei Vorhofflimmern) als Ausweichpräparate in Betracht, wenn Phenprocoumon nicht vertragen wird, die Einstellung nur unbefriedigend gelingt oder die notwendigen Laborkontrollen unzumutbar sind. Gut eingestellte Patienten sollten nicht umgestellt werden. Der Vorteil liegt in der nicht erforderlichen labortechnischen Überwachung der Gerinnung, die Nachteile sind die hohen Preise, die fehlenden Langzeitdaten und die zahlreichen Ausschlusskriterien in den Studien. Die kurze Halbwertszeit aller Präparate führt bei unregelmäßiger Einnahme möglicherweise zu Wirkungsschwankungen, die genauer untersucht werden sollten. Bemerkenswerterweise korrelieren die empfohlenen Einnahmeintervalle nicht gut mit den Halbwertszeiten. Antidote gibt es bisher nicht. Die Hersteller und ihre Multiplikatoren preisen die neuen Antikoagulanzien mancherorts als eine Revolution in der Therapie. Das ist sicher übertrieben.
Nachdem Anfang August 2011 der orale Thrombinhemmer Dabigatran (Pradaxa®) auch in Europa für die Indikation Vorhofflimmern zugelassen wurde – wir haben mehrfach über die Substanz berichtet (1) – stehen zwei weitere Kandidaten, die oralen Faktor-Xa-Inhibitoren Rivaroxaban und Apixaban in den Startlöchern (2, 3, 8-12). Soeben sind die Studien mit den Akronymen ROCKET-AF (Rivaroxaban; 4) und ARISTOTLE (Apixaban; 12) zur Thromboembolie-Prophylaxe bei Vorhofflimmern erschienen.
Rivaroxaban: Rivaroxaban, ein Oxozolidinon-Abkömmling, hemmt direkt Faktor Xa und damit die gemeinsame Endstrecke der exogenen und endogenen plasmatischen Gerinnung. Die Halbwertszeit beträgt 7-11 h. Die Substanz ist bereits 2008 von der EMA für die Thromboembolie-Prophylaxe nach Hüft- oder Kniegelenkersatz zugelassen worden. Die Indikationserweiterung auf Vorhofflimmern wurde in den USA bereits 2010 nach der Vorstellung der ROCKET-AF-Studie auf der Jahrestagung der American Heart Association beantragt.
In dieser doppelt verblindeten, randomisierten, kontrollierten Studie erhielten insgesamt 14.264 Patienten (medianes Alter 73 Jahre; 39,7% Frauen) mit Vorhofflimmern und mäßigem bis hohem Schlaganfallrisiko entweder Warfarin (Dosierung in Abhängigkeit von der INR) oder Rivaroxaban (20 mg/d als fixe Einmaldosis oder 15 mg/d bei eingeschränkter Kreatinin-Clearance zwischen 30 und 45 ml/min). Das Schlaganfallrisiko wurde mittels des CHADS2-Scores beurteilt (s. Tab. 1; 5). Nur Patienten mit einem CHADS2-Score ≥ 2 wurden in die Studie aufgenommen (mittlerer CHADS2-Score 3,5; medianer 3,0). Wichtige Ausschlusskriterien waren Mitralstenose, künstliche Herzklappen, Vorhofmyxome, bekannte Thromben in den Herzhöhlen, floride Endokarditis, Blutung oder erhöhtes Blutungsrisiko, Thrombozytopenie < 90.000/µl, Blutdruck systolisch ≥ 180 mm Hg, diastolisch ≥ 100 mm Hg, Hämoglobin < 10 g/dl, Kontraindikation für Warfarin, Kreatinin-Clearance < 30 ml/min oder bekannte Lebererkrankung (z.B. ALT > dreimal oberer Normalwert).
Um die doppelte Verblindung nicht nur bei der Randomisierung, sondern auch während des gesamten Studienverlaufs zu gewährleisten, wurde auch bei den Rivaroxaban-Patienten, die Warfarin-Plazebo einnahmen, die INR gemessen. Die behandelnden Ärzte erhielten von einem unabhängigen Studienmonitor die realen INR-Werte der Warfarin-Gruppe bzw. die vorgeblichen INR-Werte der Rivaroxaban-Gruppe, nach denen sie die Warfarin- bzw. Warfarin-Plazebo-Dosis anpassten.
Der primäre Endpunkt war zusammengesetzt aus Schlaganfall (ischämisch oder hämorrhagisch) und systemischer Embolie. Als sekundäre Endpunkte wurde eine Reihe unterschiedlich zusammengesetzter und einzelner Endpunkte definiert, z.B. Schlaganfall, systemische Embolie, Tod aus kardiovaskulärer Ursache, Myokardinfarkt.
Nach einer medianen Nachbeobachtung von 707 Tagen zeigte sich in der Per-protocol-Analyse für die Rivaroxaban-Gruppe (6.958 Patienten Rivaroxaban, 7.004 Patienten Warfarin) eine signifikant geringere Ereignisrate pro 100 Patientenjahre hinsichtlich des primären Endpunkts: 1,7 vs. 2,2; Hazard ratio: 0,79; 95%-CI: 0,66-0,96. In der Intention-to-treat-Analyse, die wegen ihrer größeren Aussagekraft von den CONSORT-Richtlinien gefordert wird und heute üblich ist (6, 7), konnte allerdings nur die Nichtunterlegenheit von Rivaroxaban nachgewiesen werden (Ereignisrate 2,1 vs. 2,4; Hazard ratio: 0,88; 95%-CI: 0,75-1,03). Bemerkenswert ist, dass in beiden Gruppen viele Patienten die Therapie abbrachen: 23,7% in der Rivaroxaban- und 22,2% in der Warfarin-Gruppe. Immerhin brachen 8,3% der Rivaroxaban-Patienten die Therapie wegen einer UAW ab (7,0% in der Warfarin-Gruppe). Die mediane Therapiedauer betrug daher nur 590 Tage, war also deutlich kürzer als die Nachbeobachtungszeit von 707 Tagen. 93 Patienten wurden wegen Verstößen gegen Good Clinical Practice in einem Studienzentrum ausgeschlossen.
Als primärer Sicherheitsendpunkt wurden „größere und klinisch relevante Blutungen” festgelegt. Definition einer größeren Blutung war: Blutungen mit tödlichem Ausgang, intrakraniale, spinale, okulare, perikardiale, artikuläre, retroperitoneale oder intramuskuläre Blutungen mit Compartment-Syndrom, Hämoglobinabfall > 2 g/dl, Transfusion von mehr als zwei Erythrozytenkonzentraten oder Blutung mit permanentem Folgeschaden; die Definition sonstige klinisch relevante Blutung war: offene Blutung, die eine medizinische Intervention erforderte.
Größere und klinisch relevante Blutungen traten in der Rivaroxaban-Gruppe etwas häufiger auf als in der Warfarin-Gruppe (14,9% vs. 14,5%). Dies betraf auch größere Blutungen allein (3,6% vs. 3,4%). Diese geringen Unterschiede waren vor allem auf häufigere gastrointestinale Blutungen unter Rivaroxaban zurückzuführen (3,2% vs. 2,2%), dagegen waren intrakraniale Hämorrhagien unter Rivaroxaban signifikant seltener (0,5% vs. 0,7%; Hazard ratio: 0,67; 95%-CI: 0,47-0,93).
Auch die zusammengesetzten sekundären Endpunkte (Schlaganfall, Embolie oder kardiovaskulärer Tod bzw. diese mit Myokardinfarkt) zeigten einen leichten Vorteil für Rivaroxaban (Hazard ratio: 0,86; 95%-CI: 0,74-0,99 bzw. 0,85; 95%-CI: 0,74-0,96). Alle übrigen sekundären Zielkriterien sowie alle nicht-hämorrhagischen UAW traten in beiden Therapiegruppen etwa gleich häufig auf.
Die ROCKET-AF-Studie scheint also insgesamt zu belegen, dass Rivaroxaban der Antikoagulation mit Vitamin-K-Antagonisten zur Prophylaxe thromboembolischer Ereignisse bei Vorhofflimmern etwa ebenbürtig ist. Kritisch zu sehen sind die insgesamt etwas häufigeren Blutungskomplikationen und die höhere Therapieabbruch-Rate in der Rivaroxaban-Gruppe. Zudem sind die zahlreichen Ausschlusskriterien bei der Rekrutierung zu bedenken, will man die Studienergebnisse auf Patienten in der Praxis übertragen.
Die Studie wurde durch die Herstellerfirmen Johnson & Johnson sowie Bayer HealthCare finanziert. Die Autoren haben zahlreiche Interessenkonflikte, die am Ende der Publikation aufgelistet werden.
Apixaban: Apixaban ist wie Rivaroxaban ein direkter Faktor-Xa-Inhibitor. Er wird nahezu vollständig resorbiert, zu 75% metabolisiert und zu 25% renal ausgeschieden. Die Halbwertszeit beträgt 9-14 h. Eine Zulassung besteht bisher nur für die Prophylaxe thromboembolischer Ereignisse nach Hüft- oder Kniegelenkersatz.
Zu Apixaban bei Patienten mit Vorhofflimmern, die eine Kontraindikation gegen Vitamin-K-Antagonisten hatten, erschien bereits im Februar dieses Jahres im N. Engl. J. Med. die AVERROES-Studie, die wegen deutlicher Überlegenheit im Vergleich zu Acetylsalicylsäure (ASS) vorzeitig abgebrochen wurde (14). Ohne Steigerung des Blutungsrisikos waren Schlaganfälle und andere thromboembolische Ereignisse unter Apixaban im Vergleich zu ASS deutlich seltener: 1,6%/Jahr vs. 3,7%/Jahr. Jetzt wurde Apixaban in der ARISTOTLE-Studie erneut bei Vorhofflimmern untersucht, diesmal aber gegen Warfarin verglichen (12). Dazu wurden insgesamt 18.201 Patienten (medianes Alter 70 Jahre; 35% Frauen) mit Vorhofflimmern randomisiert und kontrolliert entweder mit zweimal 5 mg/d Apixaban (zweimal 2,5 mg/d bei Alter > 80 Jahre, Gewicht < 60 kg oder Kreatinin > 1,5 mg/dl) oder mit Warfarin (Ziel-INR zwischen 2 und 3) behandelt. Beide Gruppen erhielten die jeweils andere Tablette in Form eines Plazebos. Patienten, die Plazebo-Warfarin einnahmen, mussten wie die Verum-Warfarin-Patienten regelmäßig zur INR-Bestimmung kommen. Bei ihnen wurde die Plazebo-Warfarin-Dosis nach „Sham-INR-Werten” angepasst.
Der primäre Endpunkt der Wirkung war zusammengesetzt aus Schlaganfall und systemischer Thromboembolie, der sekundäre Hauptendpunkt war die Letalität. Die Studie wurde hinsichtlich der Effektivität als Nicht-Unterlegenheitsstudie konzipiert und „gepowert”. Als primärer Sicherheitsendpunkt wurde eine „schwere Blutung“ festgelegt. Sie war folgendermaßen definiert: Blutung mit mindestens 2 g/dl Hämoglobinabfall, Notwendigkeit von zwei oder mehr Erythrozytenkonzentraten, kritische Blutungslokalisation (gastrointestinal, zerebral) oder Blutung mit Todesfolge. Der mittlere CHADS2-Score (s. Tab. 1) betrug 2,1. 34% der Patienten hatten einen CHADS2-Score von 1 und 30,2% einen Score von ≥ 3. Patienten mit einer Kontraindikation gegen Warfarin, mit einem Serumkreatinin > 2,5 mg/dl oder einer Kreatinin-Clearance < 25 ml/min wurden ausgeschlossen.
Nach einer durchschnittlichen Beobachtungszeit von 1,8 Jahren lag die jährliche Ereignisrate des primären Endpunkts unter Apixaban signifikant niedriger als bei Warfarin (1,27%/Jahr vs. 1,60%/Jahr; Hazard ratio = HR: 0,79; 95%-Konfidenzintervall = CI: 0,66-0,95; p = 0,01; Intention-to-treat-Analyse). Die HR für Schlaganfall (0,79), hämorrhagischen Schlaganfall (0,51) und Letalität (0,89) ergaben ebenfalls signifikante Vorteile für Apixaban. Auch hinsichtlich der Sicherheitsendpunkte war Apixaban überlegen. Die Rate schwerer Blutungen betrug für Apixaban 2,13%/Jahr, für Warfarin 3,09%/Jahr (HR: 0,69; CI: 0,60-0,80). Unter Apixaban traten vor allem signifikant weniger intrakranielle Blutungen auf (HR: 0,42). Die gastrointestinalen Blutungen waren nicht signifikant seltener.
Für die Gesamtbewertung von Effektivität und Sicherheit wurde nachträglich ein kombinierter Endpunkt aus Schlaganfall, systemischer Thromboembolie, schwerer Blutung und Gesamtletalität gebildet. Auch hier war Apixaban überlegen: Ereignisrate 6,13%/Jahr unter Apixaban, 7,20%/Jahr unter Warfarin (HR: 0,85; CI: 0,78-0,92; p > 0,001). Bei den unerwünschten Wirkungen zeigte sich kein Unterschied zwischen Apixaban und Warfarin. Auch die Zahl der Patienten, die die Studienmedikation vorzeitig beendeten, war in beiden Gruppen nahezu identisch.
Als Kritikpunkte an dieser Studie sind anzumerken, dass sehr viele Patienten (34%) mit dem niedrigen CHADS2-Score von 1 eingeschlossen wurden, für die keine zwingende Indikation zur oralen Antikoagulation besteht. Bei Analyse dieser Subgruppe und auch bei Patienten mit einem Score von 2 zeigte sich beim primären Endpunkt kein signifikanter Vorteil gegenüber Warfarin. Weiterhin ist festzuhalten, dass die hohe Signifikanz nur durch die große Fallzahl erreicht wurde. Die Studie wurde als Nicht-Unterlegenheitsstudie gepowert und dann als Überlegenheitsstudie ausgewertet. Die absoluten Unterschiede sind daher auch sehr gering. Unsicherheit in den Ergebnissen birgt die INR-Einstellung in der Warfarin-Gruppe, die nur während 66% der Studienzeit im therapeutischen Zielbereich zwischen 2 und 3 lag. Die INR-Einstellung war also nicht optimal, und aus diesem Grund könnte Apixaban besser abgeschnitten haben. Vielleicht gilt dies besonders für die asiatisch-pazifischen Studienzentren, die bei der Subgruppenanalyse der geographischen Regionen als einzige einen hochsignifikanten Vorteil für Apixaban beim primären Endpunkt fanden (HR: 0,65). Für Europa lag die HR bei 1,0! Angaben zur Qualität der INR-Einstellung in den einzelnen Regionen werden nicht gemacht.
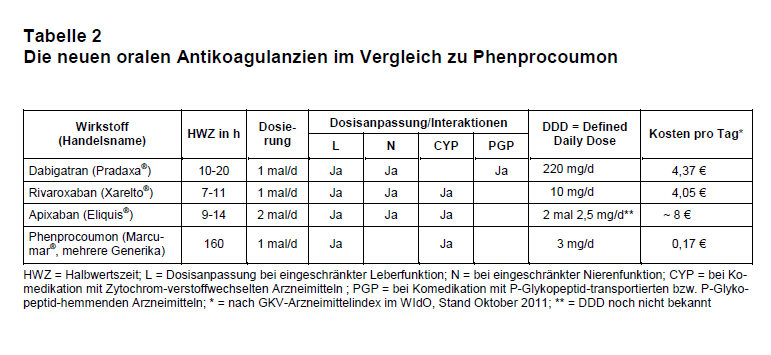
Insgesamt kann aus der ARISTOTLE-Studie (Sponsoren: Bristol-Myers Squibb und Pfizer) abgeleitet werden, dass Apixaban der herkömmlichen Antikoagulation mit Vitamin-K-Antagonisten wahrscheinlich nicht unterlegen und möglicherweise leicht überlegen ist. Wie bei Dabigatran und Rivaroxaban fehlen Langzeitdaten zur Wirkung und Sicherheit und vor allem vergleichende Untersuchungen der neuen Antikoagulanzien untereinander. Die Preise der neuen Antikoagulanzien sind extrem hoch verglichen mit Phenprocoumon (s. Tab. 2; 13).
Literatur
- AMB2008, 42, 09 Link zur Quelle ; AMB 2010, 44, 06b Link zur Quelle; AMB 2011, 45, 07. Link zur Quelle
- AMB2008, 42, 76 Link zur Quelle ; AMB 2010, 44, 01. Link zur Quelle
- http://www.akdae.de/Arzneimitteltherapie/WA/Archiv/Rivaroxaban.pdf Link zur Quelle
- Patel,M.R., et al. (ROCKETAF = Rivaroxaban Once daily oral direct factor Xa inhibition Comparedwith vitamin K antagonism for prevention of stroke and Embolism Trialin Atrial Fibrillation): N. Engl. J. Med. 2011, 365, 883. Link zur Quelle
- Gage, B.F., et al.: JAMA 2001, 285,2864. Link zur Quelle
- AMB 2001, 35, 46. Link zur Quelle
- Alexander,J.H., et al. (APPRAISE= Apixaban for PRevention of Acute Ischemic and SafetyEvents): Circulation 2009, 119, 2877. Link zur Quelle
- Alexander,J.H., et al. (APPRAISE-2= Apixaban for PRevention of Acute Ischemic and SafetyEvents-2): N. Engl. J. Med. 2011, 365, 699. Link zur Quelle
- Lassen, M.R., et al. (ADVANCE-2 = Apixaban versusenoxaparin for thromboprophylaxis after knee replacement-2): Lancet 2010, 375,807. Link zur Quelle
- Lassen, M.R., et al. (ADVANCE-3= Apixaban dosed orally vs. anticoagulation with injectable enoxaparin toprevent venous thromboembolism-3): N. Engl. J. Med. 2010, 363, 2487. Link zur Quelle
- Granger, C.B., et al. (ARISTOTLE = Apixaban forreduction in stroke and other thromboembolic events in atrial fibrillation): N.Engl. J. Med. 2011, 365, 981. Link zur Quelle
- Schwabe, U., undPaffrath, D. (Hrsg.): Arzneiverordnungs-Report 2011. Springer-Verlag BerlinHeidelberg New York 2011.
- Conolly, S.J., et al. (AVERROES = Apixabanversus acetylsalicylic acid to prevent stroke in atrial fibrillation patientswho have failed or are unsuitable for vitamin K antagonist treatment): N. Engl.J. Med. 2011, 364, 806. Link zur Quelle